三氟甲磺酸催化氮杂环丙烷与腈的区域选择性[3+2]环加成反应
刘 锐,李 兴,常宏宏,高文超,魏文珑
(太原理工大学 化学化工学院,太原 030024)
咪唑啉是一种重要的具有骨架结构的有机化合物,广泛存在于许多具有生物和药物活性(如消炎、止痛、治疗糖尿病、降血压,抗氧化和抗癌活性)的天然产物和生物活性分子中[1-6];此外,它们也已经被广泛用作有机合成的中间体[7-10]和不对称催化的配体[11-13]。近年来,咪唑啉重要的药用价值引起了科学家们广泛的兴趣,探索一种通用的、快速的、绿色的和高区域选择性的合成咪唑啉的方法是非常有必要的。
氮杂环丙烷与腈的[3+2]环加成反应已被证明是一种很有效的合成各种咪唑啉的方法,有许多科学家已在这方面做出了一些贡献;如利用过渡金属(包括Cu(OTf)2[14],ZnX2(X=Cl,Br,I)[15],Zn(OTf)2[16],Sc(OTf)3[17]和TiF4[18])作为催化剂或促进剂合成咪唑啉。路易斯酸BF3·Et2O[16-21]也能高效促进这类环加成反应。最近,我们课题组使用Bi(OTf)3作为催化剂也实现了该环加成反应[22]。到目前为止,尽管对于该合成方法的研究有了很大进展,但是它们中许多使用了昂贵且有毒的过渡金属试剂或者需要化学当量的促进剂,这样会产生大量的废物,降低原子利用率和反应步骤的经济性。然而,杂多酸催化的反应仍有广普性不好和低收率的缺点[23]。同时,尽管2当量的三氟甲磺酸作为促进剂在该反应中也得到了应用,但是酸用量大和底物广普性差(仅有5个底物)成为其明显的缺点[24]。因此,寻找绿色而实用的合成各种咪唑啉的方法,特别是考虑到原子利用率和步骤经济性等方面,仍是一个具有挑战性的课题。在此,我们报道一种通过非金属催化剂催化氮杂环丙烷与腈的[3+2]环加成反应来快速有效合成咪唑啉的方法,该方法可得到高收率的目标产物且具有很好的广普性。
1 实验
1.1 药品来源
本实验中所用化学药品除氮杂环丙烷和1-萘甲腈是参考相关文献方法合成外,其他均为市场购买所得。其中,原料N-对甲苯磺酰基氮杂环丙烷的合成分为两步:第一步由醛合成烯烃,第二步由烯烃合成N-对甲苯磺酰基氮杂环丙烷。具体方法如下。
第一步:醛合成烯烃。
本实验中所用的烯烃均使用同样的合成方法,以图1所示的合成苯乙烯反应式为例[25]:
图1以苯甲醛为原料合成苯乙烯
Fig.1 Synthesis of styrene using benzaldehyde as raw material
实验步骤:在25 mL圆底瓶中加入无水1,4-二氧六环(5 mL)、溴化三苯基甲基磷(2.1 g,6 mmol)和碳酸钾(1.1 g,8 mmol),搅拌均匀,随后加入苯甲醛(5 mmol),在回流状态下搅拌约16 h;经TLC薄层色谱检测反应完成后,冷却反应体系至室温,过滤掉不溶物,将滤液用无水硫酸镁干燥,减压浓缩;粗产品经柱层析色谱分离提纯可得纯的苯乙烯为无色透明液体。
第二步:烯烃合成N-对甲苯磺酰基氮杂环丙烷
(方法一)本文实验中所使用的芳香族N-对甲苯磺酰基氮杂环丙烷均使用同样的合成方法,以图2所示合成2-苯基-N-对甲苯磺酰基氮杂环丙烷的加成反应为例[26]。
图2以苯乙烯为原料合成2-苯基-N-对甲苯磺酰基氮杂环丙烷
Fig.2 Synthesis of N-tosyl-2-phenylaziridine using styrene as raw material
实验步骤:在50 mL单口烧瓶中加入三水合氯胺-T(3.37 g,12 mmol)、碘(0.25 g,1.0 mmol)、10 mL乙腈和10 mL pH=6.86的磷酸缓冲溶液,搅拌均匀,随后加入苯乙烯(1.15 mL,10 mmol),在氮气环境下室温搅拌约10 h,经TLC薄层色谱检测反应完成后,在真空下旋蒸除去乙腈,加入适量硫代硫酸钠至体系褪去黄色变为乳白色,用二氯甲烷萃取萃取出有机相,无水硫酸钠干燥、减压浓缩,粗品经柱层析色谱分离提纯可得纯的苯乙烯氮杂环丙烷为白色固体,1H NMR(400 MHz,CDCl3)∶δ2.38(d,J=4.4 Hz,1H),2.43(s,3H,CH3),2.98(d,J=7.2 Hz,1H),3.76(dd,J=7.2,4.5 Hz,1H),7.20~7.23(m,2H,Ph-H),7.27~7.30(m,3H),7.32(d,J=8.0 Hz,2H),7.86(d,J=8.3 Hz,2H).
(方法二)本文实验中所使用的脂肪族N-对甲苯磺酰基氮杂环丙烷均使用同样的合成方法,以图3所示合成2,3-环己烷N-对甲苯磺酰基氮杂环丙烷的加成反应为例[27]。
图3以环己烯为原料合成2,3-环己烷N-对甲苯磺酰基氮杂环丙烷
Fig.3 Synthesis of 2,3-cyclohexane N-tosylaziridine using cyclohexene as raw material
实验步骤:在50 mL单口烧瓶中加入三水合氯胺-T(3.37 g,12 mmol)、碘(0.25 g,1.0 mmol)、四丁基溴化铵(TABA,0.32 g,1.0 mmol)和30 mL水,搅拌半小时后加入环己烯(1.01 mL,10 mmol),大气环境下室温(r.t.)搅拌约5 h,经TLC薄层色谱检测反应完成后,加入适量硫代硫酸钠至体系褪去黄色变为乳白色,用二氯甲烷萃取水中的有机物,无水硫酸钠干燥,减压浓缩,粗品经柱层析色谱分离提纯可得纯的环己烯氮杂为白色固体,1H NMR(400 MHz,CDCl3)∶δ1.14~1.21(m,2H),1.25~1.47(m,2H),1.79(dt,J=1.4,5.8 Hz,4H),2.44(s,3H,CH3),2.97(t,J=1.4 Hz,2H),7.32(d,J=8.1 Hz,2H,Ph-H),7.81(d,J=8.1 Hz,2H).
其中1-萘甲腈的具体合成方法如图4所示[28]。
图4以1-萘甲醛为原料合成1-萘甲腈
Fig.4 Synthesis of 1-naphthalenitrile using 1-naphthalene formaldehyde as raw material
实验步骤:25 mL圆底烧瓶中加入1-萘甲醛(2.0 mmol)、盐酸羟胺(3.7 mmol)和二甲基亚砜(DMSO,4 mL),在100 ℃下搅拌约30 min;经薄层色谱法(TLC)检测反应完成后,冷却至室温,加入20 mL水,并用乙酸乙酯萃取(直径3 m×20 mL),乙酸乙酯相减压浓缩,无水硫酸钠干燥;浓缩物用柱层析进行分离提纯,得纯的1-萘甲腈为无色液体。
1.2 反应步骤和纯化方法
氮杂环丙烷和芳香腈的合成步骤:反应试管中依次加入N-对甲苯磺酰基氮杂环丙烷、溶剂和芳香腈(1.0 mmol),并在0 ℃下加入三氟甲磺酸,反应体系在15 ℃下搅拌;经TLC薄层色谱检测反应完成后,经柱层析色谱得纯的目标产物咪唑啉。
氮杂环丙烷和乙腈的合成步骤:反应试管中加入N-对甲苯磺酰基氮杂环丙烷和乙腈,并在0 ℃下加入三氟甲磺酸,反应体系在15 ℃下搅拌;经TLC检测反应完成后,经柱层析色谱得纯的目标产物咪唑啉。
2 结果和讨论
2.1 最佳反应条件的选择
首先,选择N-对甲苯磺酰基-2-苯基氮杂环丙烷(1a)与乙腈(2a)的环加成反应作为标准反应来确定最佳酸催化剂,反应式见图5.在所筛选的酸中,发现产物收率随着酸度的增强而增高,且三氟甲磺酸是最有效的催化剂并得到62%的目标产物收率(表1,项目4 vs.项目1-3).
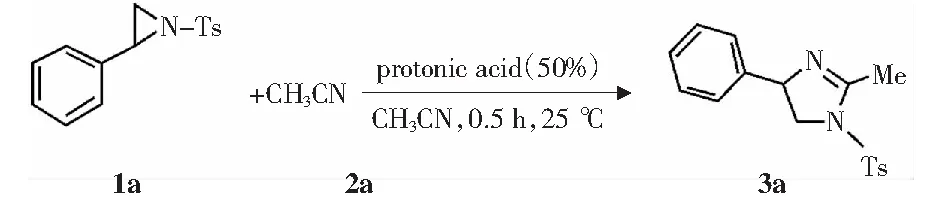
图5 不同酸催化的N-对甲苯磺酰基-2-苯基氮杂环丙烷与乙腈的[3+2]环加成反应Fig.5 [3+2] cycloaddition of N-tosyl-2-phenylaziridine with acetonitrile promoted by various protonicacids
经过初步筛选确定三氟甲磺酸为最合适的的催化剂后,还需确定其他反应条件来进一步完善该反应,结果列在图6和表2中。在乙腈作为溶剂的基础上,对催化剂用量的考察表明,当使用质量分数50%的三氟甲磺酸时收率明显提高到62%(表2,项目4 vs.项目1-3).
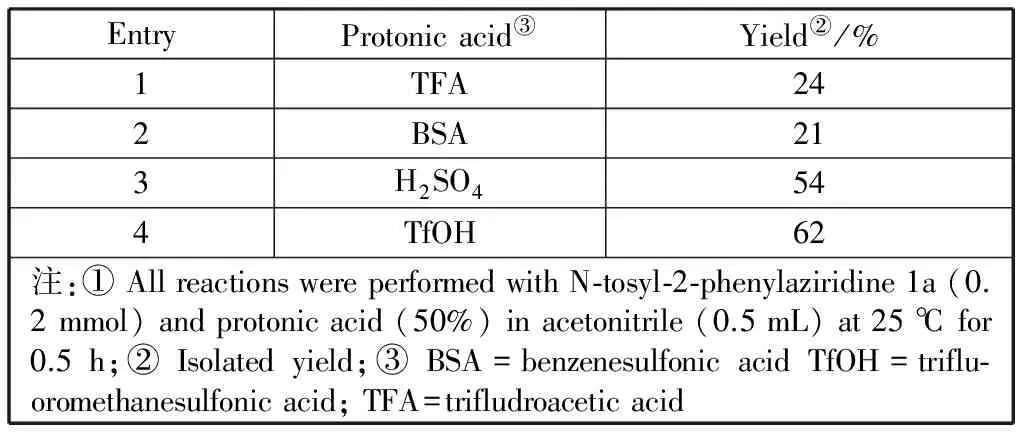
表1 不同酸催化的N-对甲苯磺酰基-2-苯基氮杂环丙烷与乙腈的[3+2]环加成反应①Table 1 [3+2] cycloaddition of N-tosyl-2-phenylaziridine with acetonitrile promoted by various protonicacids
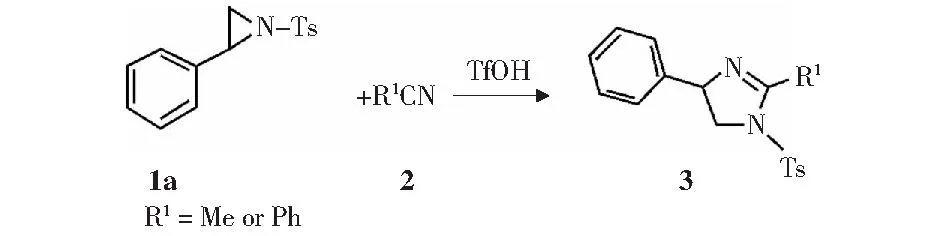
图6 其他反应条件的影响Fig.6 Effects of other reaction conditions

表2 其他反应条件的影响①Table 2 Effects of other reaction conditions
反应温度也明显影响着反应收率,且温度越高,收率越高(表2,项目6);在80 ℃的时候反应可得到89%的收率。令人满意的是,当反应使用1.0 mL的乙腈作溶剂时,产物收率可达97%(表2,项目7 vs.项目6).
为了减少后续反应中代替乙腈作为反应物的其它腈的量,选择N-对甲苯磺酰基-2-苯基氮杂环丙烷(1a)与苯腈的反应作为标准反应来考察其他溶剂。结果显示,在四氢呋喃溶剂中没有得到目标产物(表2,项目8),当使用硝基甲烷和二氯甲烷时,收率相对较低;使用1,2-二氯乙烷时能得到最好69%的收率(表2,项目11).当反应温度为10 ℃时,产物收率可达85%(表2,项目12 vs.项目11和项目13).
经过以上对条件的筛选,表明最佳反应条件是:0.2 mmol的N-对甲苯磺酰基氮杂环丙烷,质量分数50%的三氟甲磺酸,1.0 mL的乙腈作溶剂且反应温度为80 ℃.另外,如果其它的腈作为反应物,最佳反应条件是:0.2 mmol的N-对甲苯磺酰基-2-苯基氮杂环丙烷,5当量的腈,50%的三氟甲磺酸,1,2-二氯乙烷作溶剂且反应温度为80 ℃.
2.2 底物广普性研究
为了评估该反应在最佳反应条件下的广泛性和普适性,对各种N-对甲苯磺酰基氮杂环丙烷(1)与同时作为反应物和溶剂的乙腈(2a)反应进行了考察(见图7)。结果显示:该环加成反应适用于各种N-对甲苯磺酰基氮杂环丙烷,该反应相对于之前的相关报道需要更短的反应时间就可以拥有更广的底物范围。对于芳香族N-对甲苯磺酰基氮杂环丙烷,苯环上给电子基团甲基或甲氧基都很适用,能获得优秀收率的目标产物(表3,项目2-5);当N-对甲苯磺酰基氮杂环丙烷2位苯环上带有吸电子基团氯或溴时能得到良好收率的目标产物。因为位阻效应,苯环邻位和间位取代的N-对甲苯磺酰基氮杂环丙烷相比对位取代的得到相对较低的收率(表3,项目6-7 vs.项目8).值得注意的是,稠环1-萘基和2-萘基取代的N-对甲苯磺酰基氮杂环丙烷底物也很适用,均可得到96%的收率(表3,项目10-11).对于脂肪基取代的N-对甲苯磺酰基氮杂环丙烷,可得到中等收率的产物(表3,项目12-13).
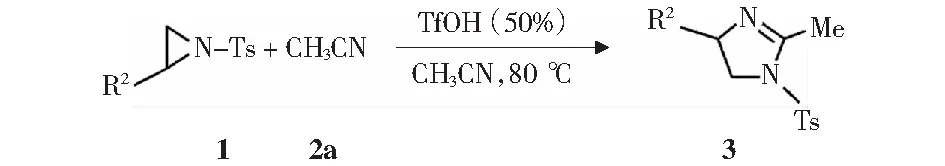
图7 各种N-对甲苯磺酰基氮杂环丙烷与乙腈反应的底物广普性研究Fig.7 Substrate scope for the [3+2] cycloaddition of various N-tosylaziridines with acetonitrile
接着,按表2中项目10提到的最佳反应条件对一系列腈与N-对甲苯磺酰基-2-苯基氮杂环丙烷的反应进行了考察(反应见图8),结果总结在表4中。

表3 各种N-对甲苯磺酰基氮杂环丙烷与乙腈反应的底物广普性研究①Table 3 Substrate scope for the [3+2] cycloaddition of various N-tosylaziridines with acetonitrile
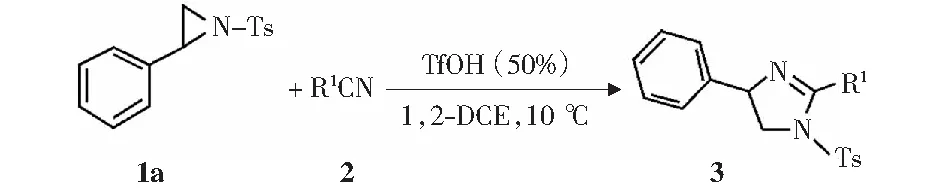
图8 N-对甲苯磺酰基-2-苯基氮杂环丙烷与各种腈的[3+2]环加成反应Fig.8 [3+2] Cycloaddition of N-tosyl-2-phenylaziridine with a variety of nitriles
各种含给电子基团(邻甲基、间甲基和对甲基)和吸电子基团(邻氟、间氟、对氟、邻氯和对氯)的腈底物均能获得良好到优秀收率的目标产物(表4,项目2-9);对于1-萘腈,双取代的苯腈和苯乙腈均能取得良好的收率(表4,项目10-13).
2.3 反应机理的探索
为探索该反应的反应机理,采用手性化合物(S)-2-苯基-1-对甲苯磺酰基氮杂环丙烷(1a')与乙腈(2a)作反应原料在三氟甲磺酸的催化作用下进行反应对反应产物的结构进行了考察(见图9).结果发现反应产物是外消旋产物3a'1和3a'2的混合物(6%),这表明该反应是通过SN1机理来进行的。

表4 N-对甲苯磺酰基-2-苯基氮杂环丙烷与各种腈的[3+2]环加成反应①Table 4 [3+2] Cycloaddition of N-tosyl-2-phenylaziridine with a variety of nitriles
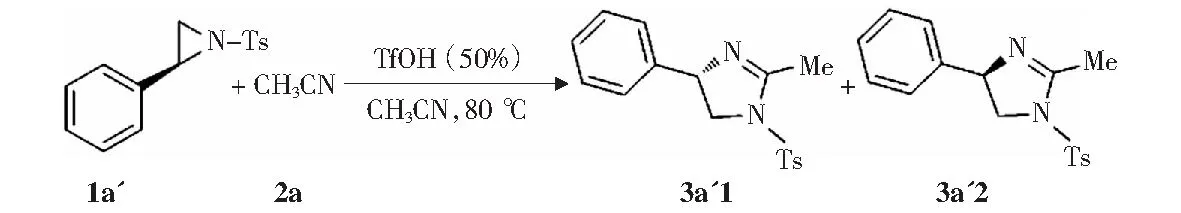
图9 机理研究Fig.9 Mechanistic studies
如图10所示,我们提出了合成目标环加成产物的一个推测机理。首先,N-对甲苯磺酰基氮杂环丙烷1上的氮原子经三氟甲磺酸质子化后形成更活泼的中间体5;然后,当R2基团为芳香基时,中间体5通过C—N键的断裂与腈反应得到中间体6,在此过程中,腈的氮原子是通过SN1的方式来攻击5的苄基位从而得到中间体6的,其中电子效应起了很大的作用;最后,中间体6通过[3+2]环加成反应产生目标产物3,同时释放出H+.如果R2基团是脂肪基时,会生成中间体7并最终得到目标产物4.
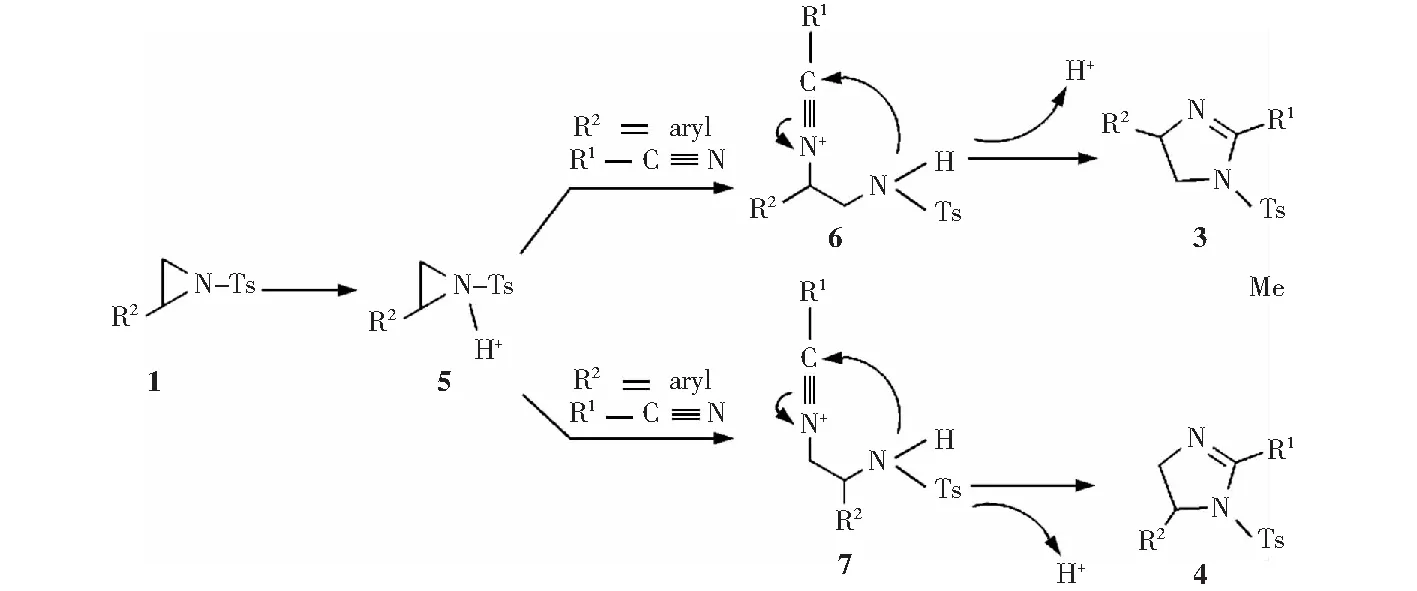
图10 三氟甲磺酸催化[3+2]环加成反应的机理推断Fig.10 Proposed mechanism of TfOH-catalysed [3+2] cycloaddition
3 结论
综上所述,我们已经建立了一种三氟甲磺酸催化的快速且有效的N-对甲苯磺酰基氮杂环丙烷与各种腈的[3+2]环加成反应,并通过该反应制得了收率高达97%的目标产物咪唑啉。这种方法的优点是采用了便宜且绿色的三氟甲磺酸作催化剂,产物收率高,底物广普性好,操作过程方便且反应时间短。

