西洛司特对慢性阻塞性肺病患者肺功能及细胞因子的影响
杨 博,赵俊英
(1.首都医科大学附属北京康复医院呼吸康复中心,北京 100144;2.中国中医科学院眼科医院,北京 100040)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)是当今最常见的慢性呼吸道疾病[1-2],由于多并发心血管、肌肉、骨骼、代谢和精神方面的疾病,在全球发病率和死亡率均较高并呈现上升趋势。COPD是一组疾病,在临床上常以进展性的气流受限为主要症状,是由于肺部对不良刺激的异常炎症反应所致[3-4]。西洛司特在COPD和哮喘的治疗中有一定功效[5-7]。本研究观察西洛司特治疗COPD患者的临床症状改善情况及肺功能和炎性因子水平的改变,评价西洛司特辅助治疗COPD的疗效。
1 资料与方法
1.1资料 2016年1月~2017年6月,选取就诊于首都医科大学附属北京康复医院的慢性阻塞性肺病患者108例,均符合COPD诊治规范中的诊断标准[8]。所纳入的患者肺功能均检测出不可逆的气流阻塞(在筛选时通过MDI 加储雾罐吸入200 μg沙丁胺醇 30±5 min 后,FEVl提高不超过10%和(或)绝对值提高≤200 mL)。采取随机对照的方法将其分为实验组与对照组,2组均给予常规治疗,实验组另口服西洛司特15 mg(葛兰素史克公司生产),每日2次,2组均治疗6个月。实验组56例,男38例,女18例;年龄54~78岁,平均65.18±3.92岁。对照组52例,男36 例,女 16例;年龄53~76岁,平均64.74±4.07岁。实验组与对照组的性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2治疗方法 观察治疗前与治疗6个月后的临床疗效变化。临床疗效指标分为4级[9]:临床控制:咳、痰、喘症状消失,病情稳定;显效:咳、痰、喘症状明显好转;有效:咳、痰、喘症状好转;无效:咳、痰、喘症状无改变或加重。在治疗前、治疗2个月和治疗6个月采用肺功能仪检测患者肺功能,通气功能指标(FEV1、FVC和FEV1/FVC)和容量指标(TLC、RV和RV/TLC);静脉采血法采集患者血清,快速离心,血清样本于-80 ℃存放。采用酶联免疫吸附法(ELISA)测定TNF-α、IL-6和IL-8水平,均按照试剂盒(深圳晶美公司)说明书进行测定[10]。

2 结果
2.1临床改善情况 经过2个月治疗的总有效率,实验组为91.07%,对照组为86.54%,差异无统计学意义(χ2=0.56,P>0.05);经过 6个月治疗的总有效率(控制+显效+有效),实验组为92.86%,对照组为78.85%,差异有统计学意义(χ2=4.43,P<0.05),见表1。
表12组患者治疗前后疗效比较
Tab.1 The curative effect of the 2 groups of patients before and after treatment
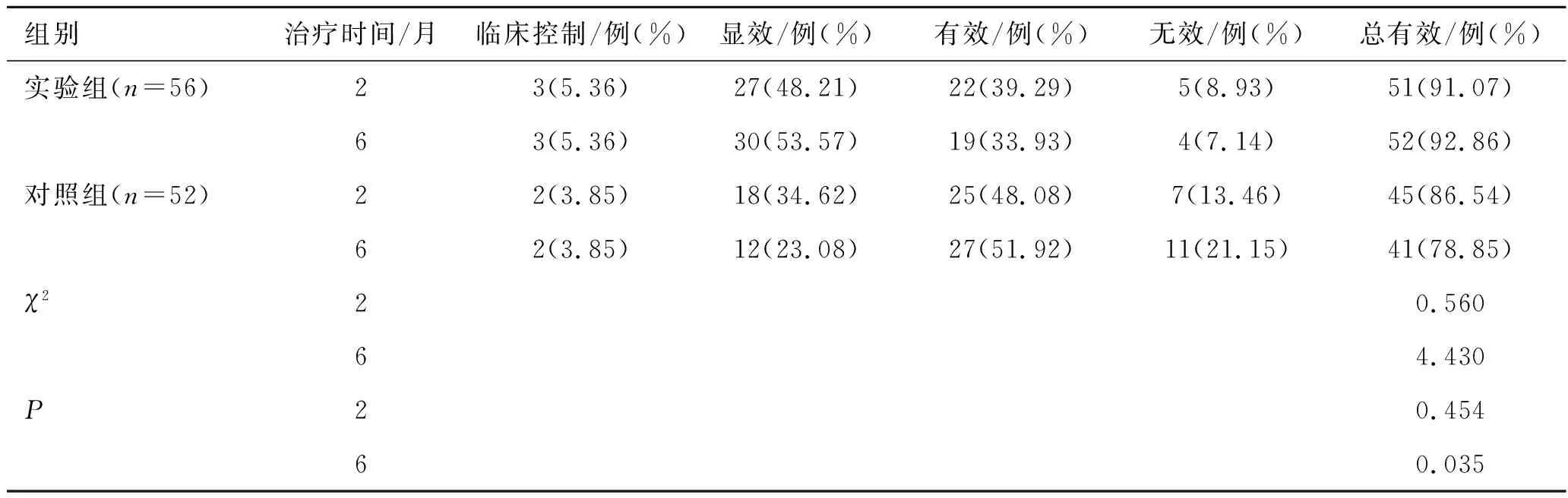
组别治疗时间/月临床控制/例(%)显效/例(%)有效/例(%)无效/例(%)总有效/例(%)实验组(n=56)23(5.36)27(48.21)22(39.29)5(8.93)51(91.07)63(5.36)30(53.57)19(33.93)4(7.14)52(92.86)对照组(n=52)22(3.85)18(34.62)25(48.08)7(13.46)45(86.54)62(3.85)12(23.08)27(51.92)11(21.15)41(78.85)χ220.56064.430P20.45460.035
2.22组治疗前后及治疗期间肺功能指标 治疗前,2组患者的FEV1、FEV1/FVC、FVC%pred、TLC、RV和RV/TLC值差异均无统计学意义(P>0.05)。在治疗2个月与6个月后,2组患者FEV1、FEV1/FVC和FVC%pred值比治疗前均上升,差异具有统计学意义(P<0.05);实验组FEV1、FEV1/FVC和FVC%pred值明显高于对照组,差异有统计学意义(P<0.05)。在治疗2个月与6个月后,实验组的TLC、RV和RV/TLC值明显下降,差异有统计学意义(P<0.05),而对照组治疗前后的TLC、RV和RV/TLC值差异无统计学意义(P>0.05)。在治疗2个月及6个月后实验组的TLC、RV和RV/TLC值明显低于对照组,差异有统计学意义(P<0.05),见表2。
2.3患者治疗前后及治疗期间血清中TNF-α、IL-6和IL-8水平变化 治疗前,2组患者的TNF-α、IL-6和IL-8水平差异均无统计学意义(P>0.05)。实验组治疗2个月与治疗6个月后TNF-α、IL-6和IL-8水平比治疗前均下降,差异具有统计学意义(P<0.05)。对照组治疗2个月后TNF-α、IL-6和IL-8水平与治疗前比较,差异无统计学意义(P>0.05),在治疗6个月后TNF-α、IL-6和IL-8水平比治疗前均下降,差异具有统计学意义(P<0.05),治疗6个月与治疗2个月后比较,差异无统计学意义(P>0.05)。实验组治疗后测得的TNF-α、IL-6和IL-8水平明显低于对照组,差异有统计学意义(P<0.05),见表3。
表22组治疗前后及治疗期间肺功能指标
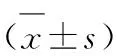

组别治疗前治疗2个月治疗6个月t1/t2/t3P1/P2/P3FEV1(L)实验组1.24±0.731.35±0.721.58±0.561.82/2.45/1.750.041/0.018/0.043对照组1.28±0.631.30±0.511.38±0.471.73/2.16/1.960.044/0.024/0.032t0.721.922.19P0.2830.0320.021FEV1/FVC/%实验组40.37±9.9443.84±10.7747.49±9.231.87/2.35/1.760.039/0.020/0.043对照组38.89±10.2640.02±11.6941.56±9.931.69/1.88/1.670.048/0.039/0.049t0.051.811.98P0.3610.0410.036FVC%pred/%实验组69.45±17.6174.92±15.3078.34±18.932.02/2.40/1.820.022/0.013/0.040对照组71.34±14.5273.61±17.0374.19±16.681.73/1.68/1.850.042/0.048/0.038t0.981.781.95P0.3270.0430.039TLC(L)实验组6.52±0.696.50±0.826.47±0.781.75/1.93/1.82-0.042/-0.035/-0.040对照组6.54±0.816.53±0.796.55±0.83-1.36/1.07/1.450.062/0.082/0.052t0.61-1.85-2.29P0.3470.0390.019RV(L)实验组3.65±0.693.61±0.733.44±0.65-1.84/-2.71/-2.420.040/0.009/0.036对照组3.64±0.643.66±0.823.67±0.771.58/1.65/1.030.057/0.052/0.176t0.751.962.87P0.2240.0350.007RV/TLC/%实验组58.84±8.2655.09±7.9151.34±6.70-1.74/-2.26/-1.980.040/0.019/0.032对照组57.45±7.6857.07±8.2356.04±8.861.46/1.53/1.330.065/0.062/0.071t0.86-1.72-1.95P0.1730.0470.037
注:比较t与P:t1/P1:治疗2个月与治疗前比较;t2/P2:治疗6个月与治疗前比较;t3/P3:治疗6个月与治疗2个月比较;t/P:实验组与对照组比较。
表32组治疗前后及治疗期间血清中TNF-α、IL-6和IL-8水平
Tab.3 TNF-α,IL-6 and IL-8 levels in serum of the 2 groups before treatment and after treatment for 2 months and 6 months
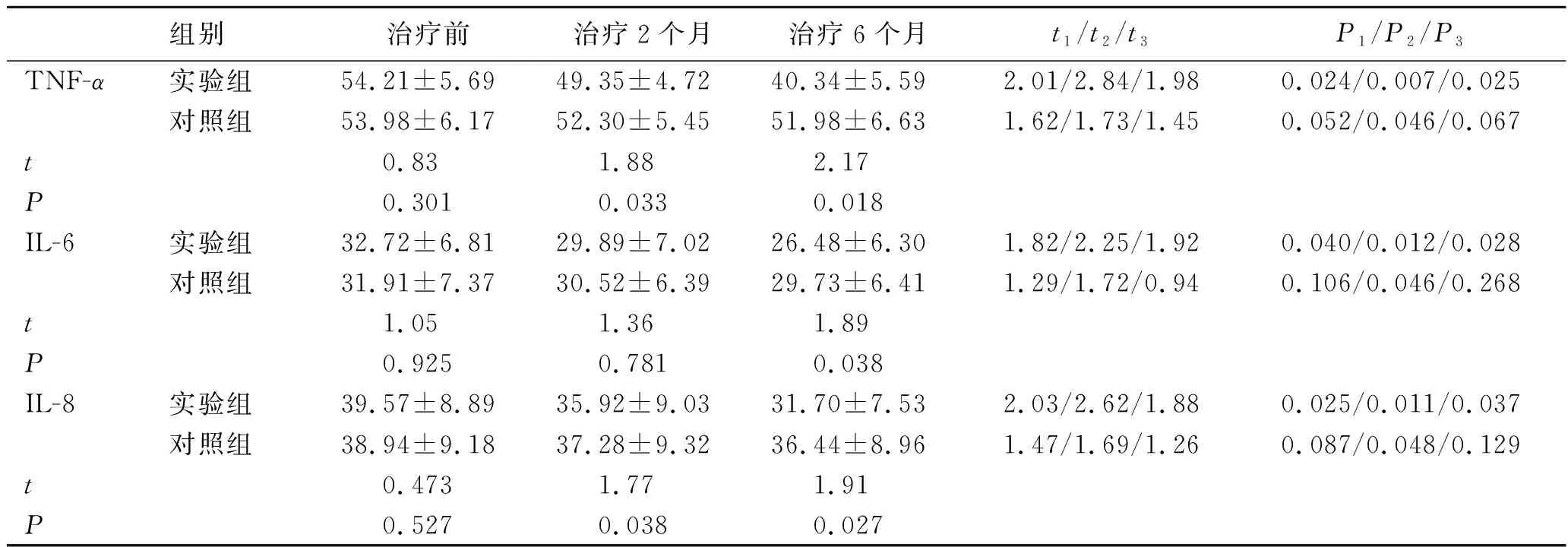
组别治疗前治疗2个月治疗6个月t1/t2/t3P1/P2/P3TNF-α实验组54.21±5.6949.35±4.7240.34±5.592.01/2.84/1.980.024/0.007/0.025对照组53.98±6.1752.30±5.4551.98±6.631.62/1.73/1.450.052/0.046/0.067t0.831.882.17P0.3010.0330.018IL-6实验组32.72±6.8129.89±7.0226.48±6.301.82/2.25/1.920.040/0.012/0.028对照组31.91±7.3730.52±6.3929.73±6.411.29/1.72/0.940.106/0.046/0.268t1.051.361.89P0.9250.7810.038IL-8实验组39.57±8.8935.92±9.0331.70±7.532.03/2.62/1.880.025/0.011/0.037对照组38.94±9.1837.28±9.3236.44±8.961.47/1.69/1.260.087/0.048/0.129t0.4731.771.91P0.5270.0380.027
注:比较t与P:t1/P1:治疗2个月与治疗前比较;t2/P2:治疗6个月与治疗前比较;t3/P3:治疗6个月与治疗2个月比较;t/P:实验组与对照组比较。
3 讨论
COPD是一组以气流受限为主要症状的慢性呼吸系统疾病,普遍研究认为是肺部的异常炎症反应,有多种炎症细胞(巨噬细胞、CD8+T淋巴细胞和中性粒细胞等)参与反应,这些炎症细胞大量增殖并活化后释放多种炎性介质和细胞因子[11]。大量研究证明,COPD患者体内可见到白三烯 B4(LTB4)[12]、白细胞介素类因子(IL-6、IL-8)[13]和肿瘤坏死因子-α(TNF-α)[14]等因子水平升高,COPD的治疗主要还是以控制炎症为主。磷酸二酯酶第4型(PDE-4)抑制剂可降低炎性细胞的活性,对于COPD具有良好的治疗效果[15]。西洛司特是一种选择性PDE-4抑制剂,临床研究其被用于COPD和哮喘的治疗中[5-6]。
肺功能检查是COPD的诊断标准[16]。本实验中,2组患者在治疗2个月与6个月后通气功能指标FEV1、FEV1/FVC和FVC%pred均上升,证明通过治疗损坏的气道和肺泡壁有所改善,肺的弹性回缩能力有一定程度的升高。与实验组比较对照组FEV1、FEV1/FVC和FVC%pred升高的程度高,证明了西洛司特可改善患者的症状。西洛司特具有较好的抗炎作用,而这一代的PDE-4抑制剂舒张支气管的作用较弱[17],因此西洛司特不是COPD的短效特效药,而是在长期用药的基础上通过抗炎作用改善了肺功能。在肺容量指标TLC、RV和RV/TLC上,实验组能有效改善这些指标,而对照组无明显疗效,这说明常规治疗并不能改善COPD患者肺动态过度充气状态,且实验组肺功能在治疗6周后改善更显著,说明西洛司特需要长期抗炎后减少小气道阻塞发挥作用。
TNF-α是由巨噬细胞产生的一种细胞因子,可诱导发生炎性反应,活化气道中的单核细胞和中性粒细胞等释放IL-6和IL-8等炎性因子[5,18]。外周血细胞因子和炎性因子水平在一定程度上代表了炎性程度。本实验中,2组患者在治疗前TNF-α、IL-6和IL-8水平均较高,实验组患者在治疗2个月与6个月后TNF-α、IL-6和IL-8水平显著下降,而对照组患者治疗6个月时才明显下降,说明西洛司特辅助治疗的实验组药物作用起效相对较快。实验组治疗后测得的TNF-α、IL-6和IL-8水平明显低于对照组,说明西洛司特对于炎性因子有良好的抑制作用。
综上所述,西洛司特的抗炎作用可改善COPD患者的临床症状,提高肺功能以及降低血清中TNF-α、IL-6和IL-8等炎症因子的水平,对于COPD有确切的疗效。同时,也可认为血清炎症因子水平可评价COPD的疗效。

