紫苏叶花青素提取工艺及其活性研究
黄红雨,赵虎,金晓艳,*
(1.昌吉职业技术学院,新疆昌吉831100;2.昌吉州中医医院,新疆昌吉831100)
紫苏 (Perilla frutescens(L.)Britton) 是唇形科(Labiatae)一年生药食同源植物[1]。紫苏叶含有蛋白质、挥发油、多酚、黄酮、色素等多种营养成分,具有抗菌消炎、防过敏、解热及抗氧化、调节血脂、抗肿瘤、改善肝机能等健康促进功能[2-5]。花青素是一种黄酮类的水溶性色素,一般来源于梗、叶片和果实。目前经常借助水提法[6]和酸化乙醇法提取[7],其中因水提法费时、提取量少、效率低、杂质较多等缺点应用较少,酸化乙醇法应用较广泛,可防止非酰基化花青素降解。超声波辅助提取法,是借助超声波来提高得率的一种新技术,有快速高效、低成本等优点,具有良好的发展前景广阔。张鑫[8]等对紫苏叶花青素提取得出其最优条件为料液比1∶30,50%乙醇体积,50℃处理120 min,此时提取率为5.6%。熊何健[9]等采用DPPH法测定桑葚花青素抗氧化能力,李敏[10]等采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定、铁还原抗氧化能力测定(ferric-reducing antioxidant potential assay,FRAP)、氧自由基吸收容量测定 (oxygen radical absorbance capacity assay,ORAC)与细胞抗氧化性(cellular antioxidant activity,CAA)等方法对比了黑莓、黑米麸、蓝莓、紫心苷中提取的花青素的抗氧化活性;此外,有报道对紫苏叶挥发油以及紫苏全草的抑菌活性进行研究[11-13],但对紫苏叶花青素的抑菌性研究较少。
近些年,花青素因其天然、安全性好、优良效果、资源可更新等优势在保健品、香料、医药及化妆品等领域都有良好的发展前景[14]。本文以紫苏叶为对象,探究其花青素的提取及抗氧化和相关抑菌特性,旨在为开发紫苏叶花青素这一天然色素资源提供理论支撑。
1 材料与方法
1.1 材料与试剂
紫苏:采摘于浙江滨江区,洗净后烘干,粉碎后用60目筛过滤备用。DPPH:日本东京化成工业株式会社;2,4,6-三(2'-吡啶基)-1,3,5-三嗪(2,4,6-tri(2-pyridyl)-1,3,5-triazine,TPTZ):Sigma-Aldrich 公司;无水乙醇、双氧水(30%)、硫酸亚铁、VC、邻苯三酚(焦性没食子酸)、水杨酸、醋酸钠(均为分析纯):南京化学试剂股份有限公司。
1.2 仪器与设备
FZ-200i系列精密电子天平:上海统舒电子科技有限公司;DHG-9075A电热恒温鼓风干燥箱:上海林频仪器股份有限公司;RE-52D旋转蒸发水浴槽:上海青浦沪西仪器厂;722N分光光度计:上海精密科学仪器有限公司;SPH-103B超凡型小容量恒温培养振荡器:上海世平实验设备有限公司;HPX-9052MBE电热恒温培养箱:上海博迅医疗生物仪器股份有限公司;90 mm培养皿:南通市卫宁实验器材有限公司。
1.3 试验菌种
金黄色葡萄球菌(ATCC29213)、大肠杆菌(ATCC44102)、荧光假单胞菌(Ip01)、腐败希瓦氏菌(AEG10146.1):昌吉职业技术学院药学与医学技术分院实验室保藏。
2 方法
2.1 紫苏叶花青素的提取
2.1.1 乙醇提取法
2.1.1.1 单因素设计
提取温度:称取紫苏叶粉末5.0 g,加入60%乙醇溶液,2.0%HCl,料液比为 1 ∶20(g/mL),提取 2.0 h。考察提取温度分别为 40、50、60、70、80 ℃时花青素的得率。
提取时间:称取紫苏叶粉末5.0 g,加入60%乙醇溶液,2.0%HCl,料液比为 1 ∶20(g/mL),60 ℃的条件下提取,考察提取时间分别 1.0、1.5、2.0、2.5、3.0 h 时花青素的得率。
HCl体积分数:称取紫苏叶粉末5.0 g,加入60%的乙醇溶液,料液比为1∶20(g/mL),60℃的条件下提取2.0 h,考察HCl体积分数分别为1.0%、1.5%、2.0%、2.5%、3.0%时花青素的得率。
乙醇体积分数:称取紫苏叶粉末5.0 g,分别加入40%、50%、60%、70%、80%的乙醇溶液,2.0%HCl,料液比为 1∶20(g/mL),60℃的条件下提取 2.0 h,考察花青素的得率。
2.1.1.2 正交试验
正交试验因素水平见表1。
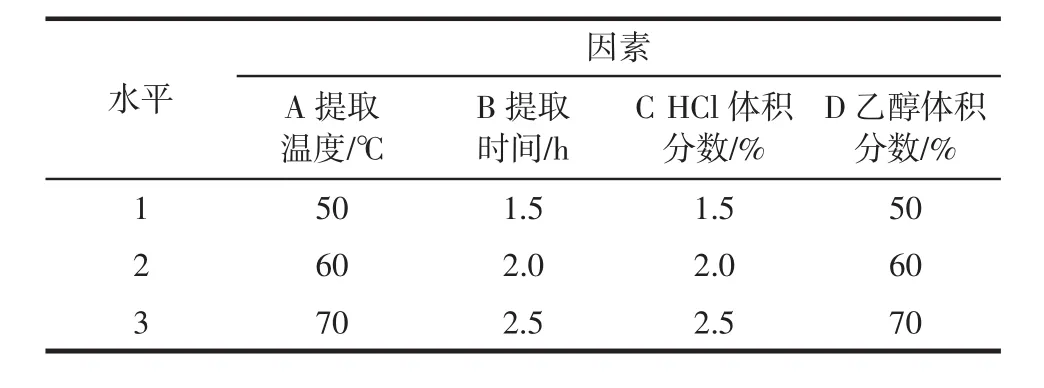
表1 乙醇提取法正交试验因素水平表Table1 The table of factor-level of orthogonal test using ethanol extraction
在单因素基础上,考察提取温度、提取时间、HCl体积分数、乙醇体积分数等因素对紫苏叶花青素得率的影响,利用L9(34)正交试验确定最佳工艺条件。
2.1.2 超声波辅助提取法
2.1.2.1 单因素设计
在乙醇提取工艺的基础上,选择乙醇体积分数为60%,进行试验。
超声功率:称取紫苏叶粉末5.0 g,在料液比1∶30(g/mL),40℃提取20 min,考查超声功率分别为350、400、450、500、550 W 时花青素的得率。
超声时间:称取紫苏叶粉末5.0 g,在超声功率450 W,料液比1∶30(g/mL),40℃下提取,考查超声时间分别为 10、15、20、25、30 min 时花青素的得率。
料液比:称取紫苏叶粉末5.0 g,在超声功率450 W,40℃提取20 min,考查料液比分别为1∶10、1∶20、1 ∶30、1 ∶40、1 ∶50(g/mL)时花青素的得率。
超声温度:称取紫苏叶粉末5.0 g,在超声功率450 W,料液比 1 ∶30(g/mL),提取 20 min,考查提取温度分别为 20、30、40、50、60 ℃时花青素的得率。
2.1.2.2 正交试验
选择料液比、超声时间、超声温度、超声提取功率4个因素,进行L9(34)正交试验确定最佳工艺,见表2。

表2 超声波辅助提取正交试验因素水平表Table2 The table of factor-level of orthogonal test using ultrasound-assisted extraction
2.2 测定花青素得率
pH 1.0缓冲液:配制0.02 mol/L的KCl溶液及0.2 mol/L盐酸溶液,以25∶76的体积比混合,再用KCl溶液调 pH(1.0±0.1)。pH 4.5 缓冲液:称取 1.64 g NaAc溶解于 100 mL 蒸馏水中,调 pH(4.5±0.1)。
取1.0 mL紫苏叶花青素溶液,分别用pH 1.0和pH 4.5的缓冲液稀释,反应平衡120min后,测定其吸光值。
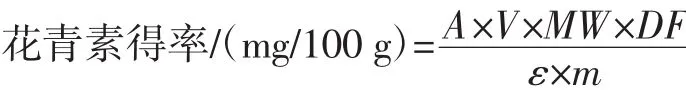
式 中 :A=(A520nm-A700nm)(pH1.0)-(A520nm-A700nm)(pH4.5);V为最终体积,mL;MW 为分子量,其值为449;DF为稀释倍数;ε为摩尔吸光系数,其值为29 600;m 为样品的质量,g。
2.3 抗氧化性测定
2.3.1 总抗氧化能力测定
FRAP法[15]:取4.9 mL FRAP试剂与0.1 mL样品溶液,反应10 min后测593 nm处吸光值,每组试验重复3次。
FRAP试剂:0.3mL醋酸缓冲液(pH 3.6):10 mmol/L TPTZ(溶于40 mmol/L盐酸):20 mmol/L FeCl3=10∶1∶1(体积比),避光储存。
2.3.2 DPPH·清除率的测定[16]
用无水乙醇配制0.1 mmol/L的DPPH溶液,储存于棕色瓶中。将3.8 mL DPPH溶液和0.2 mL样品溶液混匀反应30 min,测定517 nm处吸光度A1;将3.8 mL DPPH溶液和0.2 mL样品溶液、稀释液(60%乙醇)混合摇匀,测定吸光值A0。试验重复测3次。
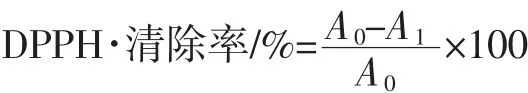
2.3.3 羟自由基(·OH)清除率的测定
参照Meng L等[17]方法,取2 mL磷酸盐缓冲液(phosphate buffer saline,PBS,pH=7.4),依次加入20 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)和 12 mmol/L FeSO4混合溶液 0.1 mL,一定浓度的紫苏花青素溶液1 mL、100 mmol/L H2O20.1 mL,用磷酸盐缓冲液定容至5 mL,迅速混匀,置于37℃水浴培养15 min,水浴完成后,取出冷却至室温,并在510 nm波长下测定各管溶液的吸光度。A0为未加花青素溶液的体系其吸光数值,A样品为加入一定浓度紫苏花青素溶液测定其吸光度值,记录数据,按下式计算清除率(%)。

2.3.4 超氧阴离子(O2-·)清除率的测定
参照Meng L等[17]方法,在各管中加入4 mL Tris-HCl(pH 8.2),2 mL 邻苯三酚溶液(10 mmol/L),样品溶液2 mL,2 mL超纯水为对照。将各试管置于37℃水浴中反应10 min。水浴完成后,各试管加1 mL盐酸(6 mol/L,约22%)溶液终止反应,冷却至室温,并在325 nm波长下测吸光度。A0为未加花青素溶液的体系其吸光数值,A样品为加入一定浓度紫苏花青素溶液测定其吸光度值,记录数据,计算公式如下:

2.4 抑菌性测定
2.4.1 菌种活化及菌悬液制备
将保存的菌种反复活化2次,细菌置于30℃孵育24 h。取活化好的供试菌采用梯度稀释法用90 mL生理盐水制成菌悬液,使菌液浓度到1×106cfu/mL~1×107cfu/mL,于4℃冰箱保存,备用。
2.4.2 抑菌活性测定
采用牛津杯法测定:取上述制备好的各待测菌液0.1 mL置于LB琼脂平板表面,涂布均匀后置于30℃培养箱中10 min,表面干燥后等距离平放做好标记的牛津杯,每支杯内分别加入150 μL不同浓度样品,对照采用无菌水,30℃孵育24 h~48 h,记录抑菌活性,重复3次。
2.4.3 最小抑菌浓度(minimum inhibitory concentration,MIC)测定和最低杀菌浓度(minimum bactericidal concentration,MBC)
用对倍稀释法将紫苏叶提取液稀释至0.312 5 mg/mL~10 mg/mL 6个梯度,分别吸取各个浓度梯度的紫苏叶提取液1 mL与约15 mL培养基充分混匀,制备含样液的平板,吸0.1 mL菌悬液均匀涂布后于30℃恒温培养24 h,以完全无菌生长的平板相对应的浓度记为MIC。
将MIC试验中的无菌生长的平板放回30℃培养箱,继续孵育24小时后记录,以完全无菌生长的平板所对应的浓度记为MBC。
3 结果与分析
3.1 乙醇提取法
3.1.1 单因素试验
提取温度、提取时间、HCl体积分数、乙醇体积分数对紫苏叶花青素得率的影响见图1。
从图1A中知,花青素得率随着温度的增加而增多,60℃时花青素得率最大,为3.932 mg/100 g。温度大于60℃时,所得花青素得率反而降低。可能是因为温度升高,分子渗透和运动速度变快,利于花青素物质的溶出,然而温度过高会使溶剂中的乙醇浓度降低,也会使花青素结构不稳定而被分解,导致得率降低,因此选择60℃为最佳。
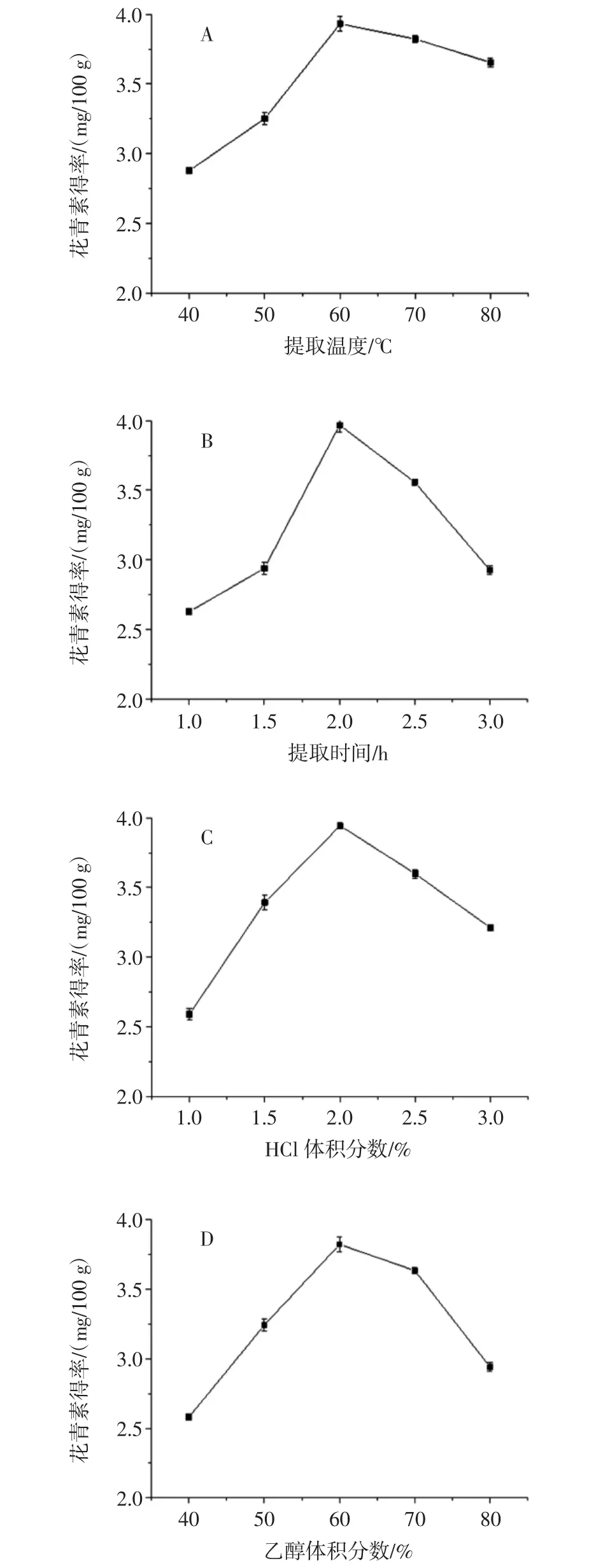
图1 提取温度、提取时间、HCl体积分数、乙醇体积分数对紫苏叶花青素得率的影响Fig.1 The effect of extraction temperature,extraction time,HCl volume fraction,ethanol volume fraction on the yield of anthocyanin from Perilla frutescens leaves
从图1B中看出,花青素得率在2.0 h时达到最大,为3.967 mg/100 g。低于2.0 h,花青素溶出的量较少;超过2.0 h,长时间处理使得的花青素稳定性下降,所以最佳提取时间为2.0 h。
从图1C中看出,随着盐酸体积分数的升高,所得花青素得率增大,盐酸体积分数在2.0%达到最大,为3.944mg/100g;大于2.0%时,所得花青素得率有所下降,说明盐酸体积分数为2%时,此时,花青素结构稳定。
从图1D可知,花青素得率随着乙醇体积分数的增加而呈先增加后减少趋势。最终选择乙醇体积分数为60%是因为60%的乙醇体积分数与花青素粗提物的极性相近,此时花青素溶解程度最好,更便于花青素类化合物的溶出。乙醇浓度过低时,不利于花青素的溶出;过高时会增加紫苏叶中其他类物质的溶出,干扰因素增加。
3.1.2 正交试验
在单因素的基础上进行正交试验,乙醇提取法试验结果见表3。

表3 乙醇提取法正交试验结果表Table3 Thetableoforthogonaltestresultsusingethanolextraction
从表3中看出,对紫苏叶花青素提取影响因素由大到小依次为提取温度、乙醇体积分数、HCl体积分数、提取时间。由极差分析知,最佳因素水平组合为A2B3C3D2,即提取温度为60℃,提取2.5 h,乙醇和盐酸体积分数60%和2.5%,在此条件下,进行验证试验,重复3次,所得紫苏叶花青素得率为4.003 mg/100 g,略多于正交试验最优组合(处理6)A2B3C1D2的3.978 mg/100 g,所以选择A2B3C3D2为最佳提取工艺。
3.2 超声波辅助提取法
3.2.1 单因素试验
超声功率、超声时间、料液比、超声温度对紫苏叶花青素得率的影响见图2。
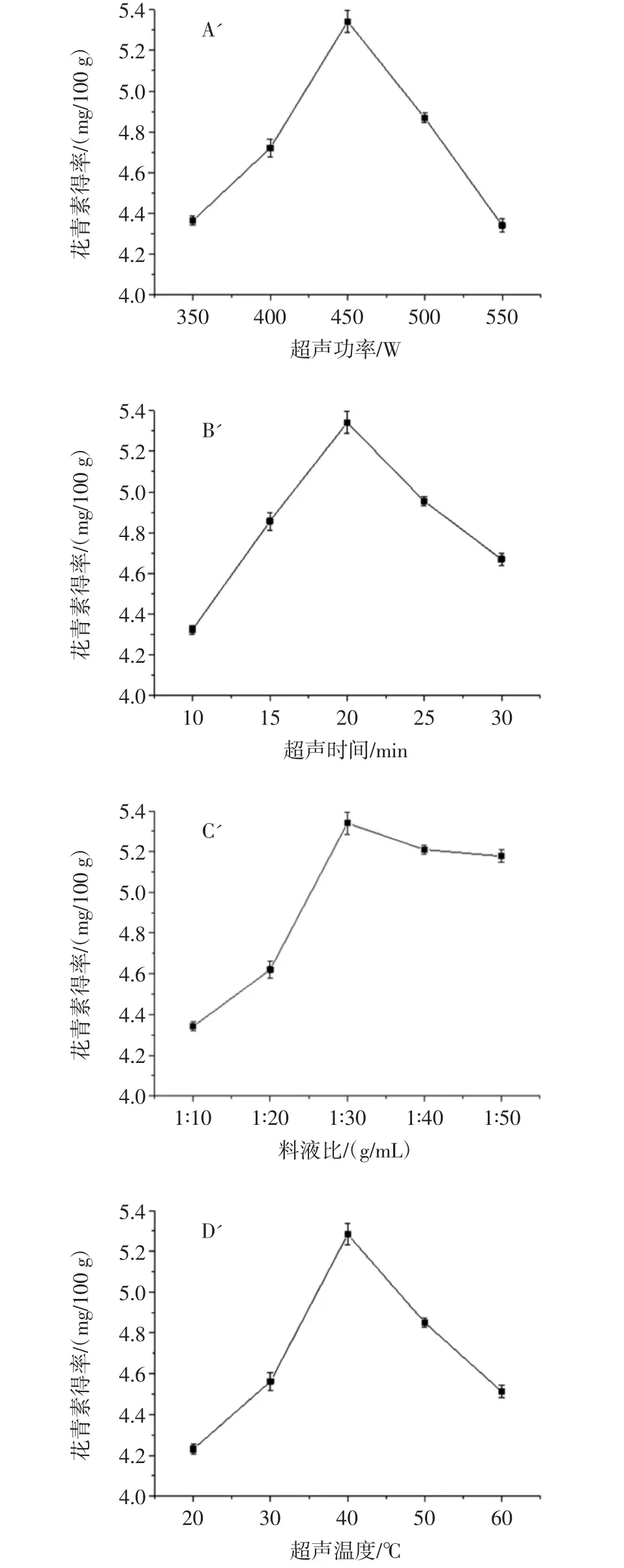
图2 超声功率、超声时间、料液比、超声温度对紫苏叶花青素得率的影响Fig.2 The effect of ultrasonic power,ultrasonic time,solid-liquid ratio,ultrasonic temperature on the yield of anthocyanin from Perilla frutescens leaves
由图2A知,超声功率为450 W时,花青素得率最高。过高的超声功率对花青素有破坏作用,高提取功率下,样品温度会升高太快,花青素结构遭到破坏,得率下降,低提取功率下,反应温度不会升高过快,得率随功率(小于450 W)的增加有增大的趋势。
由图2 B知,当超声时间为20 min时,花青素得率最高。随着超声波加热时间的延长得率呈现先增加后降低的趋势。超声波在短时间内即可造成细胞破碎,增加花青素的溶出,得率升高;降低的原因可能是花青素在长时间加热过程中,热稳定性发生了改变,同时也会增加其他高分子杂质的进出,从而得率降低。
由图2 C知,加大料液比,花青素得率会不断增大,在料液比为1∶30(g/mL)时,花青素得率达到最大,随后,得率基本维持不变。是因为料液比较低时,花青素的浸出率低,而料液比较高时,浸提液中花青素浓度高,得率也相应增高。
由图2D知,随着温度的升高,所得花青素得率逐渐增多,40℃达到最大,为5.282 mg/100 g。温度超过40℃时,所得花青素含量反而降低。可能是因为高温下,渗透和热降解速度变快,花青素结构不稳定而被分解,导致得率降低。
3.2.2 正交试验
超声波辅助提取法正交试验结果见表4。
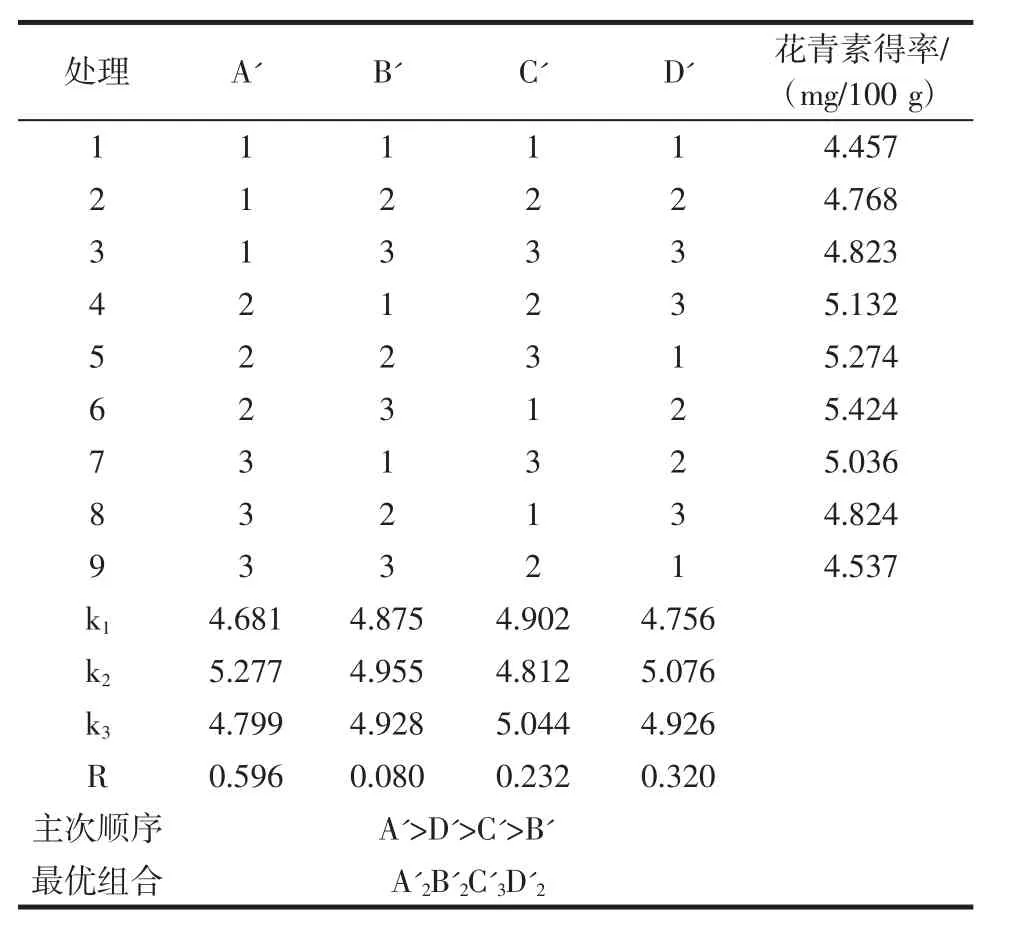
表4 超声波辅助提取法正交试验结果表Table4 The table of orthogonal test results using ultrasoundassisted extraction
由表4表明,各因素对测定结果的影响次序为:超声功率>超声温度>料液比>超声时间。由极差分析得出最佳提取工艺为A'2B'2C'3D'2:超声功率450 W,超声时间 20 min,料液比 1∶40(g/mL),超声温度 40 ℃。在此条件下,进行验证试验,重复3次,所得紫苏叶花青素得率为5.489 mg/100 g,略多于正交试验最优组合(处理 6)A'2B'3C'1D'2的 5.424 mg/100 g,所以选择A'2B'2C'3D'2为最佳提取工艺。
3.2.3 乙醇提取与超声波辅助提取花青素对比分析
不同提取方法比较见表5。

表5 不同提取方法比较Table5 Comparison of different extraction methods
由表5可知,超声波辅助提取法较乙醇提取法,花青素得率提高了0.37倍,提取时间缩短了86.67%,提取温度降低,降低了成本,进一步对得到的花青素进行活性研究。花青素虽有多种生物活性,但是一种不稳定的天然色素[18],其稳定性受到各种因素的影响,给花青素的保存、开发、利用造成一些不便,可在以后试验中尝试膜过滤等方法提取纯化,其组成成分及含量变化可通过液相色谱质谱联用(liquid chromatograph mass spectrometer,LC-MS)分析鉴定,其单体制备和合成途径等均需进一步探讨。
3.3 抗氧化测定
3.3.1 FRAP法
FRAP法[19]反映的是三价铁离子还原成二价铁离子的能力。紫苏叶花青素和VC的铁离子还原/抗氧化能力见图3。
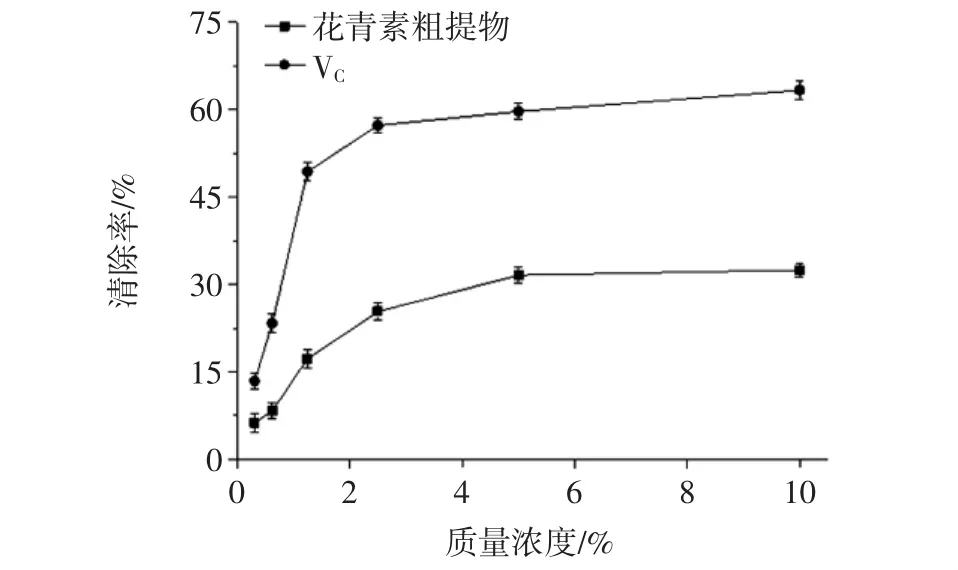
图3 紫苏叶花青素和VC的铁离子还原/抗氧化能力Fig.3 The ferric reducing/antioxident power of anthocyanins from Perilla frutescens leaves and VC
由图3可知,在测定浓度范围内,紫苏叶花青素粗提物具有一定的铁离子还原/抗氧化能力,抗氧化能力随样品的质量浓度的增加而增强,VC对Fe3+还原能力明显强于紫苏叶花青素粗提物。紫苏叶花青素抗氧化活性与其化学结构组分有关系,改变芳香环上的基团种类及位置,抗氧化性随之改变;紫苏叶提取物抗氧化能力小于VC,主要是因为提取物为粗提物,含非活性物质及杂质。
3.3.2 DPPH·清除能力
DPPH·是一种稳定自由基,在517 nm处存在最大吸收值,其吸光值与浓度呈相关关系,当加入自由基清除剂时,未配对电子被配对,自由基被抑制,吸光值会变小,以此来评价自由基清除能力[20]。紫苏叶花青素和VC对DPPH·的清除能力见图4。
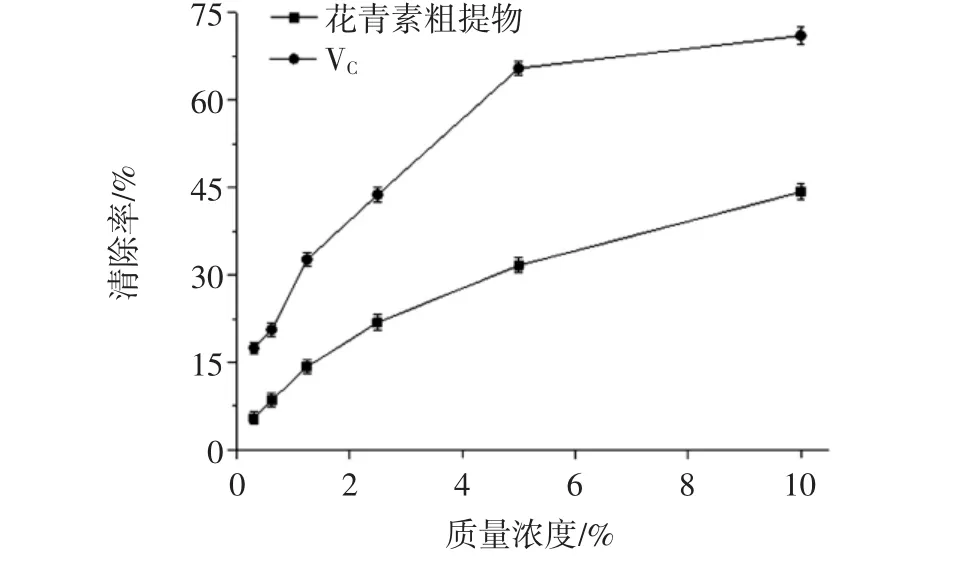
图4 紫苏叶花青素和VC对DPPH·的清除能力Fig.4 Scavenging activities of anthocyanins from Perilla frutescens leaves and VCon DPPH·
由图4可知,当质量浓度低于5%时,VC对DPPH·的清除能力随质量浓度的增加而增强,而花青素粗提物对DPPH·清除率缓慢增强;当质量浓度继续增大,清除率趋于平缓,这与蒋其忠[21]和王彦平[22]中的结果趋势一致。VC清除DPPH·能力明显高于花青素粗提物,这一结果与FRAP法结果相对应。
3.3.3 ·OH清除能力
·OH是迄今所知生物体毒性最强、危害最大的一种重要的活性氧自由基,几乎可以和所有的细胞组分反应。紫苏叶花青素和VC对·OH的清除能力见图5。
由图5可知,紫苏叶花青素粗提物对·OH具有一定的清除能力,在测定范围内,其浓度与清除率呈正相关关系,VC对·OH清除能力大于同浓度下紫苏叶粗提取物。
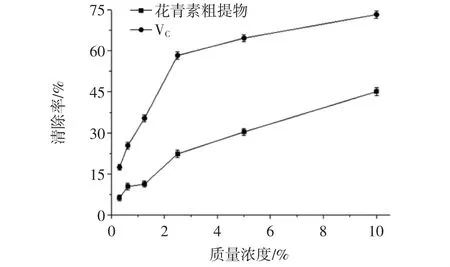
图5 紫苏叶花青素和VC对·OH的清除能力Fig.5 Scavenging activities of anthocyanins from Perilla frutescens leaves and VCon·OH
3.3.4 O2-·清除能力
O2-·是人体内产生的活性氧自由基,可在短时间内引发自由基链式反应,能引发体内脂质过氧化,加快机体的衰老,危害人体健康。紫苏叶花青素和VC对O2-·的清除能力见图6。
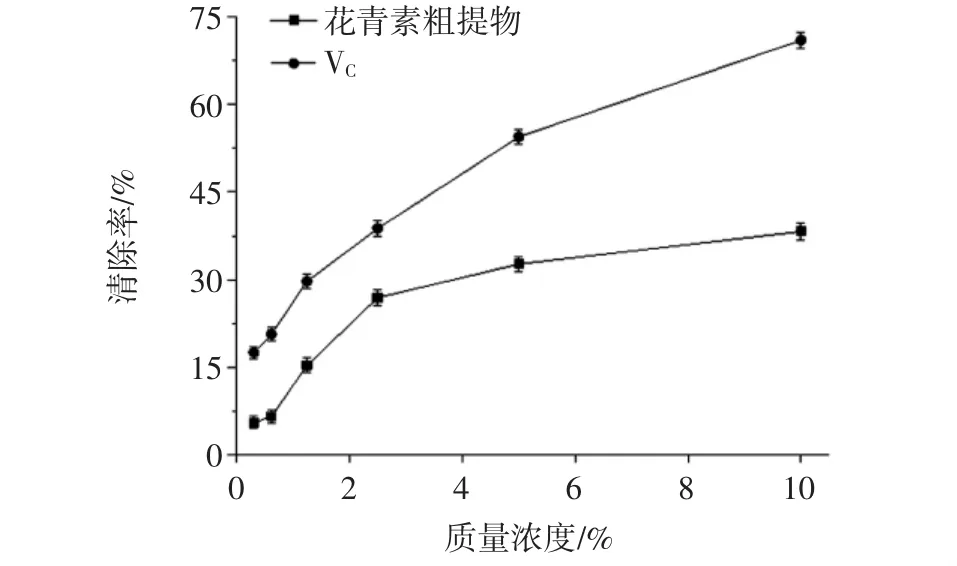
图6 紫苏叶花青素和VC对O2-·的清除能力Fig.6 Scavenging activities of anthocyanins from Perilla frutescens leaves and VCon O2-·
由图6知,紫苏花青素粗提物对O2-·有一定的清除能力,同浓度下,清除能力低于VC,清除O2-·能力强于·OH能力,说明其对不同自由基的清除具有选择性,可以有针对性的清除某种自由基,提高清除能力。
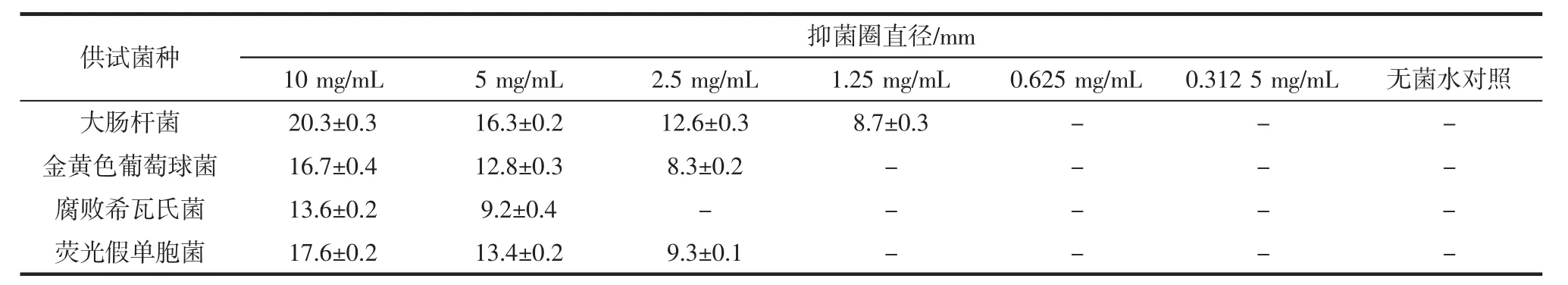
表6 不同浓度紫苏叶花青素粗提物的抑菌情况Table6 The antibacterial situation on different concentrations of anthocyanins from Perilla frutescens leaves
3.4 紫苏叶花青素抑菌性测定
不同浓度紫苏叶花青素粗提物的抑菌情况见表6。
采用打孔法观察体外抑菌活性,发现抑菌圈直径大小不一。不同浓度紫苏叶花青素粗提物对不同的菌株均有一定的抑制效果,紫苏叶花青素粗提物对大肠杆菌的抑菌效果最好,对腐败希瓦氏菌的抑菌效果最差。紫苏叶花青素粗提物对供试菌的MIC及MBC见表7。
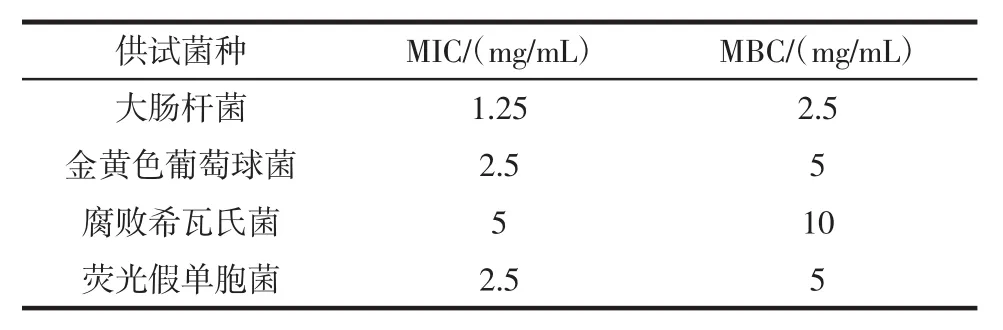
表7 紫苏叶花青素粗提物对供试菌的MIC及MBCTable7 The effect of anthocyanins from Perilla frutescens leaves on MIC and MBC of tested bacteria
紫苏叶花青素粗提物的MIC值越小,其抑菌性越强,抑菌效果越好。由表7知,紫苏叶花青素粗提物在浓度为5 mg/mL对4种菌均具有抑制效果,对大肠杆菌的抑制效果较强,其MIC和MBC分别为1.25 mg/mL和2.5 mg/mL,对金黄色葡萄球菌和荧光假单胞菌的抑制效果相当,其MIC和MBC分别为2.5 mg/mL和5 mg/mL,对腐败希瓦氏菌的抑菌效果最差。花青素对某些细菌抑制方面有一定潜能,而其抑菌和杀菌机理还有待进一步考证。
4 结论
乙醇提取法提取紫苏叶花青素最佳条件为2.5%HCl-60%乙醇60℃提取2.5 h,得率为4.003 mg/100 g;超声波辅助提取法紫苏叶花青素最佳提取工艺为超声功率 450 W,超声时间 20 min,料液比 1 ∶40(g/mL),超声温度40℃,得率为5.489 mg/100 g;超声辅助提取法较乙醇提取法,花青素得率提高了0.37倍,提取时间缩短了86.67%,提取温度降低,降低了成本。通过检测FPAR法,发现紫苏叶花青素具有较强的铁离子还原氧化能力,此外紫苏叶花青素对DPPH·、·OH、O2-·有特定的清除能力,因此花青素具有一定的抗氧化能力。不同浓度紫苏叶花青素粗提物对不同的菌株均有一定的抑制性能,对大肠杆菌有较好的抑制作用,其MIC和MBC分别为1.25 mg/mL和2.5 mg/mL,对腐败希瓦氏菌的抑制作用不明显。

