脑白质病变患者临床特征及其发病影响因素分析
王博,申抗抗,李静,窦志杰,马征
(承德医学院附属医院,河北承德067000)
脑白质病变(WML)是脑小血管病的主要类型[1]。研究显示,在60~70岁的人群中,存在深部脑白质改变和脑室旁白质改变者分别占87%、68%;在75岁以上的社区老人中,2/3的个体存在脑室旁白质病变;而在80~90岁的人群中,存在深部脑白质改变或脑室旁白质改变者占95%以上[2,3]。WML起病隐匿,临床表现差异性大,可能出现头晕、情绪改变、运动障碍、认知障碍、二便障碍等表现,最终可造成生活不能自理[4]。及早发现WML,明确其病因,分清WML的影响因素是急需解决的问题。本研究回顾性分析了214例WML患者的临床资料,分析患者的临床病理特征,并探讨WML发病的影响因素。
1 资料与方法
1.1 临床资料 选择2016年4月~2017年4月承德医学院附属医院收治的WML患者214例,男110例、女114例,年龄(63.81±10.51)岁。以同期64例健康体检者作为对照,男31例、女33例,年龄(60.04±9.83)岁。排除标准:中毒性脑病、缺氧性脑病、遗传性疾病、免疫性疾病、代谢性疾病、多发性硬化等病因所致的WML;合并恶性肿瘤;严重心、肝、肾功能不全;急性或非急性脑梗死、脑出血、蛛网膜下腔出血、混合性卒中;合并感染、易凝状态疾病;近2周服用他汀类、贝特类、烟酸类等影响脂质代谢药物以及服用抗凝药物者。
1.2 临床资料采集 采集患者的临床资料,包括年龄、性别、吸烟史、饮酒史、高血压、糖尿病、冠心病、身高、体质量,计算体质量指数(BMI)。患者入院24 h内采集清晨空腹静脉血10 mL,应用全自动生物化学分析仪检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白A1(APO-A1)、载脂蛋白B(APO-B)、C-反应蛋白(CPR)、纤维蛋白原(FIB)、尿酸(UA)水平。
1.3 WML诊断标准 头颅MRI检查显示,脑白质区异常信号,边界不清的双侧基本对称大小可不等的斑点状、斑片状甚至发生融合的病变,头颅MRI T1加权成像(T1WI)见脑室旁或深部脑白质等信号或者低信号病灶,T2加权成像(T2WI)见脑室旁或深部脑白质高信号病灶,T2FLAIR序列上见脑室旁或深部脑白质高信号病灶。
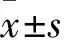
2 结果
2.1 WML组和对照组的临床特征比较 WML患者年龄、高血压患者比例、TC、LDL-C、CRP、FIB、UA水平均高于无WML者(P均<0.05)。见表1。

表1 WML患者和无WML者的临床特征比较
注:与对照组比较,*P<0.05。
2.2 WML发病的影响因素分析结果 Logistic回归分析结果显示,年龄(OR=2.674,95%CI为1.954~1.130,P<0.001)、高血压(OR=1.856,95%CI为1.265~2.457,P=0.005)、TC(OR=2.341,95%CI为1.702~4.568,P=0.002)、UA(OR=1.007,95%CI为1.017~1.043,P=0.003)是WML的影响因素。
3 讨论
随着人口老龄化进程加快以及神经系统疾病影像学诊断技术巨大发展,WML的检出率逐年升高。Yadav等[5]研究发现,遗传因素与WML密切相关。WML可能与低灌注、颅内慢性缺血以及脑白质脱髓鞘有关。脑动脉粥样硬化、脑动脉透明样变[6]等改变可引起慢性、进行性的局灶性甚至弥漫性亚临床缺血,神经细胞脱髓鞘、少突胶质细胞丢失轴索损伤,造成不完全性缺血。此阶段没有临床症状,核磁共振检查显示为WML[3]。此外,有研究认为内皮损伤后血管通透性增加导致血管内物质外渗,引起血管及血管周围组织损伤,对WML的进展可能也发挥重要作用[7]。近年来,年龄、血脂异常、高血压、炎症反应、微栓子等成为WML研究的热点,相关研究有很多,但是结论并不一致,关于WML的发病机制以及病因并不是十分明确。
目前年龄是被广泛认可的WML发病的影响因素。研究发现,老年人群中WML发病率较高,随着年龄增长,WML会更加严重[8]。髓鞘碱性蛋白和卵磷脂是神经纤维髓鞘最重要的组成成分。成年后随年龄的增加,髓鞘碱性蛋白和卵磷脂再生逐渐减少可形成WML。但目前尚不清楚WML何时出现才是正常的生理现象。
本研究发现,高血压、TC亦是WML发生的影响因素。高血压与脑小动脉病变关系极为密切,长期血压增高可导致脑动脉内皮细胞及基底膜受损,使血小板活化聚集于暴露的内膜,从而促使血栓形成,增加动脉栓塞的可能,包括脑小动脉栓塞、脑小动脉灌注障碍可导致WML。
关于血脂异常与WML关系的研究较多,两者间关系的研究结果多有矛盾。Jickling等[9]认为,TC、TG升高与WML发病有关;而Jimenez等[10]认为,血脂水平与WML发病无关。TC、LDL-C均可以导致脑动脉粥样硬化,脑动脉粥样硬化与WML的发生发展密切相关[11]。脑血管内皮细胞的损伤使得血管通透性增加,TC侵入动脉壁内引起脂质沉积,脂质沉积增多、结缔组织大量增生形成粥样斑块,导致血管管腔狭窄,粥样斑块进一步进展形成纤维斑块,纤维斑块可发生溃疡、附壁血栓形成、加重脑血管腔狭窄甚至闭塞,脑小动脉灌注不足产生WML。部分动脉粥样硬化斑块为不稳定斑块,斑块可随时脱落,形成动脉微栓子,微栓子脱落堵塞脑小动脉,引起脑小动脉血供不足,进而形成WML。本研究结果显示,TC是WML发病的影响因素。LDL-C是公认的引起动脉粥样硬化的重要物质。本研究亦发现,WML组LDL-C高于对照组,但LDL-C并不是WML发病的影响因素,且HDL-C水平与WML无明显相关性,其原因可能与纳入样本数量相对不足有关。Apo-B/Apo-A1与LDL-C/HDL-C类似,是反映动脉硬化的指标,甚至有研究指出,Apo-B/Apo-A1作为心脑血管预测指标优于传统的血脂指标,但既往很少有Apo-A1、Apo-B、Apo-B/Apo-A1与WML关系的研究。陶永等[12]研究表明,低Apo-A1水平降低是WML发生的独立危险因素,可增加WML的患病风险。但本研究未发现Apo-A1、Apo-B、Apo-B/Apo-A1与WML发病的相关性,这可能与研究纳入研究对象的临床特征以及研究方法不同有关。
CRP是炎症反应最主要的生化标志。目前普遍认为,动脉粥样硬化的病情演变及斑块的破裂和分解与血管的炎性损伤有密切关系,是一种低水平的慢性炎症。通常情况下,当机体处于正常生理状态时,CRP含量较少。机体组织受到创伤或损坏后,在白细胞介素的调控下,肝脏CRP合成增加。动物实验表明,慢性脑血流灌注不足时,小胶质细胞、少突胶质细胞通过介导白细胞介素3、粒细胞集落刺激因子等导致炎症反应,形成脑白质纤维脱髓鞘脱失[13]。本研究结果显示,WML组CRP水平高于对照组,表明在WML的发生与发展过程中,炎症反应发挥重要的作用。
FIB是肝细胞合成的糖蛋白,参与患者体内的凝血过程,可以促进血管内膜对脂蛋白的吸附,增加纤维斑块中脂质的聚集。FIB作为凝血因子和炎症标记物之一,是决定血小板聚集性和血浆及全血黏度的主要因素,可促进血栓形成,其血浆浓度过高可加重血管壁粥样斑块的不稳定性。脑动脉粥样硬化是WML的危险因素,动脉粥样硬化造成血管内皮细胞损伤,血管内皮细胞的活化素减少,可使纤维蛋白溶酶减少,FIB增加,加速动脉硬化和血栓形成,进而导致WML。本研究结果显示,WML组FIB高于对照组,提示FIB与WML的发生密切相关。
Vannorsdall等[14]研究指出,高UA水平可使脑缺血所导致的WML增加。尿酸盐结晶可沉积于血管壁引起炎症反应,直接损伤血管内膜,促进血小板聚集;高UA可与高血压并存,使纤溶系统紊乱,血液高凝;高尿酸血症常伴有血脂异常,通常以高TG合并低HDL-C为特征,可能与某些遗传缺陷有关[15];UA升高可促进LDL-C的氧化和脂质的过氧化[16],反之TG水平升高可引起UA升高;二者相互协同,加快并且加重脑动脉粥样硬化的进程;动脉粥样硬化亦可升高UA水平,并影响WML患者转归;UA升高可导致机体微炎症状态及产生氧化应激,引起微血管病变、小动脉玻璃样变,进而导致WML。本研究结果显示,WML组UA高于对照组,且UA是WML发病的影响因素。
综上所述,年龄、高血压、TC、UA是WML发病的影响因素,LDL-C、CRP、FIB亦与WML发病密切相关。长期高血压、高TC水平、高LDL-C水平、高TC水平以及CRP、FIB异常等因素相互协同作用,加快并加重WML的进程,多种危险因素共同作用的效果远远超过各个组分致病作用的单纯累加,导致恶性循环。鉴于目前尚无有效的治疗WML的方法,密切关注WML发病的危险因素是目前重要的研究任务,临床可以从控制高血压、降低TC及UA水平、减少炎症反应、抑制血栓形成等方面入手,积极预防WML的发生或延缓WML的进程。

