对二甲苯对褐牙鲆(Paralichthys olivaceus)幼鱼的毒性效应研究
蔺鹏飞,苗晶晶,,潘鲁青,林雨霏,武江越
1. 中国海洋大学海水养殖教育部重点实验室,青岛 266003 2. 国家海洋局海洋减灾中心,北京 100194
对二甲苯是一种重要的工业原料,被广泛用于农药、塑料和纤维合成等行业。2015年,全球对二甲苯年产量达3 696万吨,其中中国的全年产量达到882万吨,占全球对二甲苯年产量的23%。对哺乳动物的研究表明,对二甲苯具有神经毒性、遗传毒性、胚胎毒性以及致畸作用[1-3],目前对二甲苯已被国际海事组织列入高泄漏风险危险化学品名单[4]。2007年,位于中国珠海港恒基达鑫化工码头的一艘外籍工船发生对二甲苯泄漏,造成约计400升的对二甲苯倾入海中[5]。目前对二甲苯对水生生物的毒性作用研究较少。范亚威和周启星[6]研究了二甲苯对斑马鱼的急性致死效应,然而海洋鱼类和淡水鱼类对二甲苯的敏感性可能存在较大的区别,而对二甲苯对海洋鱼类的毒性效应研究还未见报道。因此亟需了解对二甲苯等危险化学品对海洋生物特别是经济种类的毒性作用,为海洋危险化学品泄露的风险评估提供依据。
近年来我国海水养殖业迅速发展,截至2012年为止我国海水养殖面积达2 180 927公顷,养殖产量达1 643.81万吨,海水鱼类产量超过100万吨[7]。褐牙鲆(Paralichthysolivaceus)是名贵的冷温性海水鱼类,由于其经济价值高,近10年来逐渐成为我国黄渤海海域的重要增养殖鱼类品种,同时也是毒理学研究和检测的常用受试生物[8]。二甲苯包括邻二甲苯、间二甲苯和对二甲苯3种同分异构体,本研究选择应用最为广泛的对二甲苯开展研究,通过急性和亚慢性暴露试验,研究了其对褐牙鲆幼鱼的致死效应与生长抑制效应,通过测定对二甲苯胁迫下褐牙鲆幼鱼肝脏的脂质过氧化、DNA损伤效应、脑组织中乙酰胆碱酯酶活性(AchE)、血细胞总数变化以及血清中溶菌酶活力等评价指标,解析对二甲苯对褐牙鲆的遗传毒性、神经毒性以及免疫毒性效应,进而全面系统地了解对二甲苯对海洋鱼类的毒性作用机制,为对二甲苯的海洋生态毒理评价提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验用鱼
试验所用的褐牙鲆幼鱼取自烟台海阳市黄海水产养殖厂。实验鱼类的规格分为2种,一种是孵化后60 d的幼鱼,平均体长为4~6 cm,平均体重为(4.2±0.3) g,被用于急性毒性试验。另一种规格为孵化后6个月的幼鱼,平均体长为6~8 cm,平均体重为(6.7±0.6) g,被用于生长实验和亚慢性毒性试验。实验鱼的10 d暂养条件为:溶解氧7.0~7.5 mg·L-1,盐度33~35,温度(18±1) ℃,pH 8.1。暂养期间投喂通威牌鱼用饲料,每天投喂的量为实验用鱼体重的3%。
1.2 急性毒性试验
急性毒性试验参考OECD (Organization for Economic Cooperation and Development)化学品测试导则进行[9],共设置5个染毒浓度和1个空白对照,每组设置3个平行。染毒浓度分别为20、40、80、160和320 mg·L-1。本实验采用半静态试验方法,每24小时更换95%的试验液,试验期间持续充气并尽可能保持水槽处于密封状态。对二甲苯暴露实验条件与暂养期间保持一致。在暴露96 h期间,各处理组随机6次取水样测定水体中对二甲苯浓度,以6次平均值表示对二甲苯的实际浓度。水体中对二甲苯含量测定参考顶空-毛细管柱气相色谱法(GB/T-5750.8—2006)[10],采用Agilent 6890N型气相色谱仪进行检测,毛细管色谱柱为FFAP 25 m ×0.32 mm;载气为高纯氮;燃气为纯氢;进样温度为150 ℃;柱温为50 ℃,检测器温度为160 ℃;线流速为30 cm·s-1;分流比为10:1;进样量为800 μL。鱼类死亡的判断标准为用玻璃棒触碰尾部没有任何反应。试验数据采用概率单位分析法求出96 h的半致死浓度(LC50)及其95%置信区间。
1.3 28 d慢性暴露实验
1.3.1 28 d慢性暴露试验设计
根据急性毒性的实验结果选取96 h-LC50的1/20、1/40和1/80作为3个亚慢性毒性试验暴露浓度,即2.3、4.6和9.2 mg·L-1,每组设置3个平行,试验条件与急性毒性试验一致。在试验开始之前和暴露28 d之后每组取8尾受试鱼测量体重,用于计算鱼类的增重率和特定生长率的变化[11]。增重率和特定生长率的计算公式如下:增重率(%)=(W2-W1)×100/W1,特定增长率(%)=100×[(lnW2-lnW1)/T]。其中W2和W1分别表示结束和开始时的体重,T代表染毒暴露的时间。
28 d慢性暴露实验期间分别于实验开始后的0、7、14、21和28 d时取样用于亚慢性毒性指标的测定。取样时从各个水槽内随机选取8尾褐牙鲆幼鱼,用2 mL针筒于尾静脉处取血,并立即进行血细胞计数[12]。剩余血液样品于4 ℃下,经2 000 r·min-1离心分离,收集血清,于-80 ℃冷冻保存,用于溶菌酶活力测定。取血后迅速解剖鱼体并取出肝脏和鱼脑组织于液氮中冷冻,冷冻保存于-80 ℃用于脂质过氧化、DNA损伤和乙酰胆碱酯酶(AchE)活性测定。
1.3.2 生理生化指标测定
脂质过氧化的方法采用测定次级氧化产物丙二醛(MDA)含量的方法,根据Wills的方法[13]稍加改进:将组织用体积为1∶19的匀浆缓冲液(pH=7.7, Na2HPO4·12H2O 0.125 mol·L-1, K2HPO4·12H2O 0.125 mol·L-1, Na2EDTA 0.05 mol·L-1)于冰浴中匀浆,匀浆后4 ℃、1 200 g离心30 min,收集上清液用于实验指标的测定。取200 μL上清液,加入100 μL 20% TCA(包含1 mmol·L-1FeSO4)和200 μL 0.67%硫代巴比妥酸试剂,在90 ℃水浴10 min,3 000 r·min-1离心5 min,取200 μL上清液在530 nm读取吸光值OD530,单位为nmol·mg-1。蛋白质含量测定以牛血清白蛋白为标准物,采用Bradford的方法[14]测定。
DNA碱解旋的测定方法参照Ching的方法[15]利用荧光分光光度计定量组织中双链和单链DNA含量,DNA的完整性用F值表示,计算公式为F=(XauDNA-XssDNA)/(XdsDNA-XssDNA),式中X为荧光值,dsDNA为双链DNA,ssDNA为单链DNA,auDNA为碱解旋后的DNA。
AChE的活性测定采用Ellman的方法[16],原理是碘化硫代乙酰胆碱被AChE分解为乙酸和硫代胆碱,硫代胆碱与DTNB生成一种黄色络合物,在412 nm处显色。取100 μL的磷酸盐缓冲液中加入50 μL酶液,于35 ℃保温20 min。然后依次加入50 μL碘化硫代乙酰胆碱(75 mmol·L-1)、100 μL DTNB溶液(20 mmol·L-1),置于96孔酶标板上迅速混合,在波长为412 nm处读取吸光值。蛋白质含量测定以牛血清白蛋白为标准物,采用Bradford的方法[14]测定。酶活力定义为每毫克蛋白AChE的活性单位数表示。
溶菌酶活力的测定采用Hultmark方法[17],以溶壁微球菌冻干粉为底物,用pH=6.4的磷酸钾缓冲液配成底物悬液,取200 μL该悬液与20 μL待测液血清于96孔酶标板中混匀,于570 nm处测量吸光度A1,28 ℃下水浴30 min终止反应,测定吸光度A2。溶菌酶活力(U·mL-1)计量方式采用(A1-A2)/A2。
1.4 数据分析
所有实验结果均以3个平行组的平均值±标准差(Means ± S.D)表示。用数据软件SPSS 17.0 进行单因素方差分析(One-Way ANOVA)和Duncan检验,P<0.05代表差异显著。
2 实验结果(Results)
2.1 致死和生长
试验期间测定的各浓度组水体中对二甲苯的浓度分别为(18.25±0.5)、(34.52±0.5)、(72.63±0.8)、(147.24±0.6)和(303.77±0.5) mg·L-1。对二甲苯对褐牙鲆幼鱼的96 h-LC50是45.7 (33.516~59.741) mg·L-1。回归方程y=-4.328+2.607x。试验过程中对照组没有死亡现象,其中20 mg·L-1染毒组的死亡率为25%,320 mg·L-1染毒组褐牙鲆幼鱼的死亡率为100%。
如图表1为褐牙鲆幼鱼经过28 d暴露后,增重率和特定生长率的抑制情况。2.3、4.6和9.2 mg·L-1暴露组的增重率和特定生长率与对照组相比受到显著抑制(P<0.05)。其中9.2 mg·L-1的暴露组中褐牙鲆幼鱼的生长抑制达到最高,增重率和特定增长率分别为对照组的21.27%和23.07%。
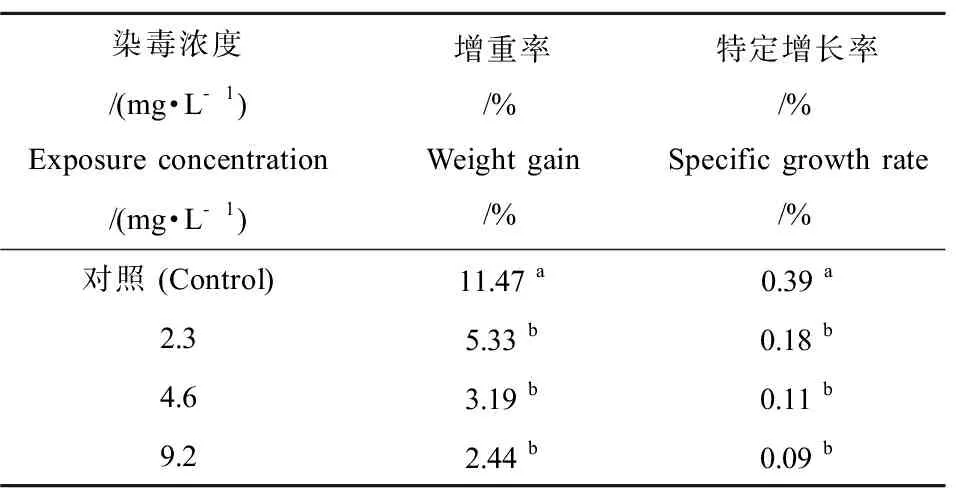
表1 对二甲苯暴露28 d后对褐牙鲆幼鱼的生长抑制效应Table 1 Effects of p-xylene on growth of P. olivaceusafter 28 days of feeding
注:数据用平均值±标准差(Means ± S.D)表示,同列中不同字母表示2组间差异显著(P< 0.05)。Note: Data are presented as means ± S.D. Means in the same column with different letters differ significantly from each other (P< 0.05).
2.2 对二甲苯对褐牙鲆幼鱼肝脏的脂质过氧化与DNA损伤效应
经过不同浓度和时间的对二甲苯暴露后,实验鱼肝组织的MDA含量变化如图1所示:在7 d时,2.3 mg·L-1浓度组中MDA含量与对照组相比并无显著性差异(P<0.05)。从14 d开始时,各个浓度组MDA含量与对照组相比均表现出显著性差异(P<0.05),各浓度组的MDA含量整体呈现先升高后降低的变化趋势。2.3 mg·L-1和4.2 mg·L-1染毒浓度的褐牙鲆幼鱼肝脏中MDA含量均在14 d时达到最高值,其含量分别为对照组的175.11%和175.85%。在9.2 mg·L-1染毒组中观察到,MDA含量在21 d时达到最高值,其含量约占对照组的197.71%。
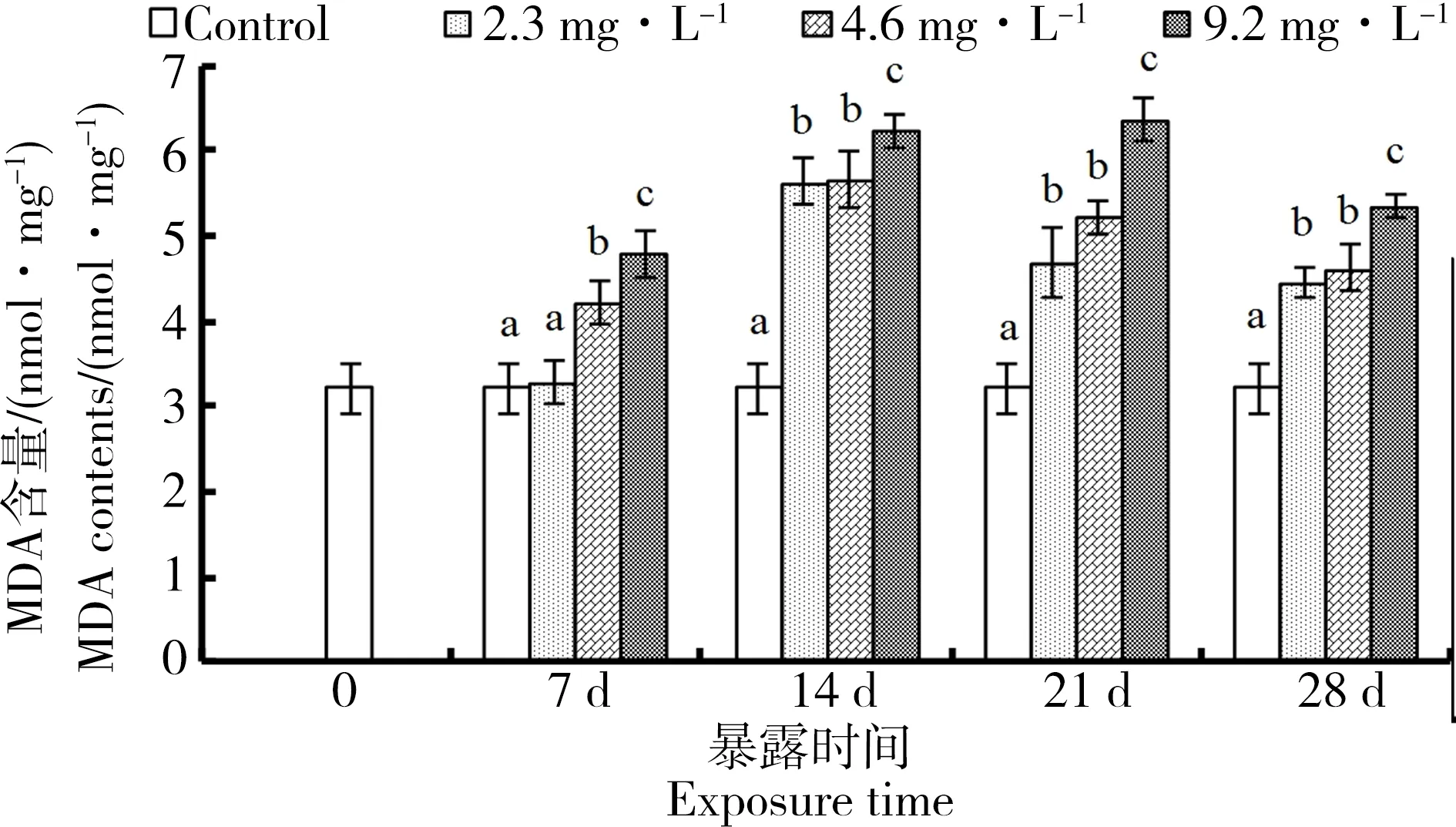
图1 对二甲苯对褐牙鲆幼鱼肝脏脂质过氧化影响Fig. 1 Effects of p-xylene on lipid peroxide (MDA) levels in fish liver

图2 对二甲苯对褐牙鲆幼鱼肝脏DNA损伤的影响Fig. 2 Effects of p-xylene on DNA damage (F value) levels in fish liver
对二甲苯对褐牙鲆幼鱼DNA碱解旋的影响如图2所示:对二甲苯对褐牙鲆幼鱼肝脏DNA损伤存在时间-剂量效应关系,随着暴露浓度和染毒时间的增加,DNA损伤增加。7 d时各浓度组与对照组相比并没有显著性变化(P<0.05),28 d时,各浓度组与对照组相比显著降低(P<0.05),分别为对照组的75.92%、64.81%和61.11%。
2.3 对二甲苯对褐牙鲆幼鱼脑组织AChE活力的影响
对二甲苯暴露质量浓度与AChE活性之间具有明显的剂量-效应关系(图3):随着染毒时间和暴露浓度的增加,2.3、4.6和9.2 mg·L-1的暴露组的AChE活性与对照组相比显著降低(P<0.05),并在28 d时达到最小值,分别是对照组的78.11%、65.11%和57.40%。

图3 对二甲苯对褐牙鲆幼鱼脑乙酰胆碱酯酶活性的影响Fig. 3 Effects of p-xylene on brain acetylcholinesterase (AchE) of Paralichthys olivaceus
2.4 对二甲苯对褐牙鲆幼鱼的总血细胞数量和溶菌酶活力的影响
对二甲苯对褐牙鲆幼鱼的总血细胞数量影响显著(P<0.05),7 d时各浓度组总血细胞数量显著高于对照组(P<0.05),14 d时9.2 mg·L-1染毒组的血细胞数量显著降低并达到最低值,血细胞数量是对照组的68.49%。14 d和21 d时2.3和4.6 mg·L-1浓度组的血细胞数量仍显著高于对照组,而9.2 mg·L-1浓度组的血细胞数量低于对照水平(图4)。对二甲苯能够显著降低褐牙鲆幼鱼血清溶菌酶活力(P<0.05),随着染毒时间增加(14~28 d),各染毒组(2.3,4.2和9.2 mg·L-1)溶菌酶活力显著下降,而对照组在试验期间并无显著性变化。2.3、4.6和9.2 mg·L-1染毒组分别于21 d和28 d时达到最小值,分别为对照组的60.71%、73.91和81.19%(图5)。

图4 对二甲苯对褐牙鲆幼鱼血细胞总数的影响Fig. 4 Effects of p-xylene on total hemocyte counts of P. olivaceus

图5 对二甲苯对褐牙鲆幼鱼血清中溶菌酶活力的影响Fig. 5 Effects of p-xylene on lysozyme activity of P. olivaceus
3 讨论(Discussion)
3.1 对二甲苯对褐牙鲆幼鱼存活和生长的影响
已有研究表明,二甲苯对花条鲈鱼(Moronesaxatilis)、黑头呆鱼(Pimephalespromelas)、网纹鳉(Poeciliareticulata)、虹鳟鱼(Oncorhynchusmykiss)和鲫鱼(Carassiusauratus)的LC50分别为2.0 μL·L-1(96 h)、8 870 μg·L-1(96 h)、8 800 μg·L-1(96 h)、2 600 μg·L-1(96 h)和18 000 μg·L-1(24 h)[18-21]。本实验研究获得对二甲苯对褐牙鲆幼鱼的96 h-LC50值为45.7 mg·L-1。由此表明6种鱼类对对二甲苯的敏感度依次为花条鲈鱼>虹鳟鱼>网纹鳉>黑头呆鱼>鲫鱼>褐牙鲆。根据化学物质对鱼类毒性分级标准(国家环保局水和废水监测分析方法编委会,2002),二甲苯对褐牙鲆幼鱼的毒性属于中等毒性,与范亚威和周启星[6]对斑马鱼的研究结果一致。目前关于对二甲苯对鱼类生长抑制的研究还未有报道,本研究表明,2.3、4.6和9.2 mg·L-1这3个染毒组均能显著抑制牙鲆幼鱼体重的增加,并降低其增重率和特定增长率,这表明暴露于对二甲苯(>2.3 mg·L-1)28 d对褐牙鲆幼鱼具有显著的生长抑制作用。
3.2 对二甲苯对褐牙鲆幼鱼的肝脏毒性
二甲苯在哺乳动物肝脏内代谢主要通过一个甲基的氧化进行,通过细胞色素CYP450 2E1将污染分子转化成甲基苄醇,进一步通过生物转化为甲基丙二酸[22]。在这一代谢过程中,组织中的氧化自由基增加,可诱发生物体内的脂质过氧化、DNA链断裂等氧化损伤[23],因此查明这些生物标志物的活性变化可反映氧化应激的存在,常被作为环境污染胁迫的生物标志物。
丙二醛(MDA)含量是脂质过氧化反应的分解产物,MDA的产生主要是由于未经抗氧化酶转化的超氧阴离子及其他自由基对细胞膜多不饱和酸进行攻击,产生了LOOH等过氧化物所致,其含量能够反映脂质过氧化的水平[24]。Jajte等[25]研究发现对二甲苯的脂质过氧化作用是其诱导小鼠肝脏毒性的主要途径。本实验研究表明,2.3 mg·L-1浓度组肝脏中的MDA含量在7 d时与对照组并无显著差异,14 d以后各浓度组的MDA含量均显著增加;在9.2 mg·L-1处理组中观察到,MDA含量在21 d时达到最高值。已有研究表明,对二甲苯能够显著影响大弹涂鱼肝脏中的MDA含量,且肝脏中MDA的产生主要是由于谷胱甘肽的再生量不足以完全清除LOOH,使过氧化物再经分子内的环化、裂解等步骤产生[26]。在本研究中对二甲苯暴露7 d时未产生脂质过氧化损伤表明短期暴露机体内的抗氧化系统能够去除多余的活性氧(ROS),因而氧自由基并未对肝脏细胞造成明显损伤,然而高浓度组在21 d时MDA含量显著增高表明高浓度长期的暴露会导致褐牙鲆幼鱼肝脏中的脂质过氧化增加,氧自由基对褐牙鲆幼鱼的肝脏细胞造成明显的毒性作用。
已有研究表明二甲苯暴露能够对哺乳动物和人类造成DNA损伤。吕丹瑜等[27]的研究表明,二甲苯可引起妊娠母鼠外周血有核细胞DNA损伤。倪祖尧和逢兵[28]研究发现接触苯、甲苯和二甲苯的工人外周血细胞会造成DNA损伤。但是目前对二甲苯对水生生物,尤其是鱼类的遗传毒性作用所知甚少。本实验中褐牙鲆幼鱼肝脏F值在7 d时各浓度组与对照组相比无显著性差异,Rogers等[29]对小鼠的研究同样也表明了短期对二甲苯的暴露不能对小鼠造成DNA损伤,这与本实验的研究结果一致。因此作者认为对二甲苯暴露并不能在短时间内对褐牙鲆幼鱼肝脏造成DNA损伤。另外本实验研究显示在14、21和28 d时,各浓度组均与对照组显著性差异(P<0.05),且均有良好的时间-剂量效应关系。由此说明对二甲苯长期(28 d)暴露能够引起幼鱼肝脏的DNA损伤。对于苯类物质产生DNA损伤的机制,Andreoli等[30]的研究表明,苯在肝脏中经细胞色素P4502E1酶的催化作用,代谢成酚的代谢物,这些产物经氧化还原产生羟自由基等活性氧物质,从而导致DNA链断裂;Niaz等[31]的研究表明对二甲苯属于高脂溶性有机溶剂,能够使细胞膜破裂,产生DNA裂解酶,最终造成DNA链断裂。由本实验得到的对二甲苯导致的脂质过氧化损伤结果,作者推测对二甲苯所致的氧化损伤可能是造成褐牙鲆幼鱼DNA损伤的主要途径。
3.3 对二甲苯对褐牙鲆幼鱼的脑神经毒性
AChE是与神经活动密切相关的重要物质,是表征污染物神经毒性的重要生物标志物[32]。Sandahl等[33]的研究发现,AChE活性抑制和鱼类的游泳以及摄食能力具有明显的正负相关性。Le Bris等[34]和Sturm等[35]也证明抑制AChE活性,能够降低鱼类的摄食活动,进而影响鱼类的生长。本文结果表明,对二甲苯(2.3~9.2 mg·L-1)作用下能够显著诱导褐牙鲆幼鱼脑组织内AChE活性,且AChE酶活力下降与染毒浓度以及暴露时间与具有明显的正负相关性。因此作者认为对二甲苯的神经毒性可能是造成的褐牙鲆幼鱼的生长抑制效应的重要原因。对二甲苯具有挥发性和脂溶性高等特征,其穿过血脑屏障后能改变相邻细胞之间的渗透性和神经信号的传导功能,甚至促使细胞膜和膜质中的脂类物质溶解,从而诱发神经毒性[36]。颜士勇等[37]的研究证实,二甲苯对大鼠神经细胞具有直接的毒性作用。本研究中长期暴露下对二甲苯对褐牙鲆幼鱼肝脏造成了显著的脂质过氧化损伤,这表明对二甲苯对褐牙鲆幼鱼的长期毒性效应会导致大量活性氧自由基无法清除。由于脑组织内抗氧化防御酶系表达量较低,极易受到自由基的攻击[38],因此对二甲苯的脂质过氧化损伤也可能造成褐牙鲆幼鱼的神经毒性,而其对褐牙鲆脑组织的氧化损伤效应有待于进一步的研究。
3.4 对二甲苯对褐牙鲆幼鱼的免疫毒性
血液指标被广泛地用于评价鱼类的健康状况以及对环境的适应能力,同时也作为毒理学指标用来反映污染物对鱼类免疫水平的影响[39]。鱼类血细胞数量变化是机体在环境胁迫下敏感的特征性指标[40]。杨洪波等[41]研究发现,鱼类受到药物刺激时,耗氧率增加,与对照组相比红细胞数量有所升高,崔素丽[42]在研究中也指出当机体受到外界因子刺激而发生应激反应时,白细胞数量会增加。本试验研究表明,2.3和4.6 mg·L-1染毒组在7、14和28 d时血细胞数量显著高于对照组。9.2 mg·L-1浓度组在7 d时血细胞总数显著高于对照,随着染毒时间的延长,血细胞数量呈明显下降趋势,并显著低于对照组。根据Toxtree数据库对化学物质的分类可知,对二甲苯属于非极性麻醉化学物质,其致毒机理主要由于其能够非选择性通过细胞膜,对细胞结构造成损伤发挥其毒性作用[43]。几项研究也表明,长期暴露在对二甲苯条件下会增加肺组织细胞凋亡,淋巴细胞以及肾小管近端细胞的细胞调亡数量[44-46];白雪等[2]的研究表明,随着染毒剂量的升高对二甲苯染毒组的细胞凋亡率显著升高。因此作者认为,高浓度的对二甲苯可能引起了血细胞凋亡而导致血细胞数量降低,进而影响褐牙鲆幼鱼的血液功能,降低其免疫力。溶菌酶在鱼类非特异性免疫中发挥着重要作用,是鱼类免疫防御水平的另一个重要指标[47]。本实验研究表明,对二甲苯染毒暴露对牙鲆血清中溶菌酶活力具有显著抑制作用。一般认为,鱼类在低浓度的外源污染物刺激时,能够造成免疫系统产生代偿性应激来调节自身状态,然而在高浓度长时间暴露下则会超出其生理调节能力,产生免疫毒性[48]。本研究结果表明对二甲苯长期(28 d)暴露下抑制了褐牙鲆幼鱼的血细胞和溶菌活力,而其对褐牙鲆幼鱼免疫力的影响有待于通过病原攻毒实验进一步证实。
致谢:感谢中国海洋大学水产动物环境生理学研究室的同学们在实验动物养殖管理和取样中给予的帮助。

