百草枯通过调节Rac1-ROS信号通路促进肺上皮细胞上皮间质转化
王晖晖 凌冰玉 张继燃 徐继扬(通讯作者)
(江苏省苏北人民医院急诊科 江苏 扬州 225001)
目前百草枯致肺纤维化的机制尚不明确,近年来研究表明肺泡上皮细胞可通过上皮间质转化(epithelial-to-mesenchymal transition,EMT)向肌成纤维细胞转化[1]。研究证实EMT是肺纤维化发生发展的重要机制,而肺上皮细胞EMT的发生是肺纤维化形成的重要标志之一[2-3]。
Rac1(Ras-related C3 botulinum toxin substrate 1)属于小G蛋白超家族的重要成员之一,在多种细胞内具有调节肌动蛋白细胞骨架重组,导致细胞板状伪足形成和膜褶皱样运动,影响细胞形体极化,促进细胞运动与迁移,促进细胞内活性氧(Reactive oxygen species,ROS)产生等作用[4]。本课题组前期研究不同活性的Rac1质粒瞬时转染肝上皮细胞,证明Rac1可促进EMT。但是Rac1在百草枯肺纤维化的EMT中的作用尚不清楚,本文将通过转染不同活性的Rac1质粒到人肺上皮细胞HPAEpiC中,观察其EMT的作用。
1.材料与方法
1.1 细胞与试剂
人肺上皮细胞株HPAEpiC购自美国ATCC;百草枯购于Sigma公司;DEME培养基、胎牛血清购于Gibco公司;MTT试剂盒购于Thermo Fisher公司;Vimentin抗体购于Merck&Millipore公司;α-SMA抗体购于Sigma公司;β-actin、CK-8、E-cadherin购于Bioworld公司;Lipofectamine2000购于Invitrogen公司;ROS试剂盒购于南京建成生物工程研究所。
1.2 细胞培养
取人肺上皮HPAEpiC细胞,培养于含10%胎牛血清的DEME培养基中(37℃、5%CO2),待细胞融合至90%左右,用0.25%胰酶-EDTA 消化、传代。
1.3 细胞转染
从标准定义可以看出,t_source只是针对能够响应从帧的源设备的要求,但是RPT并不在此范围内。标准中关于RPT的性能要求描述详见IEC 61375-3-1-2012中的5.3.1章节。其中,与本文所描述问题相关的标准中的第一条,从字面上理解为,RPT能够识别数据帧的初始方向并能保持稳定时间T_ST=2.0 μs,即RPT在从A侧向B侧转发数据帧结束后的2.0 μs时间内将无法转发B侧发来的数据帧。这正是本文中描述的列车通信故障所处的工况:主设备BA与从设备D3分别位于RPT的A、B两侧,中继器从A侧接受了主帧转发到B侧,然后又将B侧发来的从帧转发到A侧。
将对数生长期的HPAEpiC细胞以每孔2×105个细胞接种于6孔细胞培养板,37℃培养过夜。根据Lipofectamine2000说明书操作步骤,将质粒转入细胞内,4~6h后换成正常培养基。
1.4 MTT取4×103人肺上皮 HPAEpiC细胞接种于96孔板,24h细胞贴壁后,加入不同浓度的(200、100、50、20、10、5、0μmol/L)PQ溶液,每组设3个平行孔,培养72h后,各孔加入20μg的MTT溶液(0.5%),37℃培养箱中孵育4h,再加入150μg二甲基亚砜(DMSO),摇床10分钟轻轻地混匀,酶联仪上选择检测波长490nm比色测定各孔的吸光度(OD值),计算IC50值。
1.5 细胞蛋白的检测
采用 Western blotting法,取经过预处理的细胞,加PBS洗涤,加入RIPA裂解液冰上裂解30min,30min后4℃、12000r/m离心10min,取上清液于-20℃保存。各组蛋白等量加样,10%SDS-PAGE凝胶电泳分离蛋白,200mA恒流转至PDVF膜上,5%脱脂奶粉封闭1h,加入一抗室温孵育过夜,TBST洗涤3次,HRP标记的二抗室温孵育2h,TBST洗涤3次,加ECL发光液化学发光显色,压片曝光。
1.6 细胞迁移能力检测
采用Transwell小室实验,转染细胞4~6h,胰酶消化,调整各组细胞使其细胞数为1×104/ml。取各组细胞200μl加入各小室,下室加入500μl的10%FBS-DEME培养基,常规培养24h,PBS洗涤3次,4%多聚甲醛固定,结晶紫染色,光镜下随机选取6个视野,在倒置显微镜拍照、计数,取平均值。
1.7 ROS的检测
取按照上述分组培养的细胞,加入2’,7’-二氯二氢荧光素黄二乙酸酯(DCFH-DA)探针孵育30min后取细胞沉淀,PBS悬浮细胞,525mm的发射波长和488mm的激发波长检测刺激后的荧光强度。计数1×104个细胞,以DCFH-DA(DCF)的平均荧光强度表示ROS的生成量。
1.8 统计学处理
2.结果
2.1 PQ对HPAEpiC细胞增殖影响
以不同浓度PQ孵育HPAEpiC细胞,在不同时间点收集细胞,使用MTT法检测PQ对肺上皮细胞的增殖影响。如图1A所示,PQ诱导肺上皮细胞死亡呈现剂量和时间依赖性关系,PQ抑制HPAEpiC细胞的IC50值为91.3μmol/L(图1B),结合IC50和生长曲线,我们确定50μmol/LPQ用于后续实验。

图1
2.2 Rac1促进间质表达,抑制上皮表达
与对照组细胞相比,空质粒、PQ组和野生型Rac1细胞CK8、E-cadherin表达减少,Vimentin、α-SMA表达增加(P均<0.05,图2);与空质粒组、PQ组和野生型Rac1组比,持续激活型Rac1转染细胞CK8、E-cadherin表达减少,Vimentin、α-SMA表达增加,而显性负调控Rac1转染细胞CK8、E-cadherin表达增加,Vimentin、α-SMA表达减少,以上差异具有统计学意义(P均<0.05,图2)。

图2 各组细胞CK8、E-cadherin、Vimentin、α-SMA的表达情况
2.3 Rac1促进HPAEpiC细胞迁移 与对照组细胞相比,空质粒、PQ组和野生型Rac1细胞迁移能力增加(P均<0.05,图3);与空质粒、PQ组、野生型Rac1转染细胞比,持续激活型 Rac1转染的HPAEpiC细胞迁移能力增加,而显性负调控Rac1转染细胞迁移能力减弱(P均<0.05,图3)。图3各组细胞迁移能力的检测
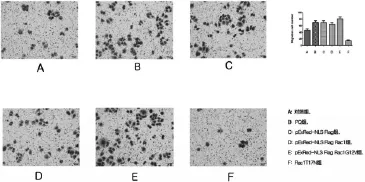
图3
2.4 Rac1促进HPAEpiC细胞ROS的表达
与对照组细胞相比,空质粒、PQ组和野生型Rac1 细胞ROS表达明显增高,(P均<0.05,图4);与空质粒、PQ组和野生型Rac1转染细胞比,持续激活型Rac1转染细胞ROS表达较高,而显性负调控Rac1转染细胞ROS表达相对较低(P均<0.05,图4)。
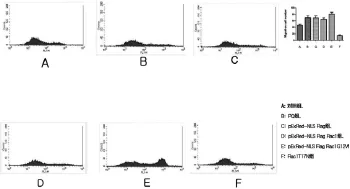
图4 各组细胞的ROS表达情况
3.讨论
百草枯中毒后可引起多脏器损害,而肺脏是其重要的靶器官,引起不可逆的肺间质纤维化,治疗效果差。因此研究百草枯致肺纤维化的机制成为了急诊中毒领域的难点和重点。
EMT是具有极性的上皮细胞转化成具有活动能力、能在细胞基质间自由移动的间质细胞的过程,其以上皮细胞极性的丧失和间质特性的获得为特征。体内外研究发现百草枯通过调控β-catenin来诱导EMT的发生,进而促进肺纤维化的形成[5-6];通过博莱霉素诱导的肺纤维化动物模型中,蔡琳等证实肺泡上皮细胞可以通过EMT向MFs转化[7]。
大量研究表明,氧化应激与肺纤维化的关系密切,百草枯可通过氧化还原反应在细胞内产生过量ROS,从而引发肺及各脏器细胞膜脂质氧化应激损伤。研究显示MMP3处理小鼠乳腺上皮细胞时,Rac1b可促进ROS的产生,而ROS可刺激转录因子Snail的表达和EMT的发生[8]。Rac1、ROS表达或活性的异常升高在肺纤维化过程中起着重要作用,但两者的相互作用及具体机制尚不清楚。
我们研究证实,与阴性对照组相比,PQ可刺激人肺上皮细胞HPAEpiC,在抑制细胞增殖的同时,增加了迁移能力,同时促进ROS的产生。本实验通过将不同Rac1活性的质粒转染到肺上皮细胞中,证实 Rac1通过以下两个方面影响HPAEpiC细胞 EMT:(1)细胞出现 EMT分子标志物的改变,即上皮标志物CK8、E-cad表达下调、间质标志物 Vimentin、α-SMA表达上调;(2)Tranwell 小室实验证实细胞迁移能力增强。检测不同Rac1活性的质粒转染到肺上皮细胞后,Rac1可促进肺上皮细胞的ROS表达,表明Rac1-ROS在PQ致肺上皮细胞EMT的过程中起着关键的作用。基于以上研究,我们推测PQ通过激活Rac1-ROS信号通路来启动EMT,从而使得HPAEpiC细胞的迁移能力增强,促进了肺纤维化的发展。
综上所述,本研究通过将上调和下调Rac1活性的质粒转染到HPAEpiC细胞,初步证实Rac1-ROS可促进PQ诱导的肺上皮细胞EMT。因此深入研究Rac1-ROS在PQ致肺纤维化过程中的作用及其具体机制具有重要意义,将为PQ肺纤维发生发展及靶向治疗提供有价值的理论依据。

