小议冷冻电镜技术对生物分子成像发展的影响
邹文康


【摘 要】冷冻电镜技术已经成为解析生物大分子结构的强有力手段,并且在相关领域取得瞩目的成绩。介绍了冷冻电镜的基本原理以及发展历程,最后对冷冻电镜的发展应用进行了初步的探讨。
【关键词】冷冻电镜;透射电镜;高分辨结构
一、引言
北京时间2017年10月4日,2017年度诺贝尔化学奖最终授予了Richard Henderson、Joachim Frank和 Jacques Dubochet三位科学家,以表彰他们在发展冷冻电镜技术中所作出的杰出贡献。冷冻电镜广泛应用于研究生物大分子结构,由于该技术能够快速、高效、精确地解析复杂的生物大分子结构,现在已经逐渐成为检测生物大分子结构的主流手段。
二、冷冻电镜的基本原理
冷冻电子显微镜技术(cryo-electron microscopy,cryo-EM),简称冷冻电镜,是利用快速冷冻的技术冷冻生物大分子后,在低温中用透射电子显微镜对样品进行成像,最后通过图像处理获得样品三维结构的一种技术,基本步骤包括制备冷冻样品、电子显微镜二维成像、计算机进行图像处理并重构三维结构等。
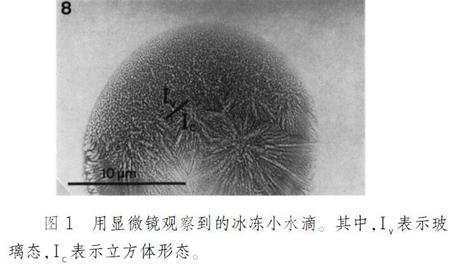
通常将水冷冻时往往会形成冰晶,而冰晶会影响显微镜对样品的成像过程,并且会破坏样品本身的结构,因此,在冷冻电镜中采用快速冷冻的方式使水处于无定形的玻璃态水,如图1所示。制备冷冻样品一般是将样品在特定的湿度和温度中利用特殊载体包裹,并放入经液氮浴冷却的液态乙烷罐中快速形成玻璃态的水,最终获得冷冻样品。并且与一般样品相比,冷冻样品在抗电子辐射的时间和辐射量上有所提高;电子作用于样品时,样品分子也不容易发生漂移,并且背景衬度也有所改善。
冷冻电镜成像的基本原理为:首先由电子枪发射电子束沿着真空通道照射到样品上,透过样品的电子可能出现折射或者反射等不同情况,样品致密处透过的电子少,疏松处则透过的电子多;然后电子束被物镜会聚并放大,最终投射到屏板上,获得图像,如图2所示。举个例子,比如用手电筒照射装有水晶的玻璃球,光线通过放大镜放大映在墙壁上出现影子,即电子束是手电筒的光束,冷冻样品是装有水晶的玻璃球,最终的投影就是电镜中获得的二维图像。而投影中有较暗的地方说明水晶较厚,反之则薄,类比于冷冻电镜中也是一样的。
由于样品之中各个分子的朝向各不相同,从屏板上能够获得成千上万的二维图像。接着计算机根据样品颗粒的方向、结构特点进行解析分类,并且应用相关软件进行三维重构最终得到生物大分子的完整三维结构,如图3所示。
三、冷冻电镜的发展历程
生物大分子通常需要稳定的结构才能发挥生物功能,所以要想更好地研究生物大分子的功能,其中非常重要的是能够了解其独特的结构。一般生物大分子的尺寸都在几个纳米到几十个纳米之间,光学显微镜已经无法观察到生物大分子的结构。于是,科学家们想到用电子显微镜进行观察。透射电子显微镜与光学显微镜的原理相似,是利用电子束穿透样品,电子碰到样品后发生折射等情况,然后电子通过电子透镜放大成像从而得到图像,如图1所示。由于电子的波长仅为光波的十万分之一左右(波长越小,能被显微镜清晰区分的两个物点的最短间距越小),所以理论上电镜是可以获得纳米级的分子结构。
但是,传统透射电子显微镜因为各种原因难以应用于生物样品,比如,透射电子显微镜需要样品在高真空环境下进行检测,而生物样品中有水分,在高真空环境下,水的沸点降低容易挥发; 电子束的高能量在穿透样品时容易将样品损毁,例如维持蛋白质空间结构的氢键仅需很低的能量就会断裂;电子穿过有活性的样品时,有可能使得样品漂移,无法清晰成像; 电子作用于样品与背景后得到的明暗程度差别不大,衬度较低,获得的图像不清晰。随着上述问题不断改善,冷冻电镜应运而生。
1968年,Klug A等人提出获得三维物体不同方向的二维图像后,在计算机中进行重构得到样品三维结构的理论。1974年,Taylor K A等人使用透射电子显微镜成功对冷冻的样品进行成像,至此冷冻电镜诞生。而三位诺贝尔奖获得者又在不同的方面发展了冷冻电镜:1982年,Jacques Dubochet等人发现了水的玻璃态并应用于制备冷冻样品;1990年,Richard Henderson等人成功使用冷冻电镜解析出高度有序的细菌视紫红质蛋白结构,这也是第一次应用冷冻电镜解析出的膜蛋白结构;1995年,Joachim Frank等人成功運用自己的算法解析出大肠杆菌核糖体的三维结构。
冷冻电镜技术逐渐成熟,并且在近些年中飞速地发展,图像分辨率不断提高,其中也依赖许多新技术的出现。第一,由于电子探测器的发明,冷冻电镜无需像从前一样先将电信号转化为光信号再转化回电信号才能得到图像,而是直接探测电子数量甚至在利用互补型金属氧化物半导体(CMOS)感光元件使得探测器能在短时间内获得数十张投影图像,再通过后期处理提高了图像的清晰程度;第二,石墨烯应用于冷冻样品的制备中,使得包裹样品的冰层更薄,能够更好地解析样品结构;另外,计算软件的不断优化更新,使得成像时间更短,重构的三维结构也更精密、更清晰。
目前,冷冻电镜与X射线晶体学和核磁共振在解析和获得生物大分子结构中起到了至关重要的作用。然而,另外两种方法都具有一些局限性,比如,X射线晶体学只能对有序的三维结晶进行检测而大多数蛋白分子难以结晶,核磁共振则需要样品颗粒足够小并且解析图谱的限制比较多。基于以上原因,冷冻电镜技术成为了解析生物大分子的重要工具。
四、应用与展望
目前,冷冻电镜已经成功应用于解析各种生物大分子。2013年,加州大学旧金山分校(UCSF)程亦凡和David Julius的研究组首次得到膜蛋白TRPV1(如图4所示)的3.4埃(1埃等于0.1纳米)近原子级别高分辨率三维结构,标志着冷冻电镜解析进入原子分辨率时代。随后一段时间内,许多结构复杂、对称度低、分子量的蛋白质分子也逐渐被解析,例如剪接体、乳酸脱氢酶等。
五、结束语
冷冻电镜技术目前仍有许多发展空间,例如应用于药物研发,通过解析疾病相关靶标分子的结构,以此开发、合成高特异性的药物或者抑制剂;也可用于解析细胞中的生物大分子原位的三维结构、运动状态等,探索未知的生物活动过程。亦或从本身技术方面切入,例如,开发其他样品载体以改善样品质量,更好地维持样品原有的生物活性;改进和优化图像处理软件算法,开发更精准的二维和三维分类工具以高效构建图像。
【参考文献】
[1]张世超,欧阳燕,刘善辉,朱莉.冷冻电镜单颗粒技术解析生物大分子结构综述[J].生物学杂志,2017(3):74-77
[2]杨涛,贾安宝,阮华斌,王亚坤,刘燕.生物科学计算平台冷冻电镜结构解析实验室管理[J].实验技术与管理,2017(2):227-230

