整合素αvβ3结构与激活及其肿瘤靶向药物的研究进展
戴明权, 金海晓, 严小军
(宁波大学 应用海洋生物技术教育部重点实验室, 宁波 315211)
整合素蛋白(integrin)是一类细胞黏附受体家族蛋白,是由α和β两个亚基通过非共价键结合而成的异二聚体跨膜糖蛋白[1]。整合素能够通过构象变化来实现跨膜双向传导信号,并且主要介导细胞与细胞、细胞与细胞外基质的黏附[1]。
与其他整合素类似,整合素αvβ3结构庞大,它含有αv亚基以及β3亚基,每个亚基中含有数个结构域。并且整合素αvβ3激活过程中会涉及结构域的构象变化以及一些结构域之间的相互作用。此外,整合素αvβ3还是一个癌症治疗及肿瘤显像的靶点[2]。有报道称,整合素αvβ3过量表达极大地驱动肿瘤生长及转移[3]。幸运的是,相应的整合素αvβ3抑制剂也在积极研究当中[4]。本文将从整合素αvβ3与癌症、结构与激活以及整合素αvβ3肿瘤靶向药物这几方面进行综述。
1 整合素αvβ3与癌症
整合素αvβ3与多种癌症有关[3]。在癌症形成过程中,癌细胞与胞外介质作用的调控、癌细胞与周围细胞的黏附能力都对其生长及转移的作用非常显著[3]。在整合素αvβ3协助癌细胞的生存方面,有报道称整合素αvβ3在正常血管中以最低量存在并且保持静止,但是在人癌症新生血管中却显著上调[5]。因此,整合素αvβ3能够通过促进癌症中新生血管生成来协助癌细胞获取营养,以此来协助其生存。在整合素αvβ3对癌细胞的转移方面,有研究表明整合素αvβ3在黑素瘤中的表达与黑素瘤的转移相关[6]。此外,整合素αvβ3在骨组织中能与调骨素以及骨唾液酸糖蛋白作用来促进癌细胞迁移[7]。
2 整合素αvβ3的结构特点与激活过程
2.1 整合素αvβ3的结构
整合素αvβ3包含两个非共价结合的I型跨膜糖蛋白αv亚基和β3亚基。αv亚基的胞外域中含有3个结构:头部结构(β-propeller结构域)、大腿结构(Thigh结构域)以及小腿结构(calf-1及calf-2),见图1-C。β3亚基的胞外域中,βΙ结构域构成头部结构,PSI(plexin/semaphorin/integrin)结构域和hybrid结构域构成大腿结构,EGF (epidermal growth factor)1~4结构域与βTail结构域构成了小腿结构[8](图1)。
其中,β-propeller与βΙ组成了αvβ3配体结合口袋。βI结构域(图2)内部含有6个β折叠组成的β折叠片,它的外周有8个螺旋[9]。βI结构域包含两条长环区,其中一条在底物特异性识别中很重要,称为特异性识别环区(specificity-determining loop,SDL)。
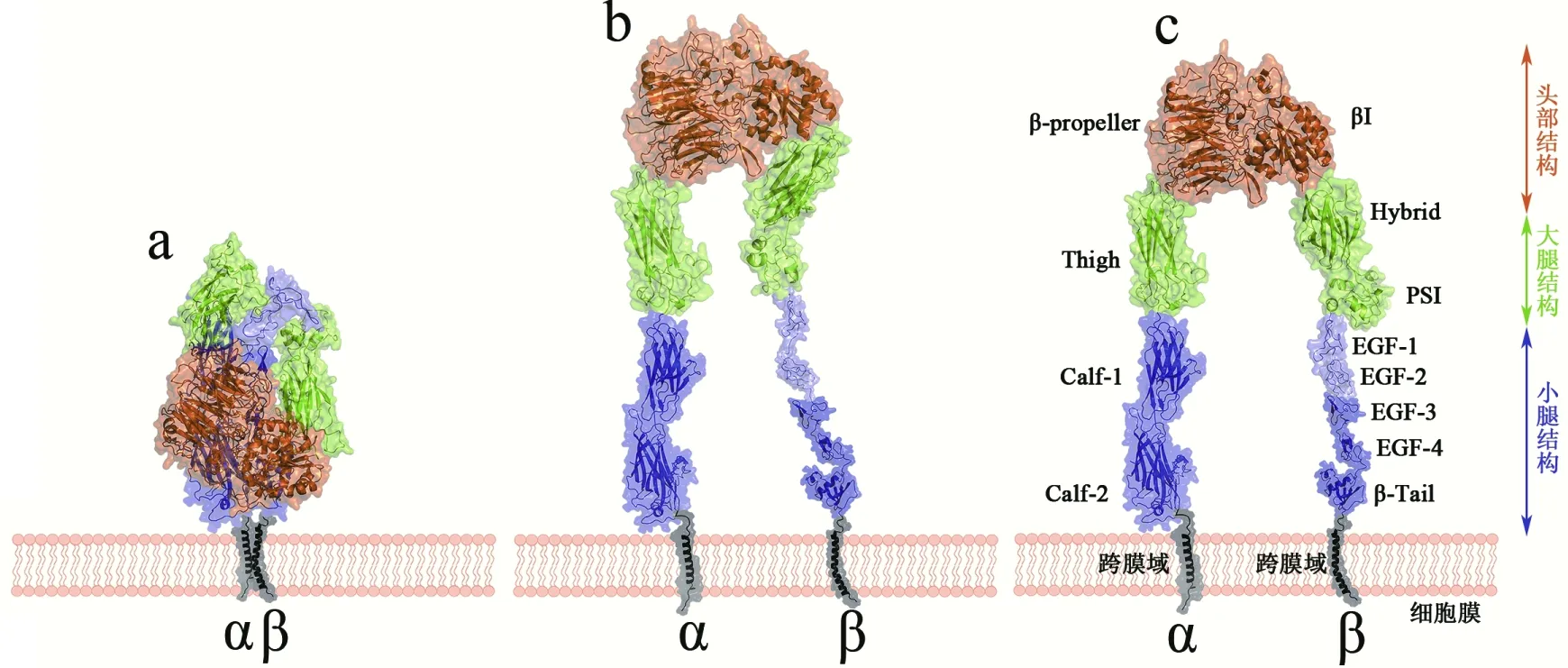
图1 整合素αvβ3三个基本构象Fig 1 Three basic conformational states of integrin αvβ3
A:静止状态;b:部分亲和状态;c:激活高亲和态
2.2 结合口袋中关键金属离子位点
βI结构域中存在3个金属离子结合位点[9]:金属离子依赖性结合位点(Metal ion dependent adhesion site,MIDAS)、临近金属离子依赖性结合位点(adjacent MIDAS,ADMIDAS)和配体相关金属结合位点(ligand-associated metal binding site,LIMBS),见图2。这3个位点能够结合Mn2+、Mg2+以及Ca2+[10]。ADMIDAS离βI结构域中激活相关螺旋(α1螺旋、α7螺旋)最近,MIDAS次之,而LIMBS则离这两个螺旋最远[10]。
这3个金属离子结合位点的特点以及作用各不相同。1)MIDAS。通常而言,整合素的MIDAS中含有保守序列Asp-X-Ser-X-Ser,例如在整合素αvβ3的MIDAS中就包含了Asp119、Ser121、Ser123、Glu220以及Asp251的侧链,这些残基对于金属离子的配位非常关键[8]。有研究表明,通过对残基突变将MIDAS中的金属离子除去后,配体就无法结合到整合素上[11-13],因此MIDAS对配位结合是十分关键的。2)ADMIDAS。ADMIDAS是针对通过高浓度Ca2+抑制整合素激活负调节位点,并且Mn2+与Ca2+竞争这个位点来激活整合素[8,12-13]。在整合素αvβ3非结合低亲和态时,ADMIDAS中的金属离子会与α7螺旋上是Met335的主链羧基氧进行配位以此来稳定整合素的关闭构象[14]。但是当整合素αvβ3处于结合配体高亲和态的时候,ADMIDAS处的金属离子与Met335的主链羧基氧之间的配位键会被打破,α7螺旋会向下进行运动(图3-a、b)。此外,α1螺旋会朝里面运动。这两个重要螺旋的运动就会使得整合素αvβ3达到高亲和状态(图3-b)。有实验表明[13,15-16],将ADMIDAS中的金属离子除去后,整合素会被诱导激活。3)LIMBS。LIMBS是一个配体结合的正向调节位点。有研究表明将LIMBS中的配位残基突变后会抑制配体结合[17],因此LIMBS也是整合素激活所必须。此外,有报道称LIMBS中的金属离子会与特异性确定环区(specificity-determining loop, SDL,β3亚基中159~191号残基)中保守的芳香族残基形成一个离子-π作用[18],这个作用不仅帮助LIMBS中的金属离子稳定配位,还帮助SDL维持正确的构象。
最近,金属离子与αvβ3激活状态以及αvβ3靶向放射性示踪剂三者之间也有相关研究进展[19]。Andriu等的研究结果显示[19],用Mn2+将整合素αvβ3激活后,放射性示踪剂结合率上升。此外,当抑制基本的信号传导后,整合素αvβ3的活性降低。相应地,放射性示踪剂的结合下降。此外,当有Mn2+存在时,即使细胞表面αvβ3表达并没有显著提高,放射性示踪剂在PC3及U87MG细胞系上的结合也会显著提高。相比之下,Mg2+并不会提高放射性示踪剂等结合到细胞上,而Ca2+反而会降低放射性示踪剂的结合。
2.3 整合素αvβ3的激活过程
整合素αvβ3存在3类基本构象:即弯折构象(图1-a)、中等亲和性构象(图1-b)以及高亲和性构象(图1-c)[8,20]。αvβ3激活时,会逐渐从弯折构象转变到中等亲和性构象,最后达到高亲和性构象。其中包含两个步骤,即inside-out过程及outside-in过程。
首先,细胞内部信号变化使得胞内尾巴分离,跨膜域则随之分开,αvβ3胞外域底部分开。之后,αvβ3亚基大腿结构和头部结构向上延伸,达到低亲和态,此过程为inside-out[21]。

图2 βI结构域结构
接下来则是outside-in过程[22]。配体与整合素αvβ3结合后,βΙ结构域中βF-α7环区向下运动,α7螺旋向下移动随后向外摆开(图3-b)。同时βΙ上的α1螺旋向上运动,有利于其底部的hybrid结构域外摆(图3-b)[11]。此外,金属离子配位也会发生变化,如图3-a显示(PDB ID:1L5G, 1JV2),当αvβ3结合配体后,由于βA-α1环区带着ADMIDAS的配位残基朝配体方向移动,且Mn2+对羰基配位倾向低,因此βF-α7环区上Met335主链羧基氧与ADMIDAS上Mn2+的配位键断裂。所以,βF-α7环区与α7螺旋一起向下移动[13]。α7螺旋向下移动后,它末端两个残基从螺旋中打开。于是,α7和βC之间的连接区域得到延伸(图3-c),使α7和βC之间的角度变大,并使hybrid外摆。由于PSI结构域和hybrid连接紧密,PSI随着hybrid一起朝外摆开后,紧靠PSI的“膝盖”也向外移动。这一过程扩大并且传导了βI结构域的变构效应到β亚基大小腿之间的“膝盖”上,让αβ两亚基的“膝盖”之间分开一定距离 (图1-b、c),最终使整合素αvβ3达到完全激活状态。
3 整合素αvβ3靶向药物
3.1 肿瘤显像药物
对肿瘤显像药物的具体描述见表1。
3.1.1 单功能肿瘤显像药物
1)68Ga-BBN-RGD。蛙皮素是一种哺乳动物胃泌素释放肽(GRP)的两栖动物同源物[23],能够靶向结合前列腺癌诊断标志物胃泌素释放肽受体(GRPR)。而蛙皮素-RGD异二聚肽(BBN-RGD)则由蛙皮素部分序列(7~14号氨基酸,序列:Gln-Trp-Ala-Val-Gly-His-Leu-Met-NH2)与整合素αvβ3靶向结合的c(RGDyK)通过谷氨酸接头连接获得。因此,BBN-RGD能够同时靶向结合αvβ3以及GRPR。Zhang等将BBN-RGD标记上68Ga后,通过68Ga-BBN-RGD与68Ga-BBN对比研究来评估68Ga-BBN-RGD的安全性及其对前列腺癌病人的临床诊断价值[24]。结果发现,当受试病人的平均注射剂量为(107.3±14.8) MBq时,经两周的追踪调查后并未发现副作用。每个病人在注射了129.5 MBq (3.5 mCi)的药物后所受到的辐射剂量(2.90 mSv)远低于FDA限定量。此外,在组织活检结果显示,68Ga-BBN-RGD PET/CT检测出3/4的病人所患肿瘤,14处转移性淋巴结以及20处骨病变。相比之下,68Ga-BBN PET/CT显像只检测出了2/4的病人所患肿瘤,5处转移性淋巴结以及12处骨病变,并且68Ga-BBN-RGD PET/CT显像所检测出的每一项的最大标准吸收值(SUVmax)均高于68Ga-BBN PET/CT显像的SUVmax。因此,新型整合素αvβ3及GRPR双靶向PET放射性示踪剂68Ga-BBN-RGD能够安全并高效地对前列腺癌进行诊断及分期。

图3配体结合前后金属离子配位变化(a);整合素激活过程βI及Hybrid构象变化(b);整合素激活过程中βI的α7螺旋的变化(c)
Fig 3 Metal ion coordination difference after ligand binding(a). The conformational changes in βI domain and hybrid domain during the integrin activation(b). The changes of α7 helix in βI domain during the integrin activation(c)
2)18F-Alfatide。18F-Alfatide(18F-AlF-NOTA-PRGD)是一种利用氟铝络合物进行标记的PRGD2肽[25],具有良好的整合素αvβ3靶向结合性质。Zhou等运用18F-Alfatide对非小细胞肺癌(NSCLC)病人的淋巴结转移进行术前显像检测,且在术后对淋巴结切开进行评估[26]。结果显示,192个淋巴结中有20个为恶性,并且所有恶性淋巴结均在18F-Alfatide PET/CT中显像,其灵敏性为100%,特异性为94.9%,精度为95.4%。此外,在药物吸收方面,恶性淋巴结中对18F-Alfatide的最大标准吸收值、平均吸收值以及平均吸收率均显著高于良性淋巴结。因此,18F-Alfatide对NSCLC病人转移性淋巴结的诊断非常有意义。
3.1.2 多功能肿瘤显像药物
1)131I-RGD-BSA-PCL。131I标记的RGD-牛血清白蛋白-聚己内酯(131I-RGD-BSA-PCL)可以作为靶向结合整合素αvβ3的放射性肿瘤显像剂且是一个潜在肿瘤治疗药。Ming等用小鼠肺癌模型来探究131I标记的RGD-牛血清白蛋白-聚己内酯(131I-RGD-BSA-PCL)在生物体内辐射的效应及效果[27]。结果显示,RGD-BSA-PCL或BSA-PCL与细胞孵育1 h后就能观察到荧光,8 h后萤光信号仍然存在。131I标记的BSA-PCL (131I-BSA-PCL)在24 h及72 h的肿瘤吸收平均数均显著高于其他器官。131I-RGD-BSA-PCL 在24 h及72 h的肿瘤吸收率显著高于没有结合RGD的131I-BSA-PCL。有意思的是,用131I-RGD-BSA-PCL处理的小鼠体重下降为3.5%,远远小于摄入食盐水组(21.5%)。此外,用131I-BSA-PCL以及131I-RGD-BSA-PCL处理的小鼠生存时间中位数分别为延长了23 d及27 d。
2)cRGD-IR-780 SLNs。IR-780是一种优良的治疗诊断近红外染料。由于IR-780荧光显像灵敏度高、荧光强度高并且稳定性强,因此它能够用于近红外荧光显像及光热治疗[28]。Ye等将固体脂质纳米粒子(SNLs)与靶向结合αvβ3的c(RGDyK)结合制成一个高效的运载体,来提高IR-780向肿瘤的靶向运输量,并通过实验进行验证[29]。实验结果显示,多功能的cRGD-IR-780 SLNs具有理想的分散性、良好的稳定性,并且它能高效靶向结合过量表达的αvβ3。此外,体外实验结果显示U87MG细胞或者U87MG移植瘤可以在激光照射下,通过cRGD-IR-780 SLNs来根除。因此,cRGD-IR-780 SLNs除了可以成为一种非放射性肿瘤显像剂之外,还有可能成为一种NIR引导的靶向光热治疗药。
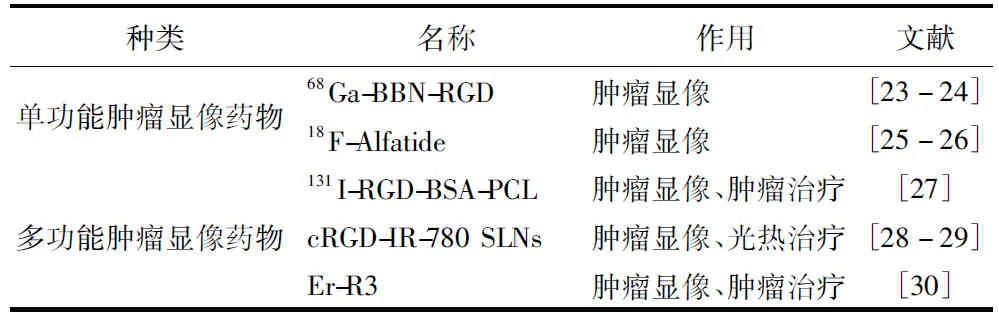
表1 肿瘤显像药物
3)Er-R3。Zhou等合成了多个稀土元素卟啉光动力治疗(PDT)药,并在膀胱癌中对其进行肿瘤显像及光动力治疗实验[30]。结果显示,双功能铒卟啉肿瘤显像及PDT药物(Er-R3)能特异性靶向结合过量表达的αvβ3,以此来对膀胱癌细胞产生高度选择性,并能通过卟啉基团产生1O2来杀死肿瘤细胞,同时还有很强的近红外发射来进行荧光显像。
3.2 靶向运输治疗药
对靶向运输治疗药的具体描述见表2。
3.2.1 放射性靶向运输治疗药
1)225Ac-IA-TLs。Sattiraju等将锕-225标记在整合素αvβ3特异性脂质体(IA-TLs)最终获得放射性标记的靶向结合脂质体225Ac-IA-TLs,拟通过放射性核素来提高血脑屏障(BBB)以及血瘤屏(BTB)的渗透性[31]。实验结果显示,225Ac-IA-TLs显著提高了患胶质母细胞瘤小鼠BBB及BTB的渗透性。此外,肿瘤处有典型的α粒子诱导的DNA双链断裂,但是在远离肿瘤的正常脑组织中并未出现显著的损伤。225Ac-IA-TLs不仅能够提高BBB及BTB的渗透性,还能作为放疗药直接抗癌。

表2 靶向运输治疗药物
2)67Cu-cyclam-RAFT-c(-RGDfK-)4。Copper-67 (67Cu)是一种有前景的内放疗药。Jin等用67Cu来标记αvβ3靶向结合的RGD环肽结合物cyclam-RAFT-c(-RGDfK-)4,获得67Cu-cyclam-RAFT-c(-RGDfK-)4后,对其进行动物实验[32]。实验结果显示,67Cu-cyclam-RAFT-c(-RGDfK-)4在体内外血浆稳定性均非常良好,并且将67Cu-cyclam-RAFT-c(-RGDfK-)4静脉注射到患胶质母细胞瘤小鼠中,发现其显著延缓肿瘤生长。同时,治疗的小鼠也未出现显著毒性。
3.2.2 非放射性靶向运输治疗药
1)RGD-IFN-α2a-core。干扰素(IFN)能够控制免疫应答以及抗肿瘤活性。Wen等将两个INF-α2a-core与靶向结合整合素αvβ3的RGD(Arg-Gly-Asp)进行了重组表达。获得两个RGD-IFN-α2a-core融合蛋白后,对它们进行体外抗肿瘤活性评价[33]。实验结果显示,这两个RGD-IFN-α2a-core融合蛋白能特异性地结合到肿瘤细胞表面,且不会结合到普通细胞上。这两个融合蛋白治疗肿瘤细胞后,极大地降低了细胞活性,并且诱导肿瘤细胞凋亡。此外,两个蛋白都能在mRNA水平上提高CASP3表达。
2)cRGD-SCM/DOX。Shen等用c(RGDfC)修饰的聚乳酸立体复合胶束(cRGD-SCM)装载抗肿瘤药物阿霉素(DOX),并对其展开研究[34]。研究结果表明,装载阿霉素的cRGD-SCM(cRGD-SCM/DOX)相较于DOX单体以及不含cRGD的SCM/DOX而言,具有更低的副作用。此外,缓释型cRGD-SCM/DOX提高循环时间,提高肿瘤对药物的累积进而提高抑制效果。
3)ALOS4-CPT。ALOS-4是新发短链(9个氨基酸)非RGD二硫键连接环肽[H-cycl(Cys-Ser-Ser-Ala-Gly-Ser-Leu-Phe-Cys)-OH],它能够结合整合素αvβ3[35]。对接分析发现,ALOS-4在整合素αvβ3上的潜在位点并非在RGD结合位点[36]。此外,Redko等将ALOS-4与拓扑异构酶I抑制剂喜树碱(ALOS4-CPT)联用后提高了CPT对人转移性黑色素瘤细胞的毒性,并且显著地降低了对正常细胞的毒性[36]。此外,将ALOS-4与CPT结合后提高了CPT在生理pH值下的稳定性[36]。因此,ALOS-4是一种特异性非RGD环肽,能够将其作为药物运输载体,帮助提高现有的恶性黑色素瘤治疗药效率并降低毒性。
4)c(AmpRGD)-sunitinib二聚结合物。Sartori等将抗整合素αvβ3拟肽(c(AmpRGD))与临床证明的抗血管生成激酶抑制剂sunitinib合成出3种新型的二聚合物,并进行了进一步研究[37]。研究结果所示,3种的双结合物的结合靶点仍为αvβ3并且激酶抑制活性几乎保持不变。在体外实验中,3个化合物均展现出良好的抗血管形成的活性。此外,二聚RGD结合物3在体外实验中对血管形成抑制效果突出。
5)RIP。Roy 等将Saporin突变体(157位上Cys替代了Ala),整合素αvβ3/αvβ5小分子抑制剂(SMI)以及一个强效细胞毒素auristatin F (AF)连接在一起获得了核糖体失活蛋白(RIP)[38]。经试验证明,这个结合物能够靶向抑制表达整合素肿瘤细胞的增殖,非常高效并且选择性高[38]。
6)cRGD-Lipo-PEG/Apatinib。阿帕替尼(Apatinib)是一种口服酪氨酸激酶抑制剂。它能够靶向结合在表皮生长因子受体2,是多种肿瘤潜在的治疗药。Song等用精氨酸-谷氨酸-天冬氨酸环肽(cRGD)以及聚乙二醇(PEG)构建了一个经修饰的脂质体(cRGD-Lipo-PEG),将其作为靶向运输系统来将apatinib运输到人结肠癌细胞株HCT116[39]。研究结果所示,相较于用未结合cRGD的apatinib,结合cRGD的cRGD-Lipo-PEG A/patinib具有更好靶向结合肿瘤的能力、更好的肿瘤抑制活性以及更少的毒性。
3.3 直接抗肿瘤药
对直接抗肿瘤药的具体描述见表3。
1)Cilengitide。Cilengitide是一个含RGD的整合素αvβ3环肽抑制剂,其由RGD以及一个Phe和Val组成,而Phe和Val之间的肽键经过N甲基化修饰,其结构为c(RGDf(NMe)V)[40]。Cilengitide临床前研究显示,能够抑制新生血管形成并且诱导肿瘤细胞凋亡[41]。而最近研究进展,主要集中在clingitide与其他药物联用上。Haddad等联合cilengtide以及紫杉醇对晚期肿瘤病人的效果进行研究[42]。结果显示,cilengitide与紫杉醇联用有很好的耐受性,并且观察到了抗肿瘤活性。此外,Wichmann等将cilengitide与cetuximab联用,来研究对头颈鳞状细胞癌的治疗情况[41]。研究结果所示,虽然两种药物联用的效果高于只用一种药物的情形,但是两种药物之间并没有产生极大的协同作用。
2)含β内酰胺的缩酯环肽。Zabala-Uncilla等将cilengitide上的Phe-(Me)Val二肽换成β内酰胺环后,新产物具有比原先环肽更高的抑制效果[43]。此外,将新产物的β内酰胺-NH-Asp接头替换成β内酰胺-O-Asp酯接头后,二次获得的缩酯环肽具有更高的活性[43]。
3)NDAT。Tetraiodothyroacetic(tetrac)是一种甲状腺素衍生物,它能够阻断左旋甲状腺素(T4)在αvβ3的作用,并且具有抗癌以及抗血管生成活性[44]。Sudha等将tetrac通过一个接头共价链接到纳米粒子上后,获得了纳米tetrac(Nanotetrac,NDAT)。这种纳米粒子能够增加tetrac的效力并且增强了抗癌活性[44]。实验研究表明[44],在人多形性胶质母细胞移植瘤研究中,NDAT给药10 d后(1 mg/kg),免疫缺损小鼠的移植瘤重量下降了50%。此外,经过tetrac治疗10 d后,肿瘤内血管分布下降了95%,并且80%的肿瘤细胞在血供应阻断后坏死。
4)YSNSG肽。YSNSG肽是一种靶向结合整合素αvβ3的合成肽,它来源于肿瘤抑素并具有良好的抗黑色素瘤效果[45]。Slimano等运用药代动力学模型以及蒙特卡洛模拟,确定了YSNSG肽在中枢神经系统以及皮下组织中的药代动力学参数并预测活性剂量[46]。结果显示,YSNSG在皮下能够很好地分布。此外,YSNSG制剂及在肿瘤内分布等进一步的研究正在进行。

表3 直接抗肿瘤药
4 讨论与结论
整合素αvβ3参与肿瘤的生长以及转移[1]。由于αvβ3结构庞大并且激活复杂,因此研究αvβ3高效安全的靶向药物,尤其是抑制剂有一定的难度。虽然在整合素αvβ3结构、激活以及肿瘤靶向药物研究方面有很大的进展,但在今后的研究中仍存在一定问题亟待研究与解决。
第一,3个重要金属离子位点中不同金属所产生的具体影响仍未得到确切详细的解释。整合素αvβ3结合口袋中重要金属离子位点对配体结合以及αvβ3激活非常关键,这些位点可以结合Ca2+、Mg2+以及Mn2+。但是,同一种金属离子在不同位点中所产生的作用以及同一位点中不同离子所产生的影响仍需要进一步研究。
第二,LIMBS中离子与保守芳香族残基之间的离子-π键发挥作用的机制,以及对配体结合的影响仍不清楚。
第三,安全有效的整合素αvβ3抑制剂的研究仍是首要问题。在设计新型抑制剂方面,可以将现有的金属离子以及离子-π键等因素纳入考虑范围,辅助抑制剂的设计。
本文较为全面地总结了整合素αvβ3结构特点、激活过程及其肿瘤相关靶向药物研究进展。此外,还对整合素αvβ3靶向药物进一步研究方向做了一定的探讨。本文从以上几个方面对整合素αvβ3进行了综述,意在为以后针对整合素αvβ3的研究以及靶向药物开发打下一定理论基础。

