HBP在儿童血流细菌感染性疾病诊断及鉴别中的应用价值研究
陈芬 洪开听 陈凤凤 潘辉 陈萍
有报道表明,全世界每年大约有160万新生儿死于各种感染[1],滞后的微生物学培养结果使得临床早期诊断尤为困难[2]。由于革兰阳性菌和阴性菌的致病机制不同,两者对抗菌药物的敏感性截然不同,因此寻找早期并能有效地鉴别病原菌种类的感染指标,对儿童感染疾病的早期诊断及抗菌药物治疗有重大意义。本资料通过检测本院儿科细菌感染患者的肝素结合蛋白(HBP)和降钙素原(PCT)水平,探讨二者在儿童细菌感染性疾病诊断以及革兰阳性菌和革兰阴性菌感染鉴别诊断中的应用价值。
1 材料与方法
1.1 一般资料 选取2015年3月至2016年12月本院儿科收治的0~14岁有明显感染症状或已确诊感染性疾病的儿童,排除未进行病原学检测且入院前接受抗生素、抗病毒等治疗以及患恶性肿瘤、自身免疫性疾病、近期使用了免疫抑制剂等的儿童120例,其中男56例,女64例,平均年龄(1.22±1.97)岁。按血培养结果分为革兰阳性菌组(50例)、革兰阴性菌组(40例)和非细菌感染组(30例,肺炎支原体阳性13例,EB病毒阳性17例),并将入托入园健康体检儿童30例设为正常对照组。本研究经过医院医学伦理委员会审核同意,向符合条件的研究对象(患儿家属)介绍参加本课题的目的、意义和流程,并签署知情同意书。
1.2 方法 (1)收集感染儿童入院时的相关资料、血培养检查结果,并采集患儿晨起8点空腹状态下的外周静脉血,经检验流水线送达生化室及时分离血清和血浆(柠檬酸钠抗凝),保存至-20℃冰箱。对照组健康小儿抽取血浆及血清。(2)儿科病房采集的血培养瓶送微生物室检测,血培养使用法国梅里埃公司的BacT/Alert 3D型血培养仪培养,阳性标本接种于培养基(郑州安图公司提供)培养后,用美国BD公司Phoenix-TM100全自动细菌鉴定仪及配套的鉴定板,对菌株进行鉴定和药敏试验。(3)采用酶联免疫吸附法检测血浆中HBP水平。HBP检测试剂盒(英国Axis-Shield Diagnostics Ltd原装进口)由杭州中翰盛泰医疗器械有限公司提供,严格按厂家说明书操作。(4)采用Inchroma免疫荧光干式定量法检测血清中PCT水平。PCT检测仪器和试剂盒为韩同Bodi Tech Med公司生产的i-CHROMA TM Reader免疫荧光分析仪及其配套试剂。
1.3 统计学方法 采用SPSS22.0统计软件。计量资料以M(P25-P75)表示,多组比较用Kruskal-Walli H检验,组间两两比较用Mann-Whitney U检验,p<0.05为差异有统计学意义。绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC)评价各指标的诊断价值,Youden指数为最大,取cutoff值,评估儿童革兰阳性菌和阴性菌感染疾病中HBP、PCT的诊断效能。
2 结果
2.1 四组HBP、PCT水平比较以及革兰阳性菌组和革兰阴性菌组的菌种分布 革兰阳性菌组HBP、PCT浓度表达水平分别为 17.90ng/ml(9.90~28.70ng/ml)、0.49ng/ml(0.34~0.61ng/ml)。革兰阴性菌组 HBP、PCT浓度表达水平分别为 83.95ng/ml(10.63~182.55ng/ml)、0.67ng/ml(0.35~1.16ng/ml)。由表 1得出,革兰阴性菌组HBP表达水平明显高于其他三组,革兰阳性菌组高于非细菌组和正常对照组。四组间HBP和PCT的H值分别为43.461、32.502,所以四组间HBP和PCT差异有统计学意义(p<0.05)。革兰阳性菌组的细菌分布构成为:金黄色葡萄球菌16例(32%)、表皮葡萄球菌12例(24%)、腐生葡萄球菌4例(8%)、屎肠球菌4例(8%)、无乳链球菌2例(4%)、马胃葡萄球菌2例(4%)、西宫菌皮肤球菌2例(4%)、巴氏葡萄球菌2例(4%)、溶血葡萄球菌2例(4%)、沃氏葡萄球菌2例(4%)、头状葡萄球菌2例(4%)。革兰阴性菌组的细菌分布构成为:大肠埃希菌12例(30%)、肺炎克雷伯菌8例(20%)、鲍曼不动杆菌8例(20%)、粘质沙雷菌2例(5%)、食神鞘氨醇杆菌4例(10%)、嗜麦芽寡养单胞菌2例(5%)、鲁氏不动杆菌2例(5%)、少动鞘氨醇单胞菌2例(5%)。
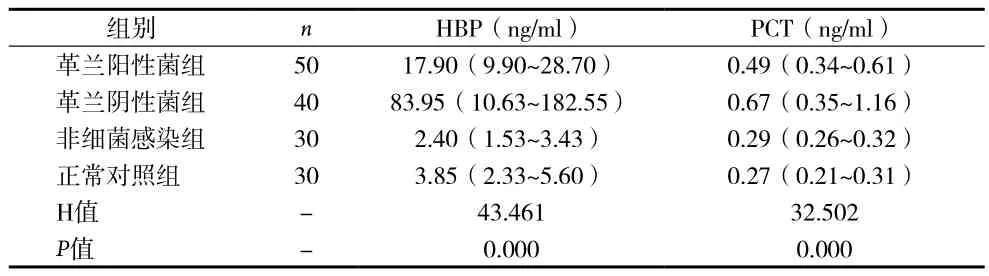
表1 四组HBP、PCT检测结果比较[M(P25-P75)]
2.2 HBP、PCT在儿童革兰阳性菌和阴性菌感染早期诊断中的应用价值 HBP诊断革兰阳性菌感染的AUC、阈值(cutoff值)、敏感度、特异度、阳性似然值和阴性似然值分别为0.929、0.460、50.0%、96.0%、12.500和0.521。PCT诊断革兰阳性菌感染的AUC、cutoff值、敏感度、特异度、阳性似然值和阴性似然值分别为0.860、0.390、55.0%、84.0%、3.438和0.536。HBP诊断革兰阴性菌感染的AUC、cutoff值、敏感度、特异度、阳性似然值和阴性似然值分别为0.956、0.817、95.0%、86.7%、7.143和0.058。PCT诊断革兰阴性菌感染的AUC、cutoff值、敏感度、特异度、阳性似然值和阴性似然值分别为0.913、0.683、75.0%、93.3%、11.194和0.268。ROC曲线图(见图1、2)表明HBP比PCT具有更高的敏感度和特异性。HBP、PCT用于革兰阴性菌感染均有较好的临床诊断价值,尤其HBP具有较高的诊断效能。

图1 HBP、PCT诊断革兰阳性菌感染的ROC曲线图

图2 HBP、PCT诊断革兰阴性菌感染的ROC曲线图
2.3 HBP在儿童细菌感染性疾病中革兰阳性菌和阴性菌鉴别诊断的应用价值 HBP鉴别诊断革兰阳性菌和阴性菌感染的AUC、阈值(cutoff值)、敏感度、特异度、阳性似然值和阴性似然值分别为0.687、0.460、50.0%、96.0%、12.500和0.521。PCT鉴别诊断革兰阳性菌和阴性菌感染的AUC、阈值(cutoff值)、敏感度、特异度、阳性似然值和阴性似然值分别为0.620、0.390、55.0%、84.0%、3.438和0.536。HBP对儿童细菌感染性疾病中革兰阳性菌和阴性菌的鉴别诊断效能相对较弱。通过Logistics回归,HBP和PCT联合鉴别诊断儿童革兰阳性菌和阴性菌的AUC为0.694,略高于单独HBP及PCT。
3 讨论
PCT作为炎症标志物的表达与细菌感染有显著相关性,可用来鉴别细菌感染及非细菌感染,并诊断和评估脓毒血症的严重程度,指导临床抗菌药物的应用[3-4],但其只在机体感染并产生全身反应时才会显著增高,局部感染和慢性感染时其血清水平正常或轻微偏高[5]。已有研究表明,PCT能反映新生儿感染性疾病的严重程度,动态监测其浓度对新生儿脓毒血症的早期诊断、疗效评价和预后判断均具有非常重要的应用价值[6-7]。HBP存在于人类中性粒细胞内的分泌颗粒和嗜天青颗粒中,1984年被Shafer等首次分离发现,也称为azuroeidin或者CAP37。近年来研究表明,HBP可以作为感染性疾病,尤其是严重的细菌感染的一种早期诊断标志[8-9]。与其它传统炎症指标相比,HBP除了灵敏度高、特异性强、阳/阴性检出率高等特点,还具有出现早,在急性细菌感染时浓度极度升高,在病毒感染和非特异性炎症时却保持较低的水平等特点。本研究结果中革兰阴性菌组HBP表达水平最高,革兰阳性菌组仅次于革兰阴性组,非细菌组最低,与上述吻合。
目前关于HBP在儿童人群中的研究还十分有限,尤其是细菌感染中的革兰阳性菌和阴性菌。Adam Linder等[10]研究发现HBP是一种潜在的重症细菌感染的诊断标志物并能判断治疗预后。Kjölvmark等[11]报道了儿童尿液中HBP水平能帮助诊断儿童尿道感染,相对于传统的检测指标更加准确。目前有关儿童感染性疾病的HBP研究,仅评估了用药前的水平,尚缺少对已接受治疗儿童的评估;对不同病原体的感染,如革兰阳性菌、革兰阴性菌、真菌、病毒等,患者血浆HBP水平是否存在差别,接受治疗后变化水平是否一致,以及该变化是否先于临床症状和体征的改变均有待研究。由于临床上革兰阳性菌、阴性菌感染的致病机制不同,两者对抗菌药物的敏感性截然不同,并且细菌培养周期较长,因此能早期发现一种判断儿童或者新生儿属于何种菌感染并易于检测的指标,对于缩短患者治疗周期和预后康复均有较大的临床应用价值。本研究表明,HBP用于诊断儿童革兰阴性菌感染具有较高的敏感度和特异度,用于诊断儿童革兰阳性菌感染的敏感度和特异度次之,均明显高于PCT。HBP鉴别革兰阳性菌感染和革兰阴性菌感染的AUC较小,表明HBP对儿童革兰阳性菌和阴性菌感染的鉴别诊断效能相对较弱。HBP、PCT联合鉴别诊断革兰阳性菌和阴性菌的AUC略高于单独HBP及PCT。
本研究受新生儿童样本例数的限制,非大样本多中心研究,同时存在抽样误差,虽然本研究纳入的非细菌感染组有支原体和病毒感染者,但是并无真菌组和衣原体或其他非典型病原体的患者,这也可能忽略了某些非细菌性感染因素引起的HBP升高。同时,上述各种变化的机制还需要进一步的基础研究证实,在应用临床前,还需要大量多中心标准化的临床试验,来验证其对感染性疾病的诊断效率。

