不同腐烂病发病程度核桃根区土壤微生物多样性分析
顾美英,徐万里,张志东,唐光木,唐琦勇,雇玉忠,宋素琴,古丽尼沙·沙依木,杨 波,冯 雷
(1.新疆农业科学院微生物应用研究所,乌鲁木齐 830091;2.新疆农业科学院土壤肥料与农业节水研究所,乌鲁木齐 830091;3.乌鲁木齐市永丰天农农业科技公司,乌鲁木齐 830000;4.新疆农业科学院园艺作物研究所,乌鲁木齐 830091)
0 引 言
【研究意义】核桃(JuglansregiaL.)是我国重要的经济树种,新疆凭借得天独厚的水土光热资源和丰富的特色品种资源,已成为核桃的主产区之一。目前,新疆核桃种植面积约为2.8 × 105hm2(420万亩),居全国第3位,产量近2.4 × 105t[1]。近年来,新疆核桃产业向基地化、规模化、产业化方向发展,但由于栽培技术落后和水肥管理粗放,多年种植的核桃园出现盛果期缩短、树体早衰、抗逆性差、病虫害加重,市场竞争力降低等生长障碍问题[2-3]。在核桃病害中,发病比较严重的核桃腐烂病是典型的潜伏浸染的真菌病害,该病已成为影响核桃生长发育和产量的主要原因[4-5]。目前生产中仍以化学防治为主,但化学杀菌剂存在易污染环境,对人畜不安全,农药残留等问题[6]。对果树根区微生物生态研究不仅对土壤微生态理论研究有重要意义,而且通过调控果树根区微生物多样性,可以实现果树持续健康生长。【前人研究进展】土壤微生物多样性与植物健康状况之间的关系已成为近年来研究的热点,土壤微生物生态是生态系统的重要组成部分,其健康与否,将直接关系到植株的生长发育以及品质,影响社会经济的可持续发展[7-9]。国内外的一些研究表明,植物病害与土壤微生物生态失衡有一定的关系[10-13],果树土壤微生物群落结构及其组成变化与果树抗逆性和病害的发生密切相关。已有研究表明,土壤可培养细菌、放线菌的减少及优势细菌分布不均,以及酶活性的降低可能是影响樱桃树"黑疙瘩"病发生的原因之一[14]。与健康的晚棱脐橙相比,在感染黄龙病前期其土壤生物学性质的变化不大;在感染的中后期,由于根系在营养缺乏和病害的双重影响下逐渐坏死,根系生态系统遭到破坏,晚棱脐橙土壤的微生物数量、土壤酶活性及土壤微生物功能多样性均明显下降[15]。但也有研究表明,土壤中微生物多样性和微生物总体数目与果树根癌病的发生没有显著相关性,但土壤中存在的个别菌种对病害发生有显著影响[16]。吴斌等[17]研究发现小麦黄花叶病毒病发病严重地块的土壤微生物总量均高于轻病地块,真菌数量和种类的增加尤为显著,其次为细菌,放线菌基本无变化。【本研究切入点】土壤微生物和病原体宿主特异性在植物健康中发挥重要作用[18],果园土壤微生物多样性下降导致果树病害的加重已成为威胁果园生态健康的一个重要问题[19-20]。研究土壤微生物数量和功能多样性与核桃腐烂病之间的关系。【拟解决的关键问题】以不同腐烂病发病程度的核桃树为研究对象,以健康植株为对照,采用可培养微生物计数和Biolog微平板的方法,探索核桃土壤微生物群落多样性与腐烂病发生的关系,为核桃腐烂病微生物调控技术的研究奠定良好的理论基础。
1 材料与方法
1.1 材 料
试验所需土壤样品,采集于新疆阿克苏地区温宿县核桃林场三队12年生核桃园。该地位于塔里木盆地北缘,全年近230 d无霜期,属典型的温带大陆性气候,昼夜温差悬殊。年平均气温10.1℃,极端最高气温40.9℃,极端最低气温-27.4℃;年均日照2 747.7 h,年均降水量65.4 mm;年均无霜期185 d。采集土样前对核桃园进行腐烂病危害程度的调查,根据腐烂病的发病情况,按健康(J)、轻度发病(Q)、中度发病(Z)、重度发病(B)植株根区土分为4组,每组各采集7棵树的根区土样。健康植株为无病疤或1~2年生小枝有少量病疤;轻度病害为2~4年生侧枝有较轻的病疤;中度危害为主枝上有1个病疤,宽度占枝干周长的 50%以上;重度病害为主干或主枝上有3个病疤,宽度均占枝干周长的50% 以上[21]。每株树以主干为中心50 cm左右半径的范围,分别从东、南、西、北4个方位取土,除去表层土后取0~30 cm的土样,每样品采用四分法混匀后装入保鲜袋中带回实验室,置于4℃冰箱保存,用于微生物分析。
1.2 方 法
1.2.1 土壤可培养微生物数量测定
可培养微生物数量采用稀释平板涂抹培养计数法分析[22]。细菌采用牛肉膏蛋白胨琼脂培养基,放线菌采用改良的高氏一号培养基(每300 mL培养基中加3%重铬酸钾1 mL),真菌采用PDA 培养基(每100 mL培养基加1%链霉素溶液0.3 mL)。
1.2.2 土壤微生物群落碳源代谢利用测定
采用Biolog ECO微平板法进行[22]。称取10 g鲜土加入100 mL无菌水中,摇匀,静止片刻,然后将土壤样品稀释至10-3。取150 μL菌悬液接种到生态板的每一个孔中,25℃恒温培养,每隔24 h分别在590 nm波长下读数,连续培养7 d。取120 h的平均光密度值进行多样性分析。
1.3 数据处理
微平板孔中溶液吸光值平均颜色变化率(average well color development, AWCD)用于描述土壤微生物代谢活性,计算公式如下:AWCD=∑(Ci﹣Ri)/n。式中:Ci为每个有培养基孔的吸光值;Ri为对照孔的吸光值;n为培养基孔数,Biolog Eco板n值为31。采用Simpson、Shannon和McIntosh 3个指数来表征土壤微生物群落功能多样性。其中Simpson指数(D)用于评估某些最常见种的优势度,Shannon指数(H)用于评估物种的丰富度,McIntosh指数(U)用于评估群落物种均匀度。
计算公式如下:

Shannon指数(H):H=﹣∑pi(pi).
式中:pi为第i孔的相对吸光值与所有整个微平板的相对吸光值总和的比值(Ci﹣Ri)/∑(Ci﹣Ri);ni为第i孔的相对吸光值(Ci﹣Ri);N为相对吸光值的总和。
数据采用DPS v9.50 版软件进行方差分析、平均吸光值(AWCD)、多样性指数和主成分分析等工作。采用单因素方差分析(one-way ANOVA)、最小显著差数法(LSD)进行多重比较差异显著性检验(P<0.05)。
2 结果与分析
2.1不同发病程度核桃根际土壤可培养微生物特征
研究表明,不同发病程度核桃根际土壤三大可培养微生物类群数量差异显著。与健康土壤对照相比,微生物总数轻、中度发病土壤分别升高了13.69%和10.88%,重度发病土壤则降低了33.06%。腐烂病病害由轻到重的根际土壤细菌数量呈先上升后下降趋势,轻度、中度腐烂病发病土壤数量分别是健康土壤的15.67%和12.28%,重度腐烂病发病土壤则下降了33.46%。放线菌和真菌数量健康土壤数量最多,不同发病土壤放线菌数量分别下降了47.33%、32.98%和19.27%,真菌数量分别下降了49.32%、22.68%和42.68%。图1

Ⅰ: 细菌Bacteria (107CFU/g) ; Ⅱ: 放线菌Actinomycetes(105CFU/g) ; Ⅲ: 真菌Fungi (104CFU/g) J:健康土壤 health soil,Q:轻度发病土壤 mild disease soil、Z:中度发病土壤 moderate degree soil、B:重度发病土壤 severe disease soil
图1 不同样地核桃根际土壤可培养微生物数量
Fig.1 Culturable microbial quantities in rhizosphere soil of Walnut under different soil samples
2.2不同发病程度核桃根际土壤微生物功能多样性
2.2.1平均颜色变化率
研究表明,Biolog ECO微平板培养过程中,各处理根区土壤微生物对碳源的利用程度随着培养时间延长而增加,表明微生物活性也增加。在培养初期的24 h内,AWCD值变化不明显,从24~96 h,AWCD值呈快速增长,96 h后增长速度减慢并延续到144 h,144 h后趋于稳定。168 h的AWCD值总体表现为腐烂病发病较轻和健康的核桃根区土壤中,微生物活性高于中度和重度的发病土壤。从差异变化较显著的144 h的AWCD值可以看出,不同发病程度的根区土壤间存在一定的差异。腐烂病发病较轻的核桃根区土壤中,微生物活性最高,健康土壤降低了12.03%,中、重度发病土壤分别降低了14.56%和18.42%。图2
2.2.2 多样性指数
根据AWCD值随培养时间的变化曲线,选取144 h的AWCD值计算土壤微生物群落的Simpson、Shannon和McIntosh多样性指数。结果表明,不同腐烂病发病程度的核桃根区土壤微生物群落功能多样性指数存在一定差异。从AWCD值可以看出,在健康和腐烂病发病程度较轻的土壤中均表现出较高的微生物活性,随着发病程度的加重,微生物活性显著降低。但不同发病程度的土壤微生物群落Simpson优势度指数(D)和McIntosh均匀度指数(U)差异不显著,轻度发病土壤的Shannon丰富度指数(H)高于健康和中、重度发病土壤。 表1
2.2.3 土壤微生物对不同种类碳源的利用
将Biolog-Eco板上的31种碳源分为6类,健康和发病的核桃树根区土壤微生物对这6类碳源的利用情况,研究表明,轻度发病土壤中的微生物对这6类碳源的利用均较高,说明微生物的活性最高;健康土壤中的微生物对糖类和氨基酸类碳源也有较好的利用;但中、重度发病土壤中微生物活性降低,对糖类、氨基酸类和酚酸类碳源的利用较低。核桃腐烂病的发病程度与土壤微生物对碳源的利用情况有一定的相关性,健康和轻度发病的土壤微生物对糖类和氨基酸类碳源有较强的利用能力,而腐烂病发病较重的土壤中利用糖类、氨基酸类和酚酸类碳源的微生物在减少。图3

图2 不同样地土壤微生物群落平均颜色变化率
Fig.2 Average well color development (AWCD) of soil microbial communities under different soil samples
表1 不同样地土壤微生物群落功能多样性指数
Table 1 Diversity indexes of soil microbial communities under different soil samples

Soil samplesAWCDSimpson(D)Shannon(H)McIntosh(U)J1.323±0.105b0.980±0.001a3.190±0.040b0.936±0.004aQ1.504±0.134a0.982±0.003a3.298±0.053a0.940±0.011aZ1.285±0.224b0.980±0.000a3.211±0.064ab0.939±0.005aB1.227±0.177b0.981±0.001a3.197±0.076b0.941±0.002a
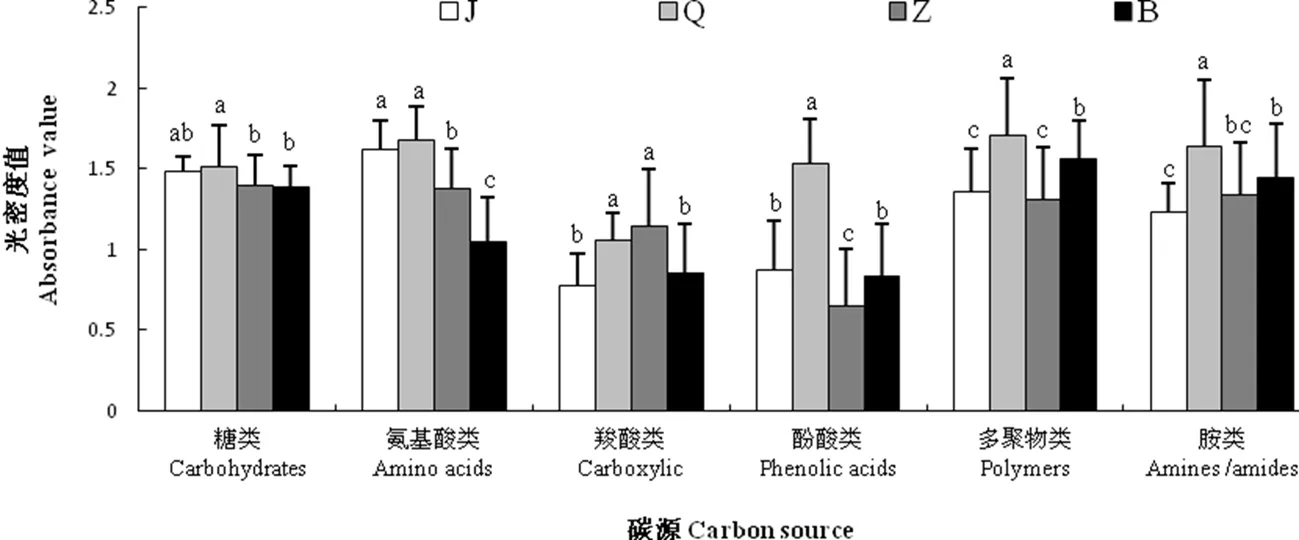
图3 不同样地土壤微生物对六类碳源的利用强度
Fig.3 Utilization intensity of soil microbial community to six types of carbon source under different soil samples
2.2.4 主成分分析
为了进一步了解腐烂病不同发病程度核桃根区土壤微生物群落功能的差异,对健康和发病的核桃树根区土壤微生物31种碳源的利用情况进行主成分分析。采用培养第144 h的数据,共提取出3个主成分,主成分1 (PC1)、主成分2 (PC2)分别解释变量方差的41.57%和32.78%。PC1和PC2的累积贡献率为74.36%,是分异的主要来源,可以解释分异的大部分信息。研究表明,不同腐烂病发病程度的土壤在PC轴上出现了明显的分化,除健康土和中度发病土均分布在第四象限外,轻度和重度发病土分别分布在第一和第二象限。从整体上看,发病程度不同的核桃根区土壤微生物群落有一定的差异。图4

图4 不同样地土壤微生物群落主成分分析
Fig.4 Principal component analysis of soil microbial communities under different soil samples
研究表明,对PC1和PC2具有较高利用率的碳源分析,对PC1和PC2的贡献率在±0.6以上的碳源能反应其中大部分信息。31种碳源中有6种碳源与PC1相关性较强,它们分别属于糖类的D、L-a-甘油,氨基酸类的L-精氨酸、L-天冬酰胺酸和L-丝氨酸,羧酸类的D-苹果酸,酚酸类的4-羟基苯甲酸。说明这6种碳源使不同样地间土壤微生物群落代谢功能多样性在PC1上差异显著,决定PC1的分异。与PC2相关性强的碳源有5种,分别属于糖类的D-纤维二糖、I-赤藻糖醇、a-D-乳糖和N-乙酰基-D-葡萄胺,多聚物类的吐温80。说明这5种碳源使不同样地间土壤微生物群落代谢功能多样性在PC2上差异显著,决定PC2的分异。表2
表2 PC1和PC2贡献率较高的部分碳源(︱r︱﹥0.6)
Table 2 The carbon source with high contribution rate for PC1 and PC2(︱r︱﹥0.6)

碳源类型Type of carbon sourcePC1PC2糖类CarbohydratesD-纤维二糖0.1630.626I-赤藻糖醇-0.4540.618a-D-乳糖-0.1050.648N-乙酰基-D-葡萄胺-0.2430.843D,L-a-甘油0.7080.28氨基酸类Amino ocidsL-精氨酸0.9380.061L-天冬酰胺酸0.790-0.201L-丝氨酸0.7580.241羧酸类 Carboxylic acidsD-苹果酸0.7110.021酚酸类 Phenolic acids4-羟基苯甲酸0.7510.445多聚物 Polymers吐温80-0.070.762
3 讨 论
土壤生态系统对于植物的生长和发育是至关重要的,土壤生物之间相互依赖、彼此制约,同时又与周围环境因子相互作用、往复调控,才能维系土壤生态系统的稳定和健康[23]。虽然核桃腐烂病病原菌主要危害核桃树枝干,并不会直接污染土壤,但核桃根区土壤养分及微生物多样性的变化是腐烂病发生的主要原因。由于核桃在生长过程中需不断从土壤中吸取养分,在管理粗放、土壤贫瘠、排水不良、肥水不足等的土壤中的营养元素相对缺乏和比例失调,导致核桃根区土壤微生物多样性降低及其群落结构发生变化,导致树势衰弱,腐烂病加重[24、25]。
土壤微生物是土壤生态系统变化的敏感指标之一,其活性和群落结构变化能反映出土壤生态系统的稳定性和健康状况[26、27]。病原菌的入侵使得植物-土壤-微生物原有的健康生态遭到破坏,导致土壤微生物多样性发生变化[28、29、30],土壤微生物群落结构变化在一定程度上也影响病害的发生[31、32、33、34]。李雪萍等[35]的研究表明,根腐病的发生会使青稞根际土壤微生物组成发生改变,细菌和放线菌数量因根腐病的发生而减少,真菌的数量则增多。吴斌等[17]的研究也表明发病严重地块的土壤微生物总量均高于轻病地块,其中发病严重地块的真菌数量和种类增加的最为显著。
研究对三大可培养微生物类群的分析表明,由于细菌数量占微生物总数的大部分,故微生物总数呈轻度发病>中度发病>健康>重度发病土壤,而放线菌和真菌数量健康土壤高于发病土壤。微生物数量与土壤养分含量关系密切,冯雷等[21]的研究表明,核桃健康土壤养分含量大于腐烂病发病土壤,这可能导致重度发病土壤微生物数量少于健康土壤。同时轻度发病植株可能产生一些应激反应来抵御病害的入侵,进而对土壤微生物也产生了一定的影响。发病较重的土壤中真菌数量并没有显著增多,由于腐烂病并非土传病害,土壤细菌、放线菌和真菌数量减少说明土壤中养分含量减少,土壤质量下降,树势可能变弱,进而导致腐烂病发病严重。土壤环境的改变诱发各种微生物的生长和繁殖,同时病原微生物的大量繁殖也可能侵入寄主后改变植株生理代谢,造成其分泌物中一些成分及含量发生变化,从而可能导致不同发病程度的土壤微生物数量及种类明显不同[17]。核桃腐烂病的发生与土壤微生物的相关性研究,还应结合高通量测序等分子生物学手段对土壤微生物的种类和数量进行深入分析。
Biolog代谢活性研究表明,健康和腐烂病发病较轻的核桃根区土壤中,微生物活性高于中、重度发病土壤。这与管冠[15]、邓晓[36、37]、付丽娜[38]等的研究结果一致。Biolog碳源利用分析表明,健康和轻度发病的土壤微生物对糖类和氨基酸类碳源有较强的利用能力,而腐烂病发病较重的土壤中利用糖类、氨基酸类和酚酸类碳源的微生物在减少。苗则彦等[39]分析认为病原菌侵入寄主后改变植株生理代谢,导致其分泌物中一些成分及含量发生变化,在促进一些微生物生长的同时又抑制了另一类群微生物,从而可能导致健康黄瓜植株与罹病黄瓜植株根际微生物数量及种类明显不同。因此,在腐烂病发病严重的土壤中增施有机肥、有益根际微生物或利用有效微生态调控措施,可增加核桃土壤养分和调节微生物多样性,进而增强树势,促进核桃树的健康生长。
4 结 论
4.1 不同腐烂病发病程度核桃根际土壤三大可培养微生物类群数量差异显著。与健康土壤对照相比,不同发病程度土壤细菌数量呈先上升后下降趋势, 轻度、中度发病土壤分别提高了15.67%和12.28%,重度发病土壤则下降了33.46%。轻度、中度和重度发病土壤放线菌数量分别下降了47.33%、32.98%和19.27%,真菌数量分别下降了49.32%、22.68%和42.68%。
4.2 Biolog碳源利用表明,健康和腐烂病发病较轻的核桃树土壤微生物多样性存在显著差异。腐烂病发病程度较重的土壤中微生物多样性低于健康和腐烂病发病程度较轻的土壤。从144 h的AWCD值可以看出,腐烂病发病较轻的核桃根区土壤中,微生物活性最高,健康土壤降低了12.03%,中、重度发病土壤分别降低了14.56%和18.42%。轻度发病土壤的Shannon丰富度指数(H)高于健康和中、重度发病土壤。研究表明,核桃腐烂病的发病程度与土壤微生物对碳源的利用情况有一定的相关性,健康和轻度发病的土壤微生物对糖类和氨基酸类碳源有较强的利用能力,而腐烂病发病较重的土壤中利用糖类、氨基酸类和酚酸类碳源的微生物在减少。主成分分析表明,发病程度不同的核桃根区土壤微生物群落有一定的差异。31种碳源中,糖类和氨基酸类碳源决定着主成分的分异。

