加工番茄田列当致病菌的筛选与鉴定
何 伟,许建军,杨 华,孙晓军
(新疆农业科学院植物保护研究所/农业部西北荒漠作物有害生物综合治理重点实验室,乌鲁木齐 830091)
0 引 言
【研究意义】列当是一类寄生在植物根部寄生生活的列当科(Orobanchaceae) 列当属(OrobancheL.) 植物的总称。列当寄主范围非常广泛,可寄生在豆科、十字花科、葫芦科、亚麻科、茄科、菊 科、禾本科和大麻科等植物根上[1]。近年来新疆加工番茄受到列当严重危害,造成大量减产,遭受列当危害加工番茄减产30%~80%,严重时甚至绝产。列当已成为制约新疆加工番茄生产主要因素之一。筛选适宜本地自然环境的强致病性菌株可为列当生防菌提供菌株资源。研究将从新疆加工番茄田间自然发病列当上分离获得致病性强的菌株,为新疆加工番茄列当生防菌提供菌种资源。【前人研究进展】利用致病菌防除列当多为镰刀菌。如Thomas 等[2]报道的尖孢镰刀菌[F.oxysporumf. sp.orthoceras(Appel & Wollenw.) Bilay]和Nemat Alla 等[3]报道尖孢镰刀菌(F.oxysporumSchl.) Foxy I和Foxy II的孢子悬浮液分别对向日葵列当、锯齿列当和分枝列当具有一定防治效果。而其他镰刀菌包括弯角镰刀菌(F.camptocerasWollenw.&Reink.)、厚垣镰刀菌(F.chlamydosporumWollenw. & Reinking)[4]和轮状镰刀菌(F.verticillioidesNirenb.)[5]等也均具有防除列当的潜能。除镰刀菌外,荧光假单胞菌(PseudomonasfluorescensFlügge)[6]、UlocladiumbotrytissPreuss.[7]和洋葱曲霉[8]也具有类似的防除作用。国内研究者也从发病列当植株上分离获得多种镰刀菌菌株,如王之樾等[9]从新疆瓜列当获得一个镰刀菌并试制成“生防剂F798;孔令晓等[10]从向日葵列当上分离获得的镰刀菌L2菌株;丁丽丽等[11]从新疆瓜列当上分离的菌株中筛选出4个对列当高致病性菌株;柴阿丽等[12]从新疆加工番茄田采集列当病样分离获得锐顶镰刀菌(Fusariumacuminatum)。【本研究切入点】采用生防菌防治列当是当前研究热点,研究筛选对加工番茄列当具有强致病力的菌株。【拟解决的关键问题】研究采集新疆加工番茄田间自然发病列当,组织分离获得菌株,菌株发酵液和粗毒素提取液抑制列当种子萌芽及活体接种,筛选致病性强的菌株,采用形态学特征并辅以分子生物学方法鉴定。为加工番茄列当生防菌的开发应用提供菌株资源。
1 材料与方法
1.1 材 料
样本:2016年加工番茄坐果期,在呼图壁县、昌吉市、吉木萨尔县、和硕县、焉耆县和博湖县等加工番茄田间采集自然发病列当植株。
马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL,pH 6.8。
马铃薯葡萄糖培养基(PDB):去皮马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,pH 6.8。
1.2 方 法
1.2.1 病原菌分离与纯化
使用消毒剪刀将列当病健交界处剪成3~5 mm的小块,将小块在70%酒精中消毒1 min,转移至3%次氯酸钠溶液中消毒5 min,转至PDA平板上。培养2~3 d后,挑取菌落边缘菌丝转移至新的PDA平板上。菌落长成后挑单孢进行纯化,并试管保存菌株。
1.2.2 菌株发酵液和粗毒素提取液对列当种子萌芽抑制作用测定
(1)列当种子预处理
将列当种子在70%酒精消毒1.5 min后转移至1%次氯酸钠消毒12 min,晾干使用。
(2)菌株发酵液对列当种子萌芽抑制效果测定
将列当致病菌接入PDA培养培养基中,7 d后打孔4~5个转入100 mL PDB液体培养基中,摇床培养7 d,26℃,160 r/min。将一张whatman滤纸(GA/A)置于培养皿中,用无菌水浸湿,将20粒列当种子置于滤纸上,每处理4次重复。在每个培养皿中依次加入5 mL GR24和5 mL发酵液,对照处理是5 mL GR24和5 mL灭菌水。在室温25℃,遮光条件下培养7~10 d后,体式显微镜下观察列当种子萌芽数量并记录。
(3)菌株粗毒素的提取
将列当致病菌转到PDA培养基中,待菌落长满整个培养基,采用直径0.6 cm打孔器打孔。用灼烧过的接种针挑取4~5片接种于装有250 mL PDB液体培养基的三角瓶内,每个菌株接种两瓶。置于恒温摇床培养7 d(26℃,160 r/min)后取培养液15 mL离心10 min,转速为10 000 r/min,取上清液,高压灭菌后得到粗毒素提取液。
(4)菌株粗毒素提取液对列当种子萌芽抑制效果测定
将20粒列当种子中置于Whatman玻璃滤纸(GA/A),加入5 mL GR24和5 mL菌株粗毒素提取液,每个菌株3次重复,空白对照为5 mL GR24和5 mL灭菌水。在室温25℃,遮光条件下培养7~10 d后,体式显微镜下观察列当种子萌芽数量并记录。将抑制列当种子萌芽抑制效果高的菌株粗毒素提取液稀释500和1 000倍进行实验,方法同上。
1.2.3 盆栽试验
(1)菌株致病性测定
盆栽试验采取以下三种方式进行接种,接种菌株孢子悬浮液浓度在106~107个孢子/mL(每200 mL中滴两滴Tween20)。
针刺法:每株列当分三段,茎基部、茎中部、茎顶端,用无菌牙签沾取菌液(无菌水稀释过的),针刺列当植株,伤口用湿润的脱脂棉覆盖保湿24 h后摘下。
涂抹法:每株列当分三段,茎基部、茎中部、茎顶端,用无菌牙签挑取菌丝,涂抹列当植株,涂抹的地方用湿润的脱脂棉覆盖保湿24 h后摘下。
喷雾法:用无菌水稀释过的菌液倒入喷壶中,喷洒刚出土的列当,最后整株列当用地膜覆盖保湿24 h后摘下。空白对照为清水处理。接种3 d后观察列当病情并记录。
(2)菌株孢子悬浮液对列当出土抑制作用测定
选择对列当植株致病性较强的菌株进行孢子悬浮液对盆栽列当防治效果实验,将土壤高温消毒后装盆,每盆装约3.2 kg,将50 mg列当种子与土混匀后撒播与番茄苗根部。将30 d苗龄的番茄苗移入盆中,每盆一株苗,每盆浇灌200 mL菌悬液,每菌株4次重复,空白对照浇灌清水。孢子悬浮液浓度在106~107个孢子/mL。15 d后调查列当出土数量并计算抑制效果。
1.2.4 菌株鉴定
(1)形态学鉴定
将从列当致病植株上分离得到的菌株接种于PSA培养基上,培养7 d后观察菌落形态和产生色素情况。在PSA上25℃培养4 d后测量菌落生长直径。大型和小型分生孢子形态、厚垣孢子形态以及分生孢子梗形态培养11 d后观察大型孢子分生孢子大小、形态、分隔数以及小型分生孢子的大小、形态,并观察厚垣孢子的形态和大小以及分生孢子梗形态。
(2)分子生物学鉴定
采用真菌DNA试剂盒提取菌株DNA基因组,引物为真菌通用引物ITS1:TCCGTAGGTGAACCTGCGG,ITS4:TCCTCCGCTTATTGATATGC,真菌DNA提取试剂盒与引物合成均为北京鼎国昌盛生物科技有限公司。反应体系为50 μL,其中2XMix 25 μL、ITS1 (10 μM) 1 μL、ITS4 (10 μM)1 μL、DNA模板2 μL,ddH2O加至50 μL。反应条件,94℃预变性5 min,94℃变性30 s,54℃退火30 s,72℃延伸50 s,72℃延伸10 min,35cycles。PCR产物回收,2.0%琼脂糖凝胶电泳,切取目的片断,加入回收试剂溶液A 300 μL/0.1 g,60℃水浴至胶完全溶化,加入50 μL回收试剂溶液B,混匀 ,将溶液置于离心柱中,静置5 min,12 000 r/m,1 min,弃液体,加入500 μL 80%乙醇,12 000 r/m,离心1 min,弃液体,重复一次,12 000 r/m,离心5 min,甩干余液,弃液体,晾干5~8 min,将离心柱置于新的离心管中,加入30 μL灭菌双蒸水,静置10 min,13 000 r/m,离心3 min,管底即为纯化产物。纯化产物在北京鼎国昌盛生物科技有限公司进行测序。以NCBI数据库中的Blast程序比对分析,采用MEGA6.0软件中邻接法进行聚类分析鉴定。
2 结果与分析
2.1 列当致病菌的分离与纯化
加工番茄田间采集自然发病寄生性杂草列当106株典型病样,带回实验室采用常规组织分离,共计获得60个菌株。
2.2 分离菌株发酵液对列当种子萌发抑制作用
研究表明,菌株发酵液对列当种子萌芽抑制效果最好的菌株为2016-22和2016-51,抑制效果均为100%,其次是菌株2016-26、2016-44、2017-6,抑制效果分别为92.86%、90.48%、92.86%。表1
表1 不同菌株发酵液对列当种子萌芽抑制效果比较
Table 1 Comparison of inhibition effect of different strains fermented liquid to broomrape seed germination
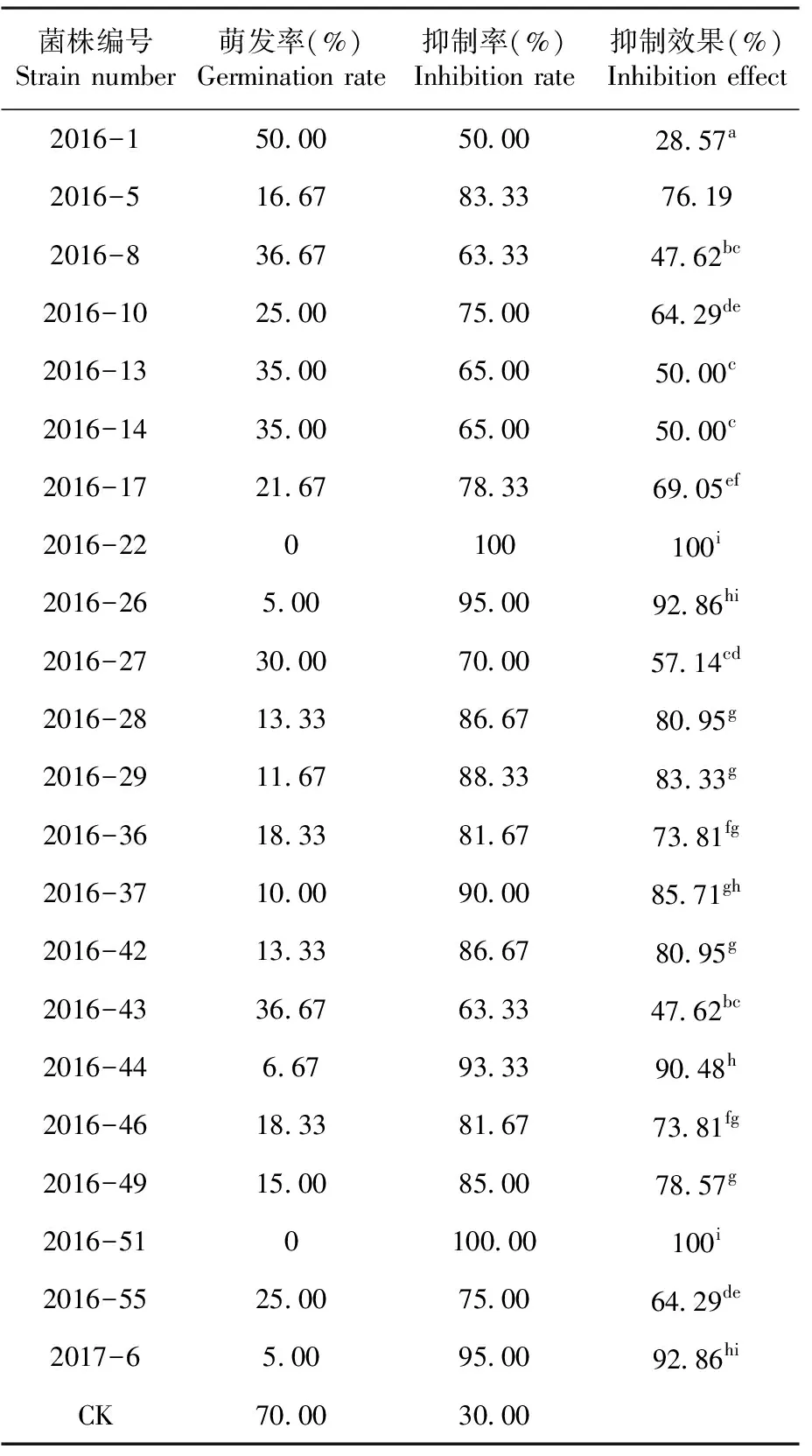
菌株编号Strain number萌发率(%)Germination rate抑制率(%)Inhibition rate抑制效果(%)Inhibition effect2016-150.0050.0028.57a2016-516.6783.3376.192016-836.6763.3347.62bc2016-1025.0075.0064.29de2016-1335.0065.0050.00c2016-1435.0065.0050.00c2016-1721.6778.3369.05ef2016-220100100i2016-265.0095.0092.86hi2016-2730.0070.0057.14cd2016-2813.3386.6780.95g2016-2911.6788.3383.33g2016-3618.3381.6773.81fg2016-3710.0090.0085.71gh2016-4213.3386.6780.95g2016-4336.6763.3347.62bc2016-446.6793.3390.48h2016-4618.3381.6773.81fg2016-4915.0085.0078.57g2016-510100.00100i2016-5525.0075.0064.29de2017-65.0095.0092.86hiCK70.0030.00
注:不同小写字母代表差异显著,P<0.05
Note:The different small letters represent significant difference at 5% level
2.3 菌株粗毒素提取液对列当种子萌芽抑制作用
研究表明,2016-14、2016-27、2016-28、2016-36、2016-37、2016-42、2016-46等8个菌株粗毒素提取液对列当种子的萌发抑制效果达到100%。2016-17、2016-22、2016-44、2016-51、2016-55、2017-6等6个菌株粗毒素提取液对列当种子的萌芽抑制效果均在90%以上,分别为95.24%、96.83%、96.83%、95.24%、92.06%、92.06%。在500倍粗毒素提取液浓度下,2016-14、2016-27、2016-42、2016-46等4个菌株粗毒素提取液对列当的萌发抑制效果均在40%以上,分别为40.48%、45.24%、59.52%、42.86%。在1 000倍粗毒素浓度下,2016-27、2016-42、2016-46、2016-51等4个菌株粗毒素提取液对列当的萌发抑制效果分别为2.38%、7.14%、4.76%、2.38%,其余菌株对列当种子无抑制效果。表2
表2 不同菌株粗毒素提取液对列当种子萌芽抑制效果比较
Table 2 Comparison inhibition effect of different strains of crude toxin extract to broomrape seed germination
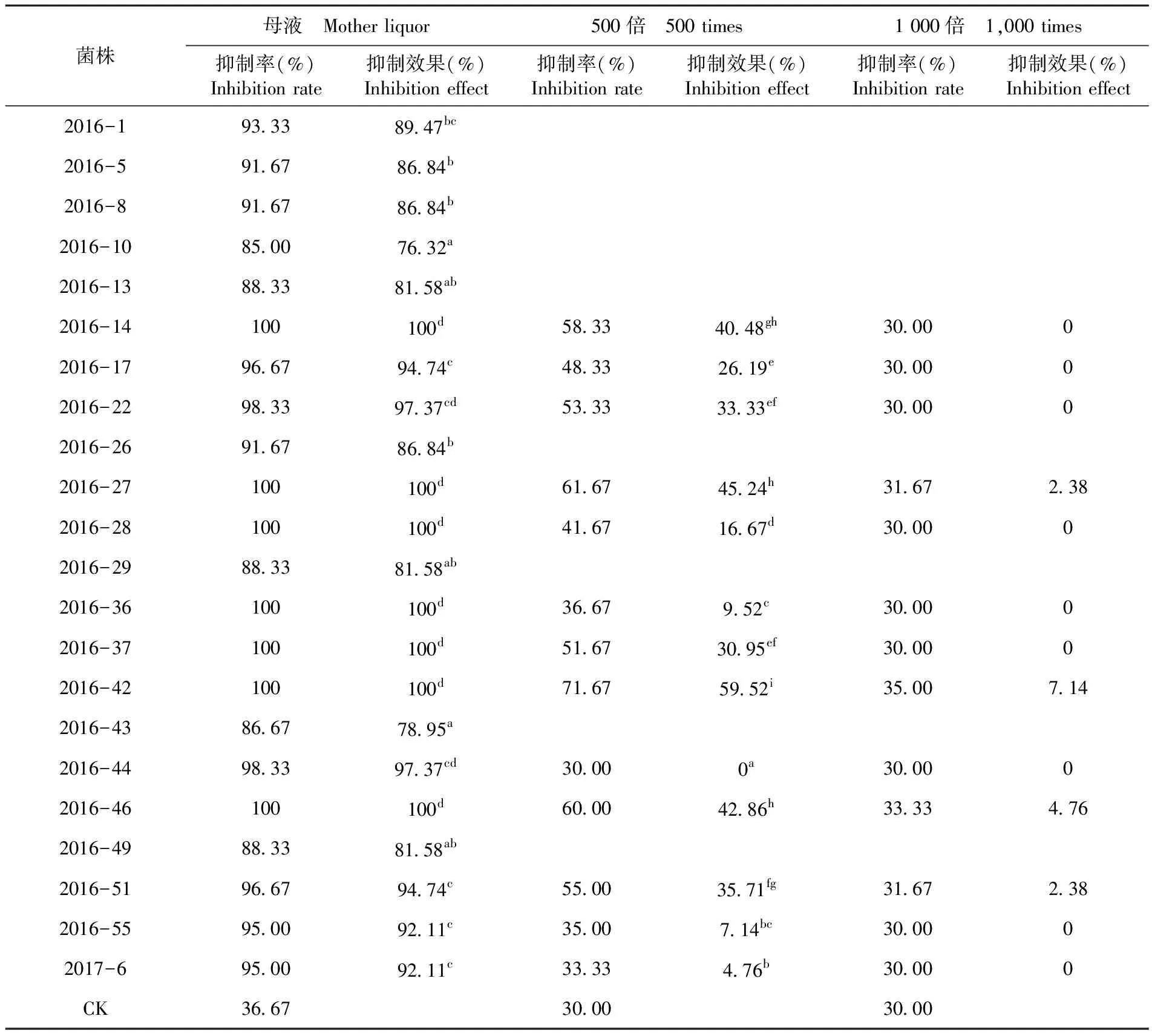
菌株母液 Mother liquor500倍 500 times1 000倍 1,000 times抑制率(%)Inhibition rate抑制效果(%)Inhibition effect抑制率(%)Inhibition rate抑制效果(%)Inhibition effect抑制率(%)Inhibition rate抑制效果(%)Inhibition effect2016-193.3389.47bc2016-591.6786.84b2016-891.6786.84b2016-1085.0076.32a2016-1388.3381.58ab2016-14100100d58.3340.48gh30.0002016-1796.6794.74c48.3326.19e30.0002016-2298.3397.37cd53.3333.33ef30.0002016-2691.6786.84b2016-27100100d61.6745.24h31.672.382016-28100100d41.6716.67d30.0002016-2988.3381.58ab2016-36100100d36.679.52c30.0002016-37100100d51.6730.95ef30.0002016-42100100d71.6759.52i35.007.142016-4386.6778.95a2016-4498.3397.37cd30.000a30.0002016-46100100d60.0042.86h33.334.762016-4988.3381.58ab2016-5196.6794.74c55.0035.71fg31.672.382016-5595.0092.11c35.007.14bc30.0002017-695.0092.11c33.334.76b30.000CK36.6730.0030.00
注:不同小写字母代表差异显著,P<0.05
Note:The different small letters represent significant difference at 5% level
2.4 不同接种方式菌株对列当致病性
研究表明,供试的7个菌株针刺法都可引起列当明显发病。其中菌株2016-14、2016-36接种3 d后即发病并迅速引起萎蔫、腐烂和茎基部褐变,接种7 d后整株腐烂,死亡。在涂抹法中,菌株2016-36、2016-42和2017-6对列当的侵染性最强,接种3 d表现明显发病,接种7 d后整株腐烂,死亡。在喷洒雾中,菌株2016-42和2017-6的致病效果最好,接种3 d后发病,7 d后整株腐烂,死亡。采用针刺、涂抹和喷雾等3种接种方式进行接种,不同菌株在不同接种方式下,发病情况具有明显差异。表3,图1
表3 不同接种方式菌株致病性比较
Table 3 Comparison of pathogenic of strains by different ways of inoculation
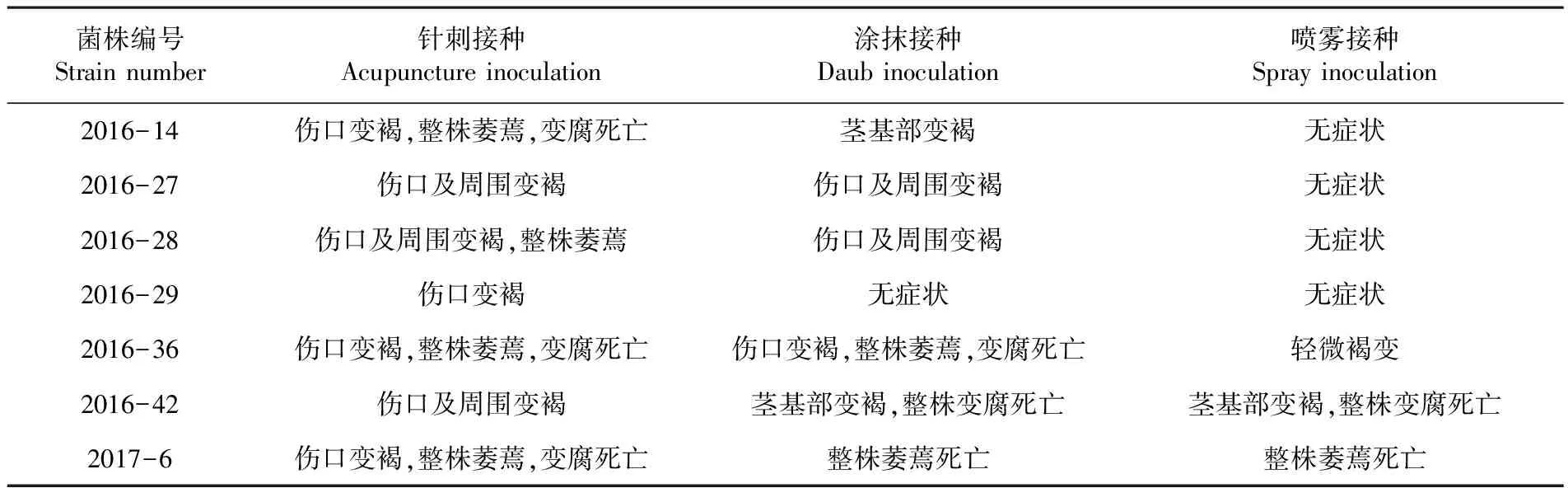
菌株编号Strain number针刺接种Acupuncture inoculation涂抹接种Daub inoculation喷雾接种Spray inoculation2016-14伤口变褐,整株萎蔫,变腐死亡茎基部变褐无症状2016-27伤口及周围变褐伤口及周围变褐无症状2016-28伤口及周围变褐,整株萎蔫伤口及周围变褐无症状2016-29伤口变褐无症状无症状2016-36伤口变褐,整株萎蔫,变腐死亡伤口变褐,整株萎蔫,变腐死亡轻微褐变2016-42伤口及周围变褐茎基部变褐,整株变腐死亡茎基部变褐,整株变腐死亡2017-6伤口变褐,整株萎蔫,变腐死亡整株萎蔫死亡整株萎蔫死亡

A:针刺接种;B:喷雾接种;C:涂抹接种;D空白对照
A:Acupuncture inoculation;B:Spray inoculation;C:Daub inoculation;D:CK
图1 菌株2016-42不同接种方式下列当发病情况
Fig.1 The infection situation of Broomrape use different inoculation by Strain 2016-42
2.5 菌株孢子悬浮液对列当出土抑制作用
研究表明,供试的3个菌株中,菌株2016-36和2016-42孢子悬浮液处理列当出土时间最早,较空白对照提前10 d,菌株2017-6孢子悬浮液列当出土时间最晚,较空白对照延迟22 d。3个菌株孢子悬浮液处理列当出土抑制效果具有显著差异,菌株2017-6孢子悬浮液对列当出土抑制效果最好,抑制效果为94.65%,其次是菌株2016-42,抑制效果为25.05%,菌株2016-36最低,抑制效果为19.70%。表4
表4 不同菌株孢子悬浮液对列当出土抑制效果比较
Table 4 Comparison of broomrape inhibition effect of different strains spore suspension

菌株Strains平均单盆列当出土数量 The number average single basin unearthed broomrape (strain/pot)9月25日10月6日10月18日10月28日总计 Sum抑制效果(%)Inhibition effect2017-60000.250.2594.65b2016-361.2502.503.7519.70a2016-4211.251.2503.525.05aCK01.672.670.334.67
注:不同小写字母代表差异显著,P<0.05
Note:The different small letters represent significant difference at 5% level
2.6 菌株鉴定
2.6.1 菌株形态学鉴定
菌株2017-6培养性状:在 PSA上25℃、4 d的菌落直径为3.0~4.5 cm。气生菌丝白色,羊毛状。形态特征:小型分生孢子数目多,椭圆形,肾形,0~1隔,大小(6.65~17.48) μm×(2.49~4.51) μm。大型分生孢纺锤形或镰刀形,基胞足跟明显,2~6分隔,多为2~3分隔,大小(3.50~4.51) μm×(17.41~39.46) μm。分生孢子梗长,单瓶梗,厚垣孢子顶生或串生。根据上述培养性状和形态特征,参考王拱辰等的《常见镰刀菌鉴定指南》[13],将菌株2017-6鉴定为尖孢镰刀菌Fusariumoxysporum。
2.6.2 菌株18S rDNA的ITS序列分析
通过GenBank中进行Blast比对,应用MEGA6.0软件中邻接法构建聚类分析树状图,bootstrap检验值≥50%,1 000次重复。基于数据库中18个菌株的ITS序列,采用邻接法构建系统发育树,以确证菌株2017-6的分类归属。菌株2017-6与菌株KF751873.1Fusariumoxysporum在同一分支上,且两个菌株ITS序列相似性为99%,这与形态学鉴定结果一致。图2

图2 菌株2017-6的系统发育树状图
Fig.2 The phylogenetic tree of strain 2017-6
3 讨 论
目前提出的防除列当的措施主要包括人工拔除、化学防除、农艺措施、培育抗性品种和昆虫防除等[14],但上述措施生产上应用存在缺陷,很难有效控制列当为害,因此,筛选对列当致病使其自然死亡的致病菌作为生防因子已成为研究热点。国内外已有很多关于从微生物防除列当的报道,主要有镰刀菌(Fusariumspp.)[15]、根瘤菌[16]、丛枝菌根真菌[17]和假单胞杆菌[18]等。已报道的从列当植株上分离获得的致病菌多为镰刀菌。研究中筛选出的菌株为镰刀菌,但由于镰刀菌中的许多种为多种植物病害的致病菌,因此,此类病原菌在使列当致病的同时也可能对寄主或其他农作物造成危害。要开发出对加工番茄安全且对列当高度致病的生防菌剂,还需要对已筛选菌株的寄主范围、安全使用浓度以及使用方法等做进一步的研究。
列当种子萌芽至寄生在寄主根部阶段是防治列当最佳时期[19]。研究中镰刀菌菌株发酵液对列当种子萌芽抑制效果较菌株粗毒素提取液差,菌株粗毒素提取液随着稀释倍数增加对列当种子萌芽抑制效果降低,当稀释倍数达到1 000倍时,菌株粗毒素提取液对列当种子萌芽无抑制效果。采用浓缩或添加助剂提高菌株毒素对列当种子萌芽抑制效果可作为进一步研究方向。
土壤中存在多种对植物土传病害有防治作用的有益微生物,而寄主植物对列当的抗性机理与植物对病原菌的抗性机理十分类似,因此,有益土壤微生物可能也可以防除列当[14]。此外,与从列当植株上分离的微生物相比,分离自土壤中微生物易在土壤中存活繁殖,且能够在列当种子萌芽和侵染寄主时发挥作用,因此,从该地加工番茄田间发病列当植株根际土壤中分离防除列当微生物可作为筛选列当生防菌的一个研究方向。
国内研究者从不同区域多种列当上分离获得对列当植株致病性强的菌株[10-13],但未见菌株孢子悬浮液对列当出土抑制效果的报道。研究筛选的菌株对列当出土具有较好抑制效果,但其作用机理、土壤中定殖能力及其与土壤中微生物群落相互作用需要进一步深入研究。
4 结 论
筛选出的菌株2017-6粗毒素提取液对列当种子萌芽抑制效果在90%以上,其孢子悬浮液对列当植株具有强致病性。目前,多数列当生防菌均是在列当出土后进行防治,此时作物已经遭受危害,且由于列当出土多在作物生育中后期,不易被发现,防治较为困难。菌株2017-6孢子悬浮液对列当出土抑制效果达94.65%,且可有效延缓列当出土时间。

