利用CRISPR/Cas9 技术建立斑马鱼Asb11基因敲除品系
尹丽阳,罗世锋,陈 宇,漆轲婧,彭 云,万永奇,吴秀山,李永青
(湖南师范大学省部共建淡水鱼类发育生物学国家重点实验室,教育部重点实验室,生命科学学院心脏发育研究中心,湖南 长沙410081)
生物信息学分析显示ASB11蛋白在N-末端有6个串联重复的锚蛋白结构域和1个在C-末端的SOCS箱形结构域[1]。ASB11蛋白是调控Delta-Notch信号的元件,以一种细胞非自主性机制调节DeltaA与Notch之间的侧抑制,是Delta-Notch信号至关重要的调节因子[2]。近年来有研究表明,Asb11在斑马鱼胚胎发育的终端分化过程中表达下调,且对于外胚层谱系分布范围具有潜在的调节作用,并表明Asb11的表达是肌肉祖细胞扩增所必须的,而其表达下调标志着终端分化的开始[3,4]。随后也有证据表明,Asb11是胚胎发育和成体肌肉再生的主要调节者[5]。
本实验室前期研究发现,Asb11基因包含的两个2.9 kb和5.0 kb转录本在心肌和骨骼肌中特异性表达[6];前人研究表明斑马鱼Asb11基因与Notch信号通路的激活有关,而Notch信号通路与斑马鱼心脏的瓣膜及流出道的发育有关。因此,本文作者推测Asb11基因也是一种与心脏发育相关的候选基因,其对于心脏的发育可能有重要的调节作用,且其可能通过Notch信号途径调控心脏的发育。
作为近年来兴起的基因编辑技术,CRISPR/Cas9是细菌演化过程中形成的一种适应性免疫防御机制,可用来对抗外来入侵的病毒及DNA[7-9]。前人研究中将CRISPR/Cas9分为3种类型,其中Ⅱ型中的Cas9能够识别一种非编码RNA(sgRNA),从而对靶向dsDNA序列进行定点切割[10]。因此,本文利用CRISPR/Cas9打靶技术对斑马鱼Asb11基因进行基因敲除。首先经网站分析筛选出Asb11基因最适合的打靶位点,通过PCR扩增出用于转录Asb11基因的CRISPR/Cas9打靶gRNA的双链DNA模板,再将Asb11基因的gRNA和Hcas9的mRNA都转录出来,混合后共同注射到斑马鱼胚胎Ⅰ细胞期胚胎中。在显微注射后,对Asb11基因CRISPR/Cas9打靶的F0代进行有效性检测,发现在斑马鱼Asb11基因的第一号外显子出现了5个和8个碱基的缺失,证明CRISPR/Cas9 系统对Asb11基因的敲除是有效的。进一步对其F0代、F1代和F2代进行筛选,成功获得Asb11基因敲除的斑马鱼品系。这些工作为探究Asb11在心脏发育中的作用奠定了基础。
1 材料与方法
1.1 材料
大肠杆菌感受态菌株E.coli:Top10 以及DH5α,克隆T载体(PMD18-T),本实验所有的野生型斑马鱼AB品系(所获得胚胎均在28.5 ℃恒温E3水中进行孵育),DNA胶纯化和回收试剂盒,T7转录试剂盒,质粒快速提取试剂盒,显微注射仪,RNA Cycle Pure kit等。
1.2 方法
1.2.1 Crispr打靶位点的选择
从Esembl(http:// www.ensembl.org / index.html)网站上获取目标基因的完整序列,各个转录本以及外显子和内含子等信息;并选取其中序列大小合适的外显子(一般优先选取1号外显子),再在NCBI(http://www.Ncbi.Nlm.Nih.gov/)网站上Blast其序列是否单一正确。然后用网上软件( http://www.genome-engineering.org / crispr/? page_id=41)进行打靶位点的设计选择,从中选取评分最高、最合适的靶标位点。
1.2.2 靶标序列gRNA的合成
根据国家斑马鱼资中心的资料可知,科学家已将 gRNA 的骨架序列克隆至PMD19-T 载体中,并命名为 p42250 质粒(如图1所示)。运用1.2.1所述网站设计合成的gRNA以P42250质粒(gRNA骨架载体)为模板进行PCR扩增,将扩增后得到的序列进行PCR产物胶纯化回收,用T7转录酶系统对纯化回收后的PCR序列进行体外转录成mRNA,再用RNA纯化试剂盒对mRNA纯化回收,保存于-80 ℃冰箱。
1.2.3 Cas9的合成与制备
用XbaⅠ将mRNA Cas9的模板h-Cas9质粒酶切线性化,经过DNA胶纯化回收试剂盒进行纯化回收,用RNase Free H2O 溶解回收于RNase Free 的EP管中。使用T7 Ultra Kit (Ambion,AM1345) 进行体外转录成mRNA,再用RNA纯化试剂盒对mRNA纯化回收,保存于-80 ℃冰箱。
1.2.4 斑马鱼胚胎显微注射及有效性检测
收取斑马鱼胚胎,待其发育至Ⅰ细胞期时排列整齐于注射板上,用半自动注射仪将提前混合好的hCas9 mRNA和gRNA(二者的混合按一定的浓度比:hCas9 mRNA∶300 ng/μL,gRNA∶20 ng/μL;)共同注射其中。同时收取同缸产的野生型胚胎进行对照,置于28 ℃培养箱培养48 h至72 h,期间收取1/3注射过后的胚胎及WT的胚胎进行有效性检测,提取其基因组,然后进行PCR扩增,测序检测。
1.2.5 斑马鱼F0、F1、F2代基因型鉴定
胚胎有效性检测为阳性后,将该批斑马鱼培养至3个月左右成熟,对单个个体斑马鱼剪尾提取基因组,PCR后测序分析,对于测序结果为双峰的个体,进行PMD18-T载体连接转化,再进行测序分析,从而获得有缺失的突变个体即F0代。将F0代与WT杂交,获得F1代,剪尾提取基因组DNA,进行PCR,产物进行测序分析,获得可稳定遗传的F1代。F1代雄性杂合体与F1代雌性杂合体杂交,可获得F2代纯合突变体,然后进行PCR和测序检测分析。
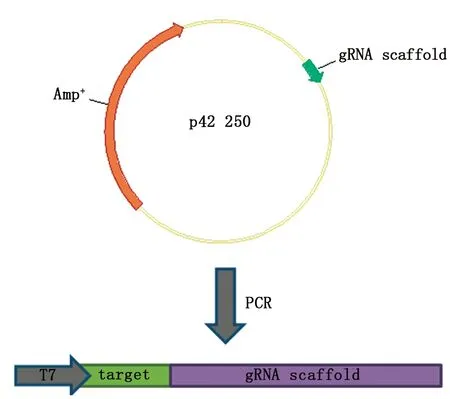
图1 p42250质粒示意图Fig.1 The picture of p42250 plasmid

图2 Asb11基因靶标位点示意图Fig.2 The design diagram of Asb11 gene targeting site注: 以上序列是 Asb11基因序列的一部分,加粗部分是 1 号外显子;未加粗的是内含子;下划线为直线的表示靶标序列;下划线为双直线的表示 PAM 序列;阴影部分为检测引物,绿色为两对引物重叠部分。Note:The above sequence is a partial sequence of the Asb11 gene;the bold part is exon 1;the un-enhanced portion is an intron;“ ”: the target sequence;“ ” : the PAM sequence;shadow region: the primers for detection;green region: the overlap of two pairs primers.
2 结果
2.1 Asb11基因靶位点的选择
按1.2.1所述的方法在Asb11基因1号外显子上择优选取打靶位点,将保护碱基 tg 和 T7 启动子加在设计好的靶位点序列前面,gRNA骨架的上游序列加在靶位点后面,将此作为正向引物序列,命名为:Asb11-gRNA-F1;以gRNA骨架的下游序列为反向引物,即Asb11-Cas-R (如表1) 。
2.2 Asb11基因gRNA和CAS9 mRNA的合成
将按1.2.2中所述方法设计好的靶标gRNA序列送铂尚公司合成后,用XbaⅠ酶切线性化的p42250质粒为模板,以Asb11-gRNA-F1为正向引物,Asb11-Cas-R作为反向引物进行PCR扩增(凝胶电泳结果如图3)。将PCR产物纯化回收后,以T7体外转录系统进行体外转录成mRNA,随后纯化回收(图4所示);hCas9 mRNA也是以线性化的p42250质粒为模板体外转录获得,纯化回收后均 保存于-80 ℃。
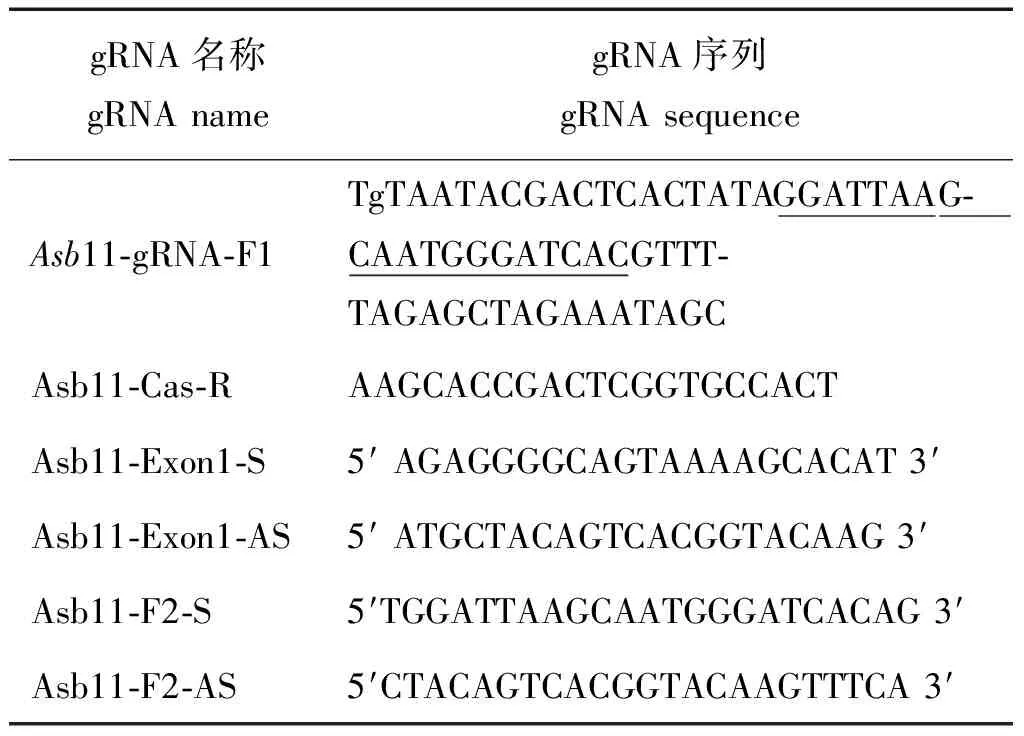
表1 gRNA及引物序列列表Tab.1 gRNA and primers list
注: 其中 Asb11-gRNA-F1是gRNA 正向引物;tg是保护碱基;TAATACGACTCACTATA 是T7启动子序列;下划线部分是靶标序列;GTTTTAGAGCTAGAAATAGC 是gRNA 骨架上游序列;Asb11-Cas-R是gRNA反向引物;AAGCACCGACTCGGTGCCACT 是gRNA 骨架下游序列;Asb11-Exon1-S及Asb11-Exon1-AS,Asb11-F2-S和Asb11-F2-AS是检测引物。
Note: Asb11-gRNA-F1: gRNA forward primer;Tg: the protecting base;TAATACGACTCACTATA: the T7 promoter sequence;“ ”: the target site sequence;GTTTTAGAGCTA GAAATAGC: the upstream sequence of the gRNA backbone sequence;Asb11-Cas-R: a gRNA reverse primer;AAGCACCGACTCGGTGCCACT: the downstream sequence of the gRNA back-bone sequence;Asb11-Exon1-S, Asb11-Exon1-AS, Asb11-F2-S, Asb11-F2-AS: the primers for detection.
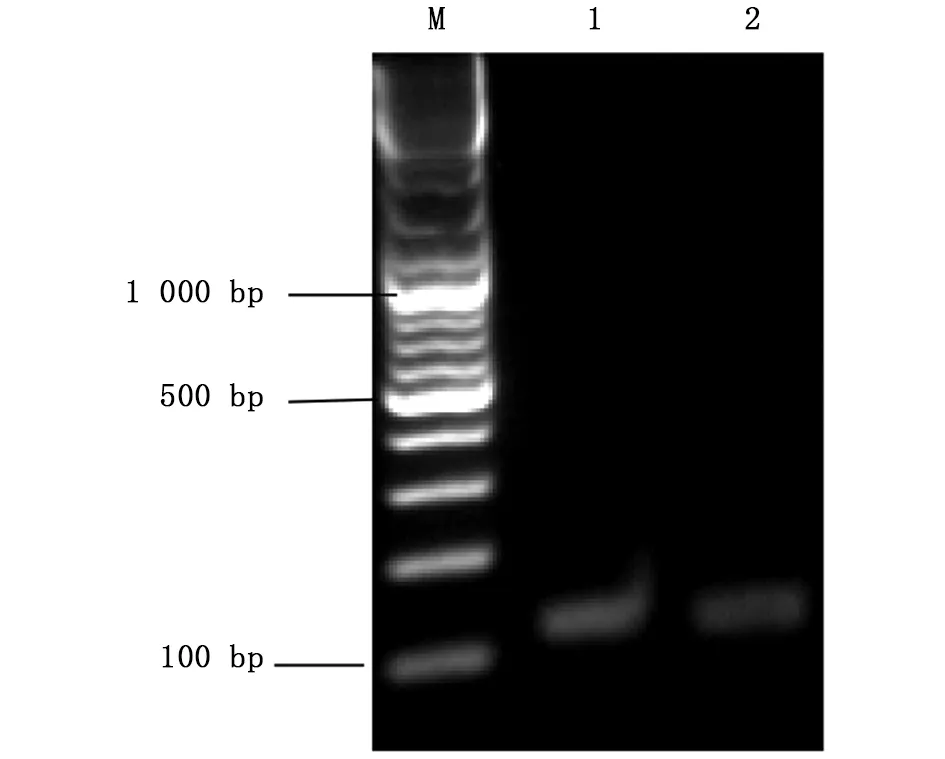
图3 Asb11基因gRNA 模板PCR扩增片段结果Fig.3 The PCR amplification results of Asb11-gRNAM:DNA marker;1、2:Asb11-gRNA-F1
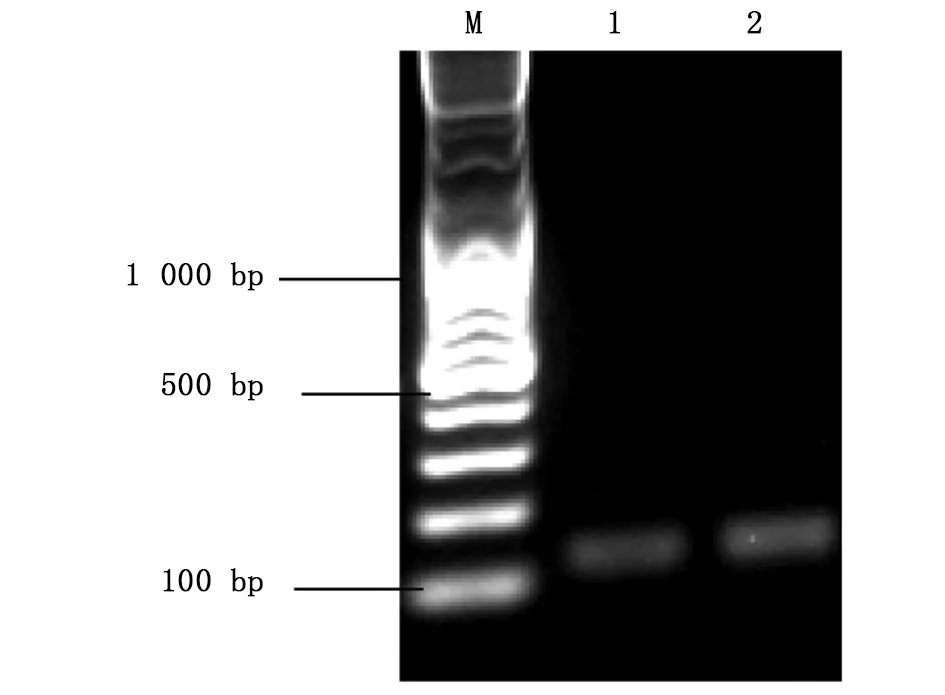
图4 Asb11基因gRNA体外转录纯化结果Fig.4 The transcriptional purification results of Asb11-gRNAM:DNA marker;1、2:Asb11-gRNA-F1
2.3 Asb11基因打靶有效性检测分析
由1.2.4所述的实验方法将hCas9mRNA与Asb11-gRNA-F1在斑马鱼胚胎发育至Ⅰ细胞期时混合共同注射入胚胎中,将胚胎置于28 ℃下孵育48-72 h后随机挑取8管,其中1管为野生型胚胎(对照),每管大约5-10颗胚胎提取基因组,以其为模板,分别以Asb11-Exon1-S及Asb11-Exon1-AS为正反引物进行PCR扩增,凝胶电泳结果显示PCR产物的大小约为400 bp(图5所示),与预期的387 bp相符。将PCR产物送测序分析,结果显示在Asb11-gRNA-F1的靶位点处出现双峰(结果如图6),提示该位点存在碱基的插入与缺失。
为了更明确Asb11-gRNA-F1注射的有效性,我们将注射的胚胎提基因组后纯化回收PCR 产物与PMD18-T载体连接后转化,挑10个左右单克隆菌落送测序,测序结果表明确实存在5 bp和8 bp碱基的缺失(如图7)。进一步说明了Asb11-gRNA-F1注射是有效的。
2.4 Asb11基因打靶F0代突变体的筛选
检测过打靶的有效性后,将注射了Asb11-gRNA-F1与hCas9的胚胎培养至3个月左右性成熟,养大的斑马鱼一共有21条,按编号Asb11-F0-1至Asb11-F0-21对其进行排序剪尾提基因组,并以其为模板,用引物Asb11-Exon1-S及Asb11-Exon1-AS进行PCR扩增,得到一条387 bp的条带,回收PCR产物送测序,测序结果显示Asb11-F0-3、5、8、9靶位点有双峰,打靶效率为19.04%,其中Asb11-F0-8的测序结果如图8所示。
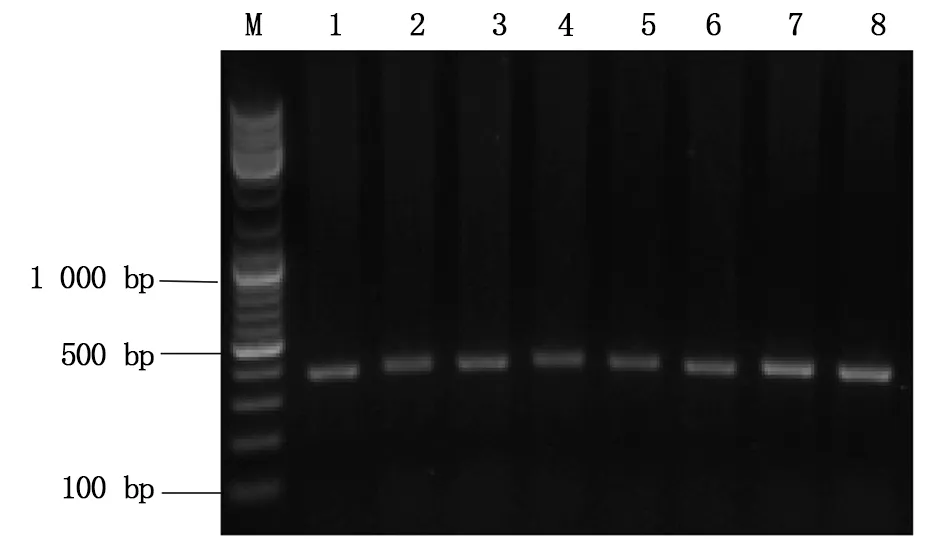
图5 PCR产物电泳结果示意图Fig.5 The electrophoresis results of PCR productM:DNA marker;1-7:注射组1-7; 8:WT (野生型对照组)M:DNA marker;1-7:Injection group 1-7;8:WT (control group)
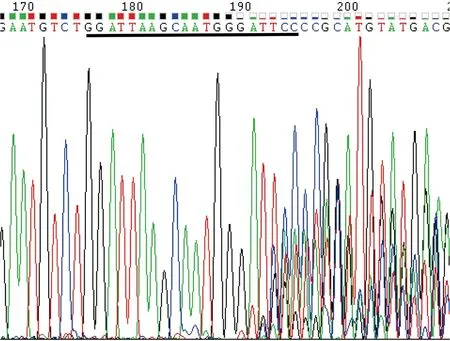
图6 PCR 产物测序峰值图Fig.6 PCR product sequencing peak results注:图为正向测序峰值结果,黑色下划线部分为Asb11-gRNA-F1靶标位点。Note:The picture is the result of forward direction sequencing peak map;“ ”: the target sequence of Asb11-gRNA-F1.
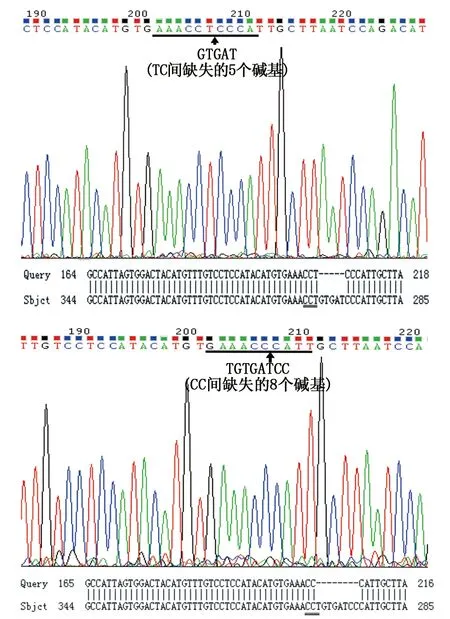
图7 gRNA打靶区域序列与正常序列比对结果Fig.7 The BLAST comparison results of gRNA target sequence to the sequence of WT 注:黑色下划线部分为Asb11-gRNA-F1靶标位点,黑色下划线为三直线部分表示PAM序列Note:“ ”:the target sequence of Asb11-gRNA-F1;“ ”: the PAM sequence.
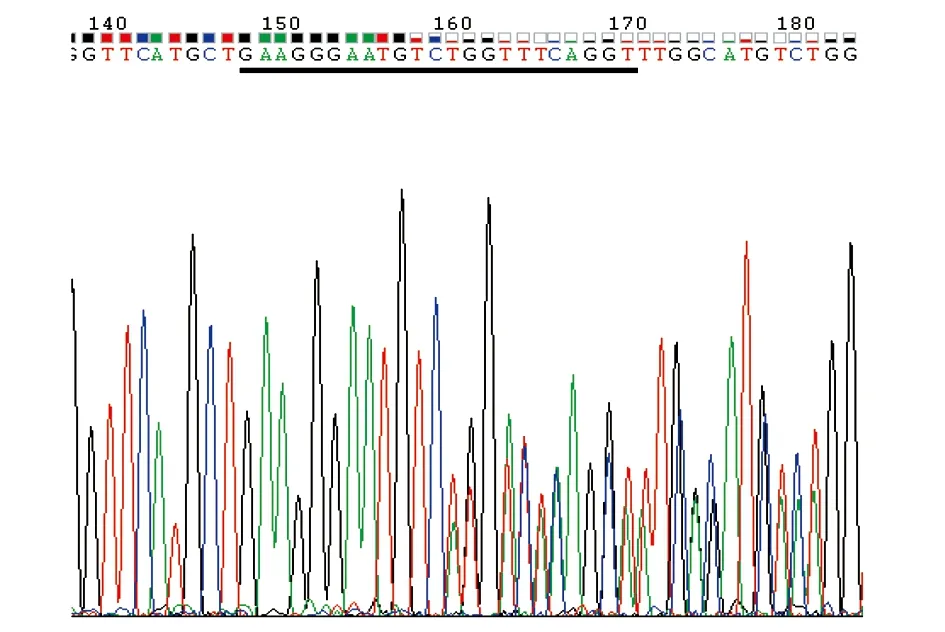
图8 Asb11-F0-8 的 PCR产物测序峰值结果图Fig.8 Asb11-F0-8 PCR product sequencing peak results注:黑色下划线部分为Asb11-gRNA-F1靶标位点。Note:“ ”: the target sequence of Asb11-gRNA-F1.
通过对测序结果进行分析,我们将Asb11-F0-3、5、8、9这4个基因组PCR的纯化产物与PMD18-T载体连接,之后转化挑10个单克隆菌落送测序,并对测序结果进行比对,获知Asb11-F0-9、3、5、8分别出现1个和2个碱基的插入,9个和14个碱基的缺失(如图9),由于9是3的倍数,因此Asb11-F0-5的敲除未达到目的。
2.5 稳定性遗传的检测
为了验证F0代个体是否能够稳定遗传,我们将F0代嵌合体与野生型斑马鱼杂交得到F1代个体,培养至3个月左右性成熟,对F1代个体剪尾提基因组,以基因组DNA为模板进行PCR扩增,送测序;将测序结果为双峰的PCR产物纯化回收后连接PMD18-T载体克隆,挑单克隆测序比对分析结果见表2,结果显示有3个突变类型能够稳定遗传。

图9 Asb11 F0代测序比对结果示意图Fig.9 The blast of sequence results of Asb11 F0
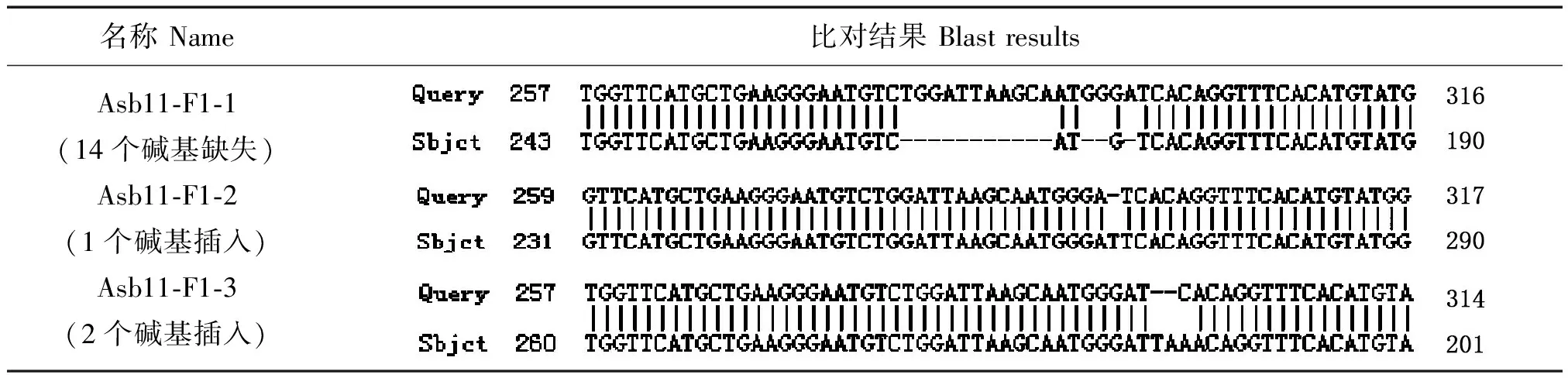
表2 斑马鱼Asb11基因F1代突变体比对结果图Tab.2 The blast results of zebrafish Asb11 gene mutant F1
注:Query:WT序列; Sbjct:测序序列。
Note:Query: WT sequence;Sbjct:Sequencing sequence.
2.6 F2代纯合突变体的筛选
本文选择缺失了14个碱基的Asb11-F1-1,插入了1个和2个碱基的Asb11-F1-2、Asb11-F1-3这3种F1代突变体建立稳定遗传的纯合敲除品系。已经筛选到缺失了14个碱基的雄性和雌性F1代斑马鱼突变体,二者杂交后获得大量胚胎,在适宜条件下培养胚胎至3个月左右性成熟,剪尾提取基因组鉴定。通过两对检测引物进行PCR扩增后的电泳结果及测序检测分析(图10所示),已经获得F2代雄性纯合突变体。Asb11-F2-S和Asb11-F2-ASPCR扩增的条带大小为181 bp,在Asb11-Exon1-S及Asb11-Exon1-AS为引物进行PCR扩增有大小为387 bp的条带的情况下,若第二对引物PCR扩增无条带,则表明为纯合子(如图11)。
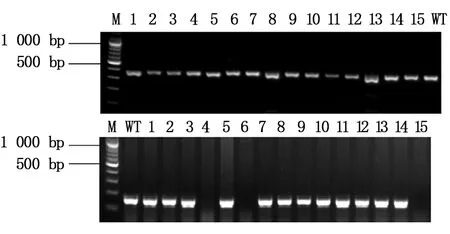
图10 PCR产物电泳结果Fig.10 The electrophoresis results of PCR product M:DNA marker;1-15:F2代个体;8: WT (野生型对照组)M:DNA marker;1-15:F2 generation fish; 8: WT (control group)
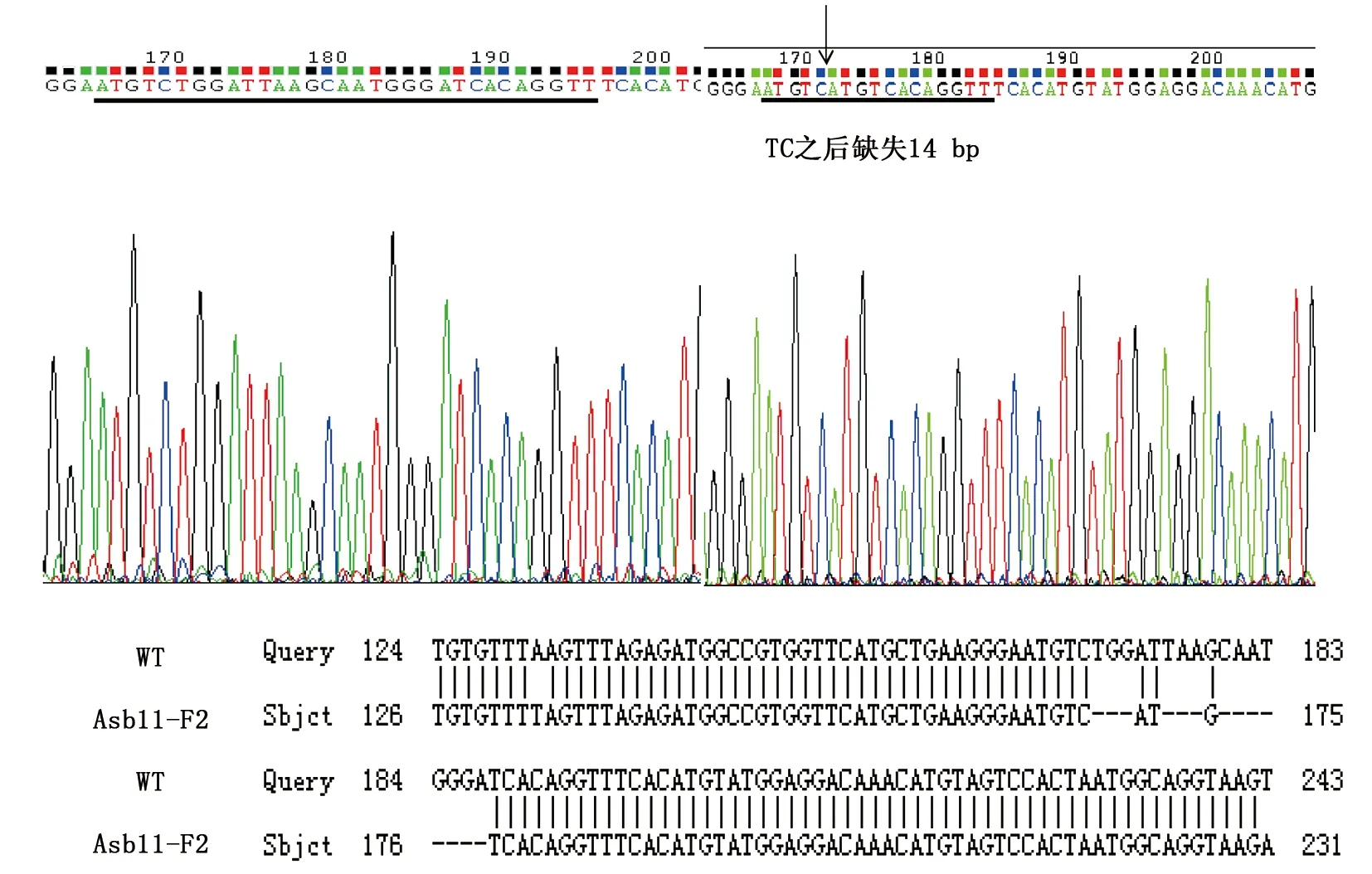
图11 F2代纯合突变体测序比对结果Fig.11 The blast of sequence results of homozygous F2 generation mutant
目前已对152条F2代进行了突变体的筛选,得到了24条纯合突变体,均为雄性,尚未获得雌性纯合突变体。还有大量F2代小鱼及胚胎正在培育中,将继续筛查。
3 讨论
CRISPR/Cas9基因编辑技术是继ZFN、ES 细胞打靶和 TALEN 打靶等传统技术后出现的第四种可应用于定点构建基因敲除大、小鼠动物模型的方法。它设计简单,制作成本低;效率高、速度快;能特异性识别任意序列,无物种限制;毒性低且脱靶情况少,因而广泛应用于基因定点修饰,在动物模型构建的应用上前景十分广阔,目前已广泛应用于生命科学领域的研究[11-17]。本文用CRISPR/Cas9基因编辑技术,也在斑马鱼胚胎的整体水平敲除了Asb11基因,成功地构建斑马鱼Asb11基因敲除稳定遗传系。
本实验室的前期研究结果显示Asb11基因在心肌和骨骼肌中特异性表达。Asb11基因在骨骼肌中的作用已经得到了很好的诠释。已有的研究表明Asb11的表达是肌肉祖细胞扩增所必须的,而其表达下调标志终末分化的开始[3,4],该基因还是成体肌肉再生的主要调节者[5]。但是Asb11基因在心脏发育中的功能尚不清楚。为此,本文用CRISPR/Cas9基因编辑的新技术构建斑马鱼Asb11基因敲除品系,通过PCR测序检测分析已经成功获得了可以稳定遗传的F2代突变体系。这一工作为深入探究该基因在心脏发育中的作用奠定了基础。
在对F2代突变体的筛选中,本次研究仅获得了该基因缺失14 bp的雄性纯合突变体,并未筛选到雌性纯合突变体。斑马鱼早期是雌雄同体,卵巢的发育是受精后10-20 d期间,随后卵巢细胞开始凋亡,精巢开始发育,其性别分化被确定[18]。斑马鱼的性成熟需要3个月左右,在其胚胎发育阶段,存在多个决定其性腺发育的基因;有研究显示,斑马鱼的性别决定也是由多个基因协同调控芳香化酶基因的表达,使其活性降低或缺失,从而影响雌激素的分泌,导致卵巢的程序性死亡;而在这种情况下,睾丸细胞开始分化,斑马鱼的性别逐渐由雌性向雄性转变[19,20]。对于本次研究中F2代纯合突变体仅出现雄性的现象,较为合理的解释有四种:1)实验样本基数过少。本研究已完成性别鉴定的斑马鱼152条,但纯合子突变体只有24条,实验基数还不够大,须在后期的研究中增大F2代个体筛选的数目,以完全排除筛选基数少导致这种现象的可能性。2)在斑马鱼的养殖过程中,本文作者发现斑马鱼的养殖密度过大也可能会影响到其性别的分化,使得斑马鱼的性别由雌性向雄性转化。后期需减小F2代斑马鱼个体的养殖密度,应按照合理的饲养密度不大于1Tail/L进行F2代斑马鱼的饲养,排除养殖密度对性别分化的影响。3)众所周知,CRISPR/Cas9打靶技术仍然存在一定的脱靶率,所以在Asb11基因被敲除的情况下,也可能出现其他与斑马鱼性别决定相关的基因被敲除。因此,需对斑马鱼性别决定的相关基因进行鉴定、筛查或者进行全基因组测序,确定其他基因是否发生了移码突变,从而影响了其性别的分化。4)Asb11基因可能参与了斑马鱼的性别发育,且在性别转化过程中该基因是不可或缺的,即在斑马鱼性别分化过程中Asb11基因发挥着关键作用,正常表达的Asb11基因会保持斑马鱼性别转化的稳定性,使后代雌雄比例保持相对稳定的状态。一旦Asb11基因缺失,斑马鱼的性别分化机制可能发生紊乱,这种紊乱可能为斑马鱼雌性发育过程被阻断,促使斑马鱼在性别分化过程中只能向雄性转化。也可能为Asb11基因敲除后,启动了卵巢细胞的凋亡机制,加速了卵巢细胞的凋亡进程,在此过程中精巢细胞发育过程不受影响,使得Asb11基因敲除后的F2代纯合突变体均为雄性。只有确定F2代纯合突变体的性别决定是否受其他因素的影响,才能进行进一步有关Asb11基因是否是斑马鱼性别决定相关基因的具体情况分析研究。

