TNF-α基因多态性及缺氧对激素诱导性股骨头坏死的影响分析
薛 亮,白东昱
(延安大学附属医院 关节外科,陕西 延安716000)
股骨头坏死是由多种因素因子的病理过程,涉及到血供的损伤以及骨细胞的坏死,且一般认为本病不可逆,临床上可分为创伤性股骨头坏死和非创伤性股骨头坏死[1]。激素性股骨头坏死(SONFH)属于非创伤性股骨头坏死,通常是由于肾上腺激素的长期和过量使用所致,但其发病机制尚不完全清楚[2]。为了探讨肿瘤坏死因子(TNF)-α基因多态性及缺氧对激素诱导性股骨头坏死的影响,本次研究对我院在2013年1月-2015年1月期间收治的100例激素性股骨头坏死患者进行了病例对照研究,现将相关内容报道如下。
1 资料和方法
1.1 资料来源
选取2013年1月-2015年1月期间我院收治的100例激素性股骨头坏死患者作为病例组,所有患者均依照国际骨循环研究会制定的相关标准[3]被确诊为激素性股骨头坏死。同时选取同期我院体检的100例健康人群作为对照组。被纳入本次研究的所有研究对象均为汉族,其中对照组男性患者64例,女性患者36例;病例组男性患者67例,女性患者33例。本研究经医院伦理委员会讨论会通过,所有患者均知情同意,并签署了知情同意书。
1.2 研究方法
所有研究对象均被抽取20 ml静脉血,加EDTA-NA2抗凝剂,并采用淋巴细胞分离液分析有核细胞,然后用基因组DNA提取试剂盒提取基因组DNA。采用Primer 5软件设计氨基酸标记的等位基因特异性寡核苷酸(ASO)探针,的引物的5'端都标记有生物素。将探针分别固定到硝酸纤维素膜上,将PCR特异性扩增产物与之杂交,然后将滤膜放入10%的EDC(1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐),用蒸馏水洗涤几次并在滤纸上干燥,室温下,放入显色液中10-15分钟,蓝紫色的斑点被记录为阳性,经显色反应后记录结果。比较两组患者TNF-α基因型。
rs1800629的引物为: 5’-GAAGTTAGAAGGAAACAGACCACAG-3’,
反向: 5’-TGTGGTCTGTTTCCTTCTAACTTCC-3’,
rs1799964的引物为: 5’-AGAAGATGAAGGAAAAGTCAGGGTC-3’
反向: 5’-GACCCTGACTTTTCCTTCATCTTCT-3’
rs1800630的引物为: 5’-TGTAGCGGCTCTGAGGAATGGGTTA-3’
反向: 5’-CCTGTAACCCATTCCTCAGAGCCGC-3’。
1.3 统计学方法
所有数据均采用SPSS19.0进行统计分析。采用χ2检验分析Hardy-Weinberg平衡(HWE)和两组间的环境因素差异,根据两组间方差是否均衡采用t检验或t’检验来分析两组间的年龄差异,SNP和环境因素对SONFH易感性的功能分析采用Logistic回归分析。以P值<0.05认为差异具有统计学意义。
2 结果
2.1 两组患者基线及人口学特征分析
对激素性股骨头坏死的危险因素进行分析发现,病例组患者的有缺氧史的比例(67%)明显高于对照组(42%),差异有统计学意义(P<0.05),详见表1。
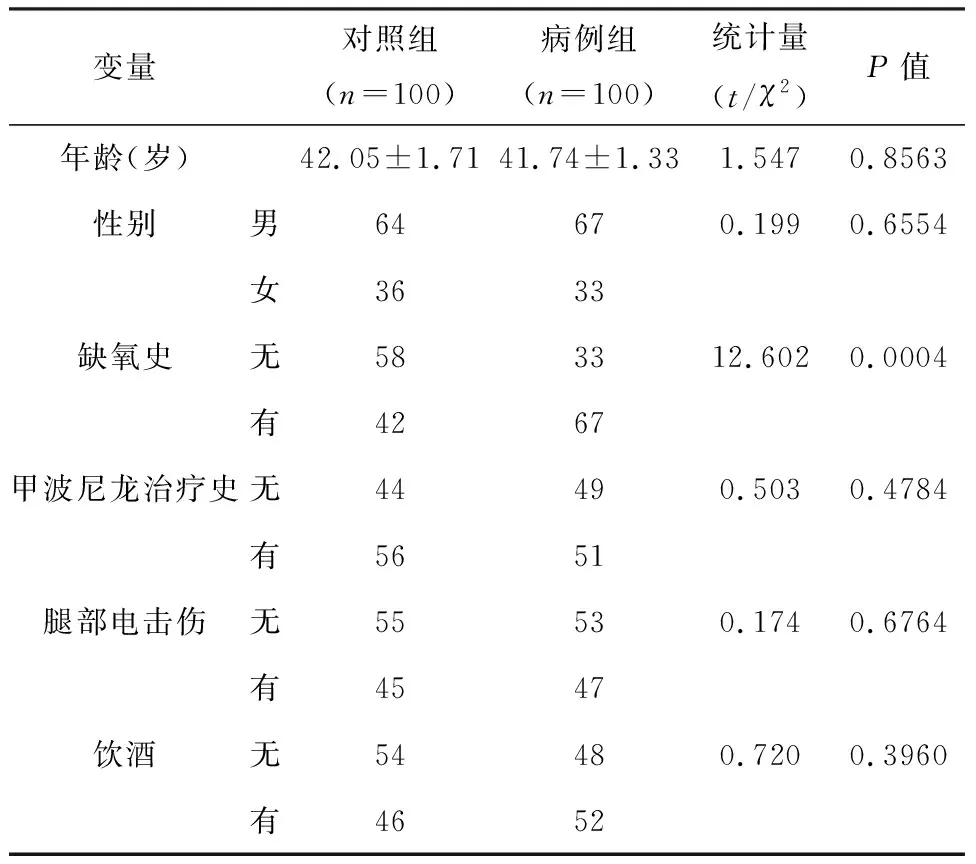
表1 两组患者激素性股骨头坏死危险因素比较
2.2 两组患者TNF-α基因多态性与患病风险关系分析
TNF-α基因多态性包括rs1800629,rs1799964和rs1800630。病例组患者rs1800629的AA基因型比例(17.0%)明显高于对照组患者(5.0%),病例组患者rs1800630的AA基因型(33.0%)明显高于对照组患者(4.0%)。Logistic回归分析显示, rs1800629的AA基因型较GG基因型有更高的患激素性股骨头坏死的风险(OR=3.89(1.32-10.44));rs1800630的AA基因型较CC基因型有更高的患激素性骨头坏死的风险(OR=7.72(3.21-29.85))。详见表2。
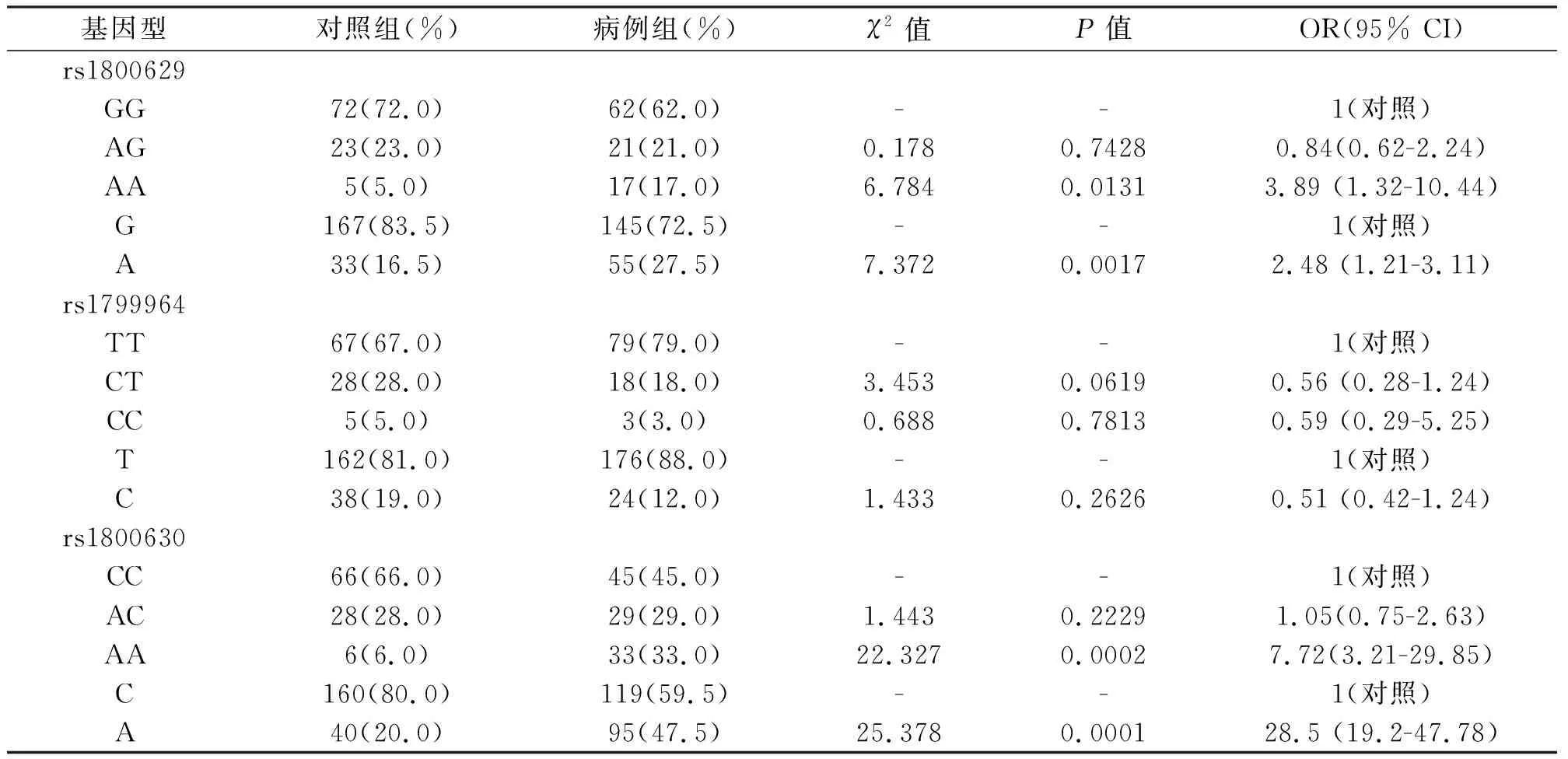
表2 两组患者TNF-α基因多态性比较
2.3 激素性股骨头坏死患者缺氧史与TNF-α基因变异相关性分析
采用Logistic回归分析激素性股骨头坏死患者缺氧史与TNF-α基因变异相关性分析。可以看出,以无缺氧史并且rs1800629未发生突变为对照,无缺氧史但有rs1800629突变的研究对象有更高的患激素性股骨头坏死风险(OR=2.69(1.24-3.96));有缺氧史并且有rs1800629突变的研究对象患激素性股骨头坏死风险最高(OR=5.43(1.50-9.56))。以TNF-α的rs1800630位点未变异并且未经历过缺氧为对照,可以发现患者TNF-α的rs1800630为变异基因型并经历了缺氧状态,那么其患激素性股骨头坏死风险更高(OR=4.74(1.82-6.83))。详见表3。
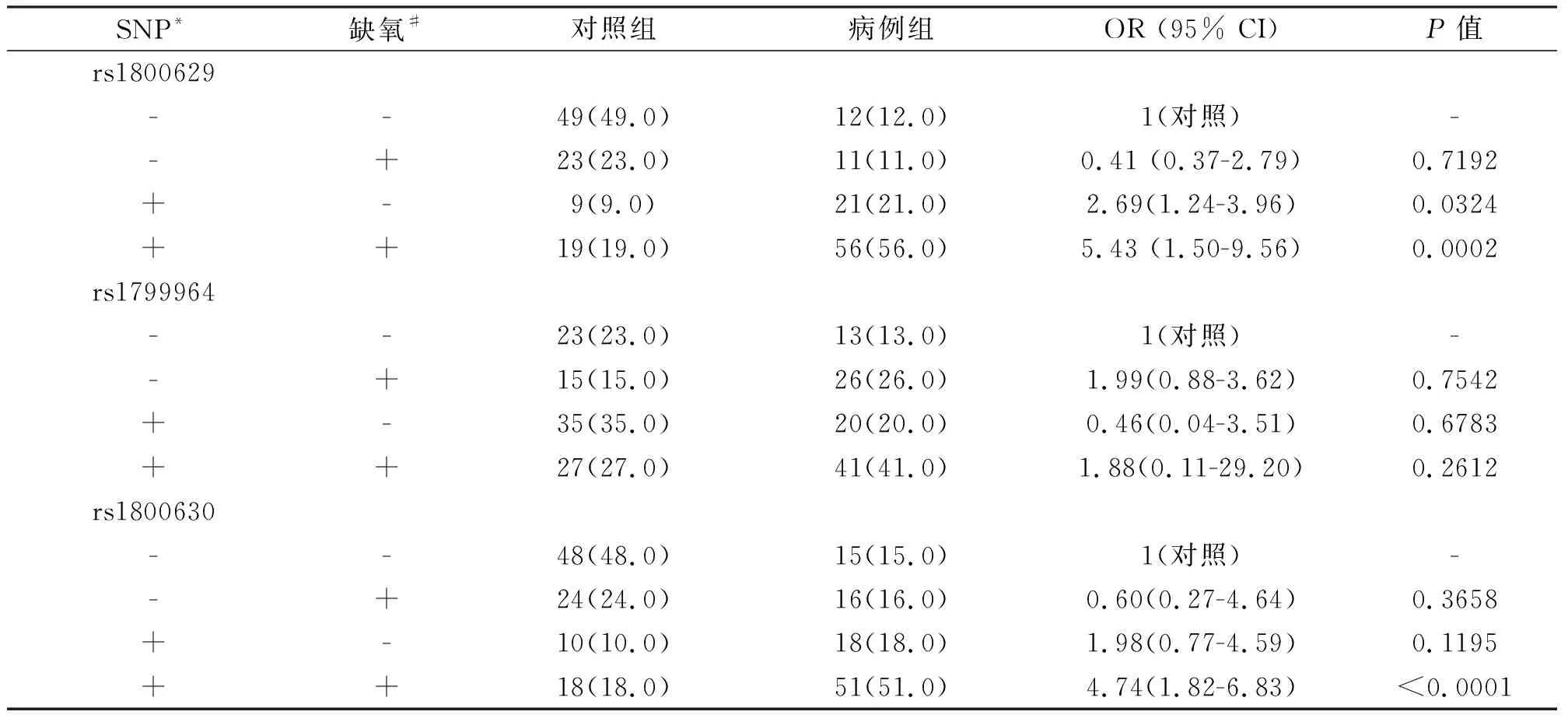
表3 激素性股骨头坏死患者TNF-α基因变异与缺氧相关性分析
3 讨论
约40%的患者在使用糖皮质激素后发生股骨头不可逆的坏死,甚至早期即可出现股骨头塌陷[4],糖皮质激素导致股骨头坏死的机制尚不完全清楚,相关研究发现超过剂量激素可诱导成骨细胞和骨细胞的细胞凋亡,从而减少骨细胞的数量,导致骨细胞的凋亡坏死,甚至破坏骨结构[5]。近年来,广泛存在于人体组织上的疾病的遗传多态性的影响引起关注,并有许多研究涉及SNP和股骨头坏死相关性[6]。然而,很少有研究着眼于TNF-α的基因多态性和SONFH易感性的关联。此外,SONFH还受到环境因素的影响,相关研究发现年龄在患者的股骨头坏死发生中起到了一定作用,有研究发现低氧能增强糖皮质激素诱导的成骨细胞的细胞凋亡[7,8]。
对于激素性股骨头坏死,多数专家认为主要是引起骨细胞凋亡。TNF-α属于TNF受体家族,参与细胞凋亡的调节,TNF-α基因作为重要的炎症因子,被认为与破骨细胞增殖和成熟相关联。有研究发现TNF-α能够抑制胶原蛋白,碱性磷酸酶活性和骨钙素的合成,且TNF-α的多态性也与SONFH发作风险密切相关。本研究也发现TNF-α多态性rs1800629和rs1800630与SONFH发生显著相关。激素性股骨头坏死患者与健康对照组比较,具有更高比例的缺氧史。 rs1800629的突变基因型可能会增加其激素性股骨头坏死的发生风险。如果患者TNF-α多态性rs1800630为变异基因型经历了缺氧状态,其SONFH的风险增加4倍以上。有学者认为血流减少可能是激素性股骨头坏死的病理因素之一[9]。激素可通过引起脂肪代谢障碍,造成相关动脉阻塞,导致股骨头缺血坏死。此外,糖皮质激素可通过诱导胆固醇沉积,降低组织液流动性和细胞膜通透性,从而造成骨细胞死亡[10]。有学者认为激素性股骨头坏死属于股骨头缺血性坏死[11],在缺血缺氧情况下,p38促分裂原活化蛋白激酶(p38MAPK)途径激活,可促进低氧诱导的成骨细胞凋亡。在生理或病理情况下,骨组织和细胞缺氧经常存在,低氧状态下,激活低氧反应通路,通过诱导低氧诱导因子集聚,随之激活相关基因,参与调控糖酵解、血管形成和血管扩张等,可引起;成骨细胞和骨细胞中大量NO生成,抑制骨的修复和重建造成,对已受损的骨细胞造成进一步损伤,产生大量凋亡细胞[11,12]。
糖皮质激素抑制成骨细胞的产生,促使成骨细胞及骨细胞凋亡[13]。低氧对骨组织细胞也会产生直接影响。近年来,低氧和糖皮质激素介导的细胞反应之间的相互影响已日益引起人们的关注。有研究发现,低氧可造成机体内糖皮质激素释放,低氧可上调人近端肾小管上皮细胞糖皮质激素受体,增加糖皮质激素的敏感性[14]。在股骨头局部微环境中,糖皮质激素和低氧之间相互作用,并对成骨细胞和骨细胞产生影响[15]。本研究是以医院为基础的病例对照研究,收集的病例来源单一,且病例数仅为100例,具有一定的局限性,后续研究还需进一步扩大样本量以及样本来源,以进一步探讨TNF-α基因多态性及缺氧在激素诱导性股骨头坏死发生过程中可能存在相互作用以及其中的机制。

