黑枸杞花色苷纯化工艺的优化与评价
顾子杨,崔梦迪,李玉华,季 拓,潘 扬,潘自皓
(1.南京中医药大学药学院,江苏 南京 210023;2.南京中医药大学第三附属医院甲乳外科,江苏 南京 210001)
黑枸杞是近年来新发掘的野生植物资源,在我国主要分布于西北地区的宁夏、青海、新疆等地[1],其营养丰富,兼具较高的食用和药用价值,开发潜力巨大[2-5]。黑枸杞富含花色苷类成分[6-7]。同时,黑枸杞产地自然环境恶劣,如盐碱干旱、早晚温差大、日照强、风力大、海拔高、氧气稀薄等,在多种环境因素的胁迫下,相比其他来源(蓝莓、黑莓、葡萄等),黑枸杞花色苷的组成、相对含量与分子结构必然存在特殊性,但这类文献报道仍然很少,有必要继续深入研究。建立高效、简便的黑枸杞花色苷提取纯化工艺,是进行上述研究的前提。本文从前期工作制备的黑枸杞花色苷提取物出发,通过萃取去除提取物中的脂溶性杂质,以及大孔吸附树脂分离工艺去除水溶性杂质,优化黑枸杞花色苷的纯化工艺,并通过高效液相色谱分析和自由基清除率测定,对纯化效果进行评价,从而为黑枸杞花色苷抗氧化活性的物质基础研究与高附加值产品开发奠定坚实的基础。
1 材料
1.1药物与试剂黑枸杞干果产自青海省德令哈地区,由鸿草生物科技(苏州)有限公司惠赠。甲酸、甲醇、乙醇、丙酮、石油醚、乙酸乙酯均为分析纯,购自南京化学试剂有限公司;氯化钾、无水乙酸钠、2,2-联氮-二(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(ABTS阳离子自由基)、三氯化铁和2,4,6-三吡啶基三嗪(TPTZ),购自上海Aladdin公司(分析纯);1,1-二苯基-2-三硝基苯肼(DPPH自由基)、没食子酸,购自SIGMA-ALDRICH公司(分析纯);磷酸(色谱纯),购自天津科密欧化学试剂有限公司;乙腈(色谱纯),购自TEDIA公司;Amberlite XAD-7HP型大孔吸附树脂,购自SIGMA-ALDRICH公司。
1.2仪器MDF-U5386S型超低温冰箱(SANYO公司);LGJ-10型真空冷冻干燥机(北京松源华兴科技发展有限公司);DZF-6050型真空干燥箱(上海精宏实验设备有限公司);AB204-S型分析天平(Mettler Toledo公司);5810R型高速冷冻离心机(Eppendorf公司);Thermo Mixer C型恒温混匀仪(Thermo公司);UV2401PC型紫外可见光分光光度计(SHIMADZU公司);1260 Infinity型高效液相色谱仪(Agilent公司)。
2 方法
2.1样品预处理按照文献[8]所述方法,选取除茎叶的黑枸杞干果,冷冻干燥12 h;粉碎,过筛(150 μm),-20℃密封避光保藏;使用时取出,真空干燥1 h,得黑枸杞干果粉末。使用1%甲酸,70℃水浴避光静置提取得提取液。
2.2萃取除杂工艺取适量提取液注入分液漏斗,加入3倍体积水充分摇匀混合,饱和过夜的萃取溶剂与之充分混合,避光萃取12 h,弃去萃取溶剂层,收集、合并水层并浓缩,即得黑枸杞花色苷萃取纯化液。
2.3萃取除杂工艺优化
2.3.1萃取除杂溶剂种类考察 分别用石油醚和乙酸乙酯避光萃取12 h,收集有机相层进行紫外-可见光全波长扫描(190~800 nm)。
2.3.2萃取次数考察 用乙酸乙酯避光萃取4次,分别收集水层和乙酸乙酯层,取水层与新鲜的乙酸乙酯混合,进行下1次萃取,取乙酸乙酯层进行紫外-可见光全波长扫描(190~800 nm)。
2.4大孔吸附树脂纯化工艺取适量、一定浓度的黑枸杞花色苷萃取液,在室温条件下,以一定的流速上样Amberlite XAD-7HP型大孔吸附树脂柱(柱径×柱长:1.0 cm × 15.0 cm),收集流出液;再使用适量的1%甲酸,以1 mL·min-1的流速充分洗涤树脂柱,收集洗涤液;然后,以含1%甲酸的一定浓度的乙醇(V/V)为洗脱剂,以1 mL·min-1的流速洗脱树脂柱,直至洗脱液呈无色,收集洗脱液。
2.5大孔吸附树脂分离工艺优化
2.5.1上样浓度 取药材浓度为20、40、100、200 g·L-1的黑枸杞花色苷萃取液,以1 mL·min-1的流速上样大孔吸附树脂柱10 mL,每个柱床体积(bed volume,BV,10 mL)收集1次流出液,测定流出液中的总花色苷含量,以流出液中累积总花色苷含量达到上样样品总花色苷含量的10%,作为泄漏临界点而停止上样。
2.5.2上样流速 选择上样药材浓度为200 g·L-1,分别以0.5、1、2 mL·min-1的流速上样大孔吸附树脂柱,每0.5个 BV 收集1次流出液,测定其中的总花色苷含量,直到出现泄漏临界点时停止上样。
2.5.3洗涤液用量 选择上样药材浓度为200 g·L-1,以1 mL·min-1的流速上样大孔吸附树脂柱30 mL。以1%甲酸溶液作为洗涤液,按1 mL·min-1的流速洗涤大孔吸附树脂柱,每个BV收1次洗涤液,采用苯酚硫酸法测定其中的总糖含量。
2.5.4洗脱剂种类 采用“2.5.3”所述条件上样大孔吸附树脂柱,再使用1%甲酸溶液洗涤大孔吸附树脂柱10个BV,将杂质除去后。分别采用含1%甲酸的70%甲醇、70%乙醇和70%丙酮(V/V),以 1 mL·min-1的流速洗脱树脂柱,直至洗脱液呈无色,每0.5个BV收集1次洗脱液,测定洗脱液中的总花色苷含量,计算解吸率。
2.5.5洗脱剂浓度 分别采用含1%甲酸的30%、50%、70%、90 %乙醇(V/V),以 1 mL·min-1的流速洗脱大孔吸附树脂柱,直至洗脱液呈无色,每0.5个BV 收集1次洗脱液,计算解吸率。
2.5.6洗脱剂pH 分别以含8%甲酸的70%乙醇(pH=2),含1%甲酸的70%乙醇(pH=3),含0.05%甲酸的70%乙醇(pH=4)和70%乙醇(pH=5)作为洗脱剂(V/V),以 1 mL·min-1的流速洗脱大孔吸附树脂柱,直至洗脱液呈无色,每0.5个BV 收集1次洗脱液,计算解吸率(n=3)。
2.5.7洗脱流速 以70%乙醇(V/V)作为洗脱剂,分别采用0.5、1、2、4 mL·min-1的流速洗脱大孔吸附树脂柱,直至洗脱液呈无色,每0.5个BV 收集1次洗脱液,计算解吸率(n=3)。
2.6总花色苷含量测定方法参考文献[8],采用pH示差法测定提取纯化样品中的总花色苷含量。具体方法为:吸取0.2 mL样品溶液,分别加入到3.8 mL氯化钾溶液(0.025 mol·L-1,pH 1.0)与3.8 mL醋酸钠缓冲液(0.4 mol·L-1,pH 4.5)中,于室温环境下避光孵育1 h,获得pH 1.0和pH 4.5供试品溶液。分别于530 nm和700 nm测定2种供试品溶液的吸光值,并按照以下经验公式计算总花色苷(total anthocyanins content,TAC)含量:TAC (mg/100 g DW)=(A×MW×DF×103/ε×1) ×V×100/m。上述公式中,A(吸光值计算结果)=(A530 nm-A700 nm)pH 1.0-(A530 nm-A700 nm)pH 4.5;MW(分子量)=449.2 g·mol-1;DF(稀释因子)=4.0 mL/0.2 mL=20;ε(摩尔消光系数)=26 900 L·mol-1cm-1;l(比色皿光径长度)=1 cm;DW:样品干重。
2.7提取纯化产物的高效液相色谱分析
2.7.1样品处理 分别将黑枸杞花色苷提取液、萃取液和大孔吸附树脂洗脱液浓缩至干,-80℃预冻12 h后,冷冻干燥至恒重。分别称取一定量的冻干浸膏或粉末,配制成1 g·L-1的供试品溶液,0.22 μm水相滤膜滤过,取续滤液,避光备用。
2.7.2色谱条件 Agilent Zorbax SB-C18色谱柱(4.6 mm× 250 mm,5 μm),流动相为0.5%磷酸溶液(A)-乙腈(B),梯度洗脱0~10 min,5%~12% B,10~30 min,12%~20% B,30~40 min,20%-50% B,40~45 min,50%~5% B,45~50 min,5% B,柱温为30 ℃,流速为1 mL·min-1,二极管阵列检测器(DAD)检测,检测波长为530 nm,进样量为10 μL。
2.8提取纯化产物的抗氧化活性评价
2.8.1DPPH自由基清除能力测定 取30 μL样品或作为空白对照的纯水,与2 mL DPPH·甲醇溶液充分混合,40℃黑暗中孵育40 min,得供试品溶液;使用紫外分光光度计于512 nm处测定各吸光值;采用下式计算其DPPH自由基清除率:DPPH自由基清除率=[Ac - (Ai - Aj)]/Ac×100%。式中,Ac:空白对照吸光值;Ai:供试品溶液吸光值;Aj:不添加DPPH·的供试品溶液吸光值。称取适量没食子酸(gallic acid,GA)于棕色量瓶中,用纯水配制成0.1、0.5、1、2、3、4、5 mmol·L-1的GA溶液。按上述方法分别测定各浓度GA稀释液的DPPH自由基清除率,绘制标准曲线,拟合回归方程,并将各样品的DPPH自由基清除率代入上述回归方程,即得各样品的GA当量浓度。
2.8.2ABTS阳离子自由基清除能力测定 配制完ABTS·+工作液;取15 μL样品或作为空白对照的甲醇,加入到4 mL ABTS·+工作液中,避光反应40 min;用分光光度计测定734 nm处各反应液的吸光值;采用下式计算ABTS阳离子自由基清除率:ABTS阳离子自由基清除率=(A0-As)/A0×100%,式中A0和AS分别为加入空白和样品后反应液的吸光度值。按“2.7.1”相同的方法制备标准曲线,拟合回归方程,并将各样品的ABTS阳离子自由基清除率代入上述回归方程,即得各样品的GA当量浓度。

3 结果
3.1萃取除杂工艺
3.1.1萃取除杂溶剂种类 由Fig 1可知,用于去除脂溶性杂质的石油醚或乙酸乙酯在花色苷的特征吸收波长(530 nm)附近都未见吸收峰,说明2种萃取剂对目标成分花色苷均无影响。同时,石油醚的萃取除杂效果较差,而乙酸乙酯除杂效果明显,因此,选择乙酸乙酯作为萃取除杂溶剂。
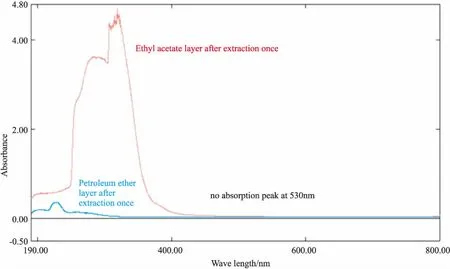
Fig 1 Full-wavelength scanning spectrum of petroleum ether and ethyl acetate phase
3.1.2萃取次数 如Fig 2所示,各次萃取后的乙酸乙酯层在花色苷特征吸收波长处均未见吸收峰。同时,随着乙酸乙酯萃取次数的增多,其位于紫外光区的吸收峰值逐渐降低,当连续萃取4次后,主要吸收峰的响应值已下降为第1次萃取的约1/10,继续萃取效果已不明显,由此选择萃取次数为4次。

Fig 2 Effect of ethyl acetate extraction times onfull-wavelength scanning spectrum
3.2大孔吸附树脂分离工艺
3.2.1上样浓度 Fig 3结果表明,在达到泄漏临界点时,虽然上样浓度200 g·L-1的解吸率(解吸率=浓缩至上样样品等体积洗脱液的总花色苷含量/上样样品的总花色苷含量×100%,以下同)略低于其他浓度,但吸附量(以总花色苷含量计,以下同)达到(455.17±17.42)mg·100 DW-1,明显高于其他上样浓度。为充分发挥大孔吸附树脂的纯化效率,增大每批次萃取液的上样量,故选择上样药材浓度为200 g·L-1。
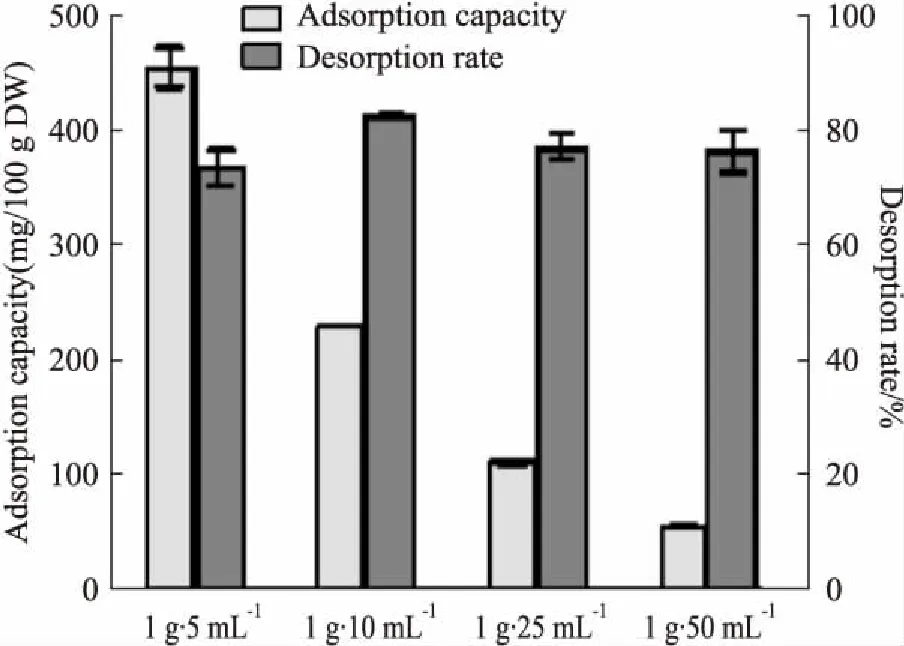
Fig 3 Influence of sample concentration on macroporous
3.2.2上样流速 Fig 4结果显示,流速2 mL·min-1的上样吸附量明显低于0.5 和1 mL·min-1,故不适用于上样。同时,虽然0.5 mL·min-1的吸附量比1 mL·min-1多约20%,但解吸率比后者少10%,说明上样量流速过低会增加树脂的死吸附,不仅损耗样品,而且不利于树脂再生,且0.5 mL·min-1的上样时间比1 mL·min-1时间多约1倍,综合考虑,选择上样流速为1 mL·min-1。此外,实验结果表明,当以1 mL·min-1的流速上样35 mL时,已接近泄漏临界点,为避免样品损失,故适当减小上样体积至30 mL。

Fig 4 Influence of flow rates of sample loading on macroporous
3.2.3洗涤液用量 Fig 5结果表明,当洗涤至第5个BV时,由分光光度计测得的总糖浓度已接近0,但直到第10个BV,洗涤液的苯酚硫酸反应才呈现完全的阴性,故选择洗涤剂用量为10个BV,即100 mL。

Fig 5 The Washing curve of macroporous adsorption resin
3.2.4洗脱剂种类 3种洗脱剂的解吸率依次为(67.78±8.94)%、(75.43±4.84)%、(61.65±2.05)%,即70%乙醇的解吸率最高。同时,乙醇相对于其他2种洗脱剂的毒性小,且容易去除,故选择乙醇溶液作为洗脱剂。
3.2.5洗脱剂浓度 4种浓度乙醇洗脱液的解吸率依次为(61.57±0.89)%、(59.96±0.46)%、(75.01±4.24)%、(50.62±5.90)%。由此可知,70%乙醇的解吸能力较强,故选择乙醇洗脱剂的浓度为70% 。
3.2.6洗脱剂pH 不同pH乙醇洗脱剂的解吸率依次为(77.09±0.99)%、(71.46±0.91)%、(73.95±6.28)%、(73.15±6.12)% ,彼此间的解吸率相差不大,差异无显著性。同时,考虑到甲酸存在一定毒性,故选择不含甲酸的70%乙醇作为洗脱剂。
3.2.7洗脱流速 不同洗脱流速的解吸率依次为(63.41±1.61)%、(75.79±0.51)%、(74.85±3.07)%、(73.20±1.53)% ,除流速0.5 mL·min-1的解吸率明显低于其他流速外,流速为1、2、4 mL·min-1的解吸率相差不大。同时,考虑到洗脱流速越快,虽然洗脱时间越短,但洗脱剂消耗量越大,如1 mL·min-1需要使用18个BV的洗脱液,而4 mL·min-1则需要使用30个BV的洗脱液,故选择1 mL·min-1作为洗脱流速,从而在保证洗脱效果的同时,减少洗脱剂的消耗。
3.3HPLC分析结果由Fig 6的HPLC谱图可知,相同质量浓度的黑枸杞花色苷的提取产物(A)、萃取产物(B)和大孔吸附树脂分离产物(C)在15~35 min内均出现7个色谱峰,且各峰的保留时间基本一致,提示经纯化后,黑枸杞花色苷提取液中的目标成分未发生改变或丢失。其次,经萃取后,各色谱峰峰面积的变化不大,但经大孔吸附树脂分离后,7个色谱峰的峰面积均明显增加,其中2个主成分峰(峰5和峰1)峰面积比萃取液中的分别增加了10.8倍和9.4倍,说明经大孔吸附树脂纯化后,花色苷类成分的纯度明显提高。

Fig 6 HPLC profiles of anthocyanin extracts and purified products
A:Extraction product(1 g·L-1); B:Extraction product(1 g·L-1); C:Macroporous adsorption resin separation product(1 g·L-1).
3.4提取纯化产物的抗氧化活性评价
3.4.1DPPH自由基清除能力测定 GA标准曲线的回归方程为Y(DPPH·清除率)=0.218X(GA当量浓度)+0.0627,R2= 0.992,线性范围为0.1~4.0 mmol·L-1。1 g·L-1黑枸杞花色苷提取产物、萃取产物和大孔吸附树脂分离产物的GA当量浓度依次为0.219、0.266、0.770 mmol·L-1。由此可见,纯化产物由DPPH自由基清除能力表征的抗氧化活性不断提高。
3.4.2ABTS阳离子自由基清除能力测定 结果表明,GA标准曲线的回归方程为Y(ABTS·+清除率)=0.3503X(GA当量浓度)+0.0068,R2=0.990,线性范围为0.01~0.5 mmol·L-1。1 g·L-1黑枸杞花色苷提取产物、萃取产物和大孔吸附树脂分离产物的GA当量浓度依次为0.013、0.017、0.472 mmol·L-1。由此可知,纯化产物由ABTS阳离子自由基清除能力表征的抗氧化活性不断增强,这一结果与“3.4.1”一致。
4 讨论
经萃取工艺和大孔吸附树脂分离工艺的优化,本文初步建立了黑枸杞花色苷的纯化工艺,即采用水饱和过夜3倍体积的乙酸乙酯萃取提取液4次,每次12 h;取30 mL药材浓度为200 g·L-1的萃取液,以1 mL·min-1的流速上样大孔吸附树脂柱,使用1%甲酸溶液洗涤树脂柱10个BV,采用70%乙醇(V/V)以1 mL·min-1的流速洗脱树脂柱,直至洗脱液呈无色,收集、合并和浓缩洗脱液,从而获得黑枸杞花色苷纯化产物。在此基础上,通过高效液相色谱分析和自由基清除率测定,分别从产物纯度和抗氧化活性的角度评价了纯化效果,结果表明,产物的纯度和抗氧化活性均明显提高。
萃取工艺的优化结果表明,乙酸乙酯的除杂效果明显优于石油醚,这应该与提取溶剂为1%甲酸,提取产物主要是水溶性成分,而石油醚是强亲脂性有机溶剂有关。同时,由萃取后萃取溶剂层全波长扫描结果与文献报道[9]可知,花色苷水提液中的亲脂性杂质主要是吸收波长在250-400 nm内的游离黄酮类化合物,这类化合物易溶于乙酸乙酯、氯仿、乙醚等中等极性有机溶剂。而目标成分花色苷属于黄酮苷类化合物,在苷化后水溶性增加,脂溶性降低,一般易溶于水,而难溶或不溶于乙酸乙酯、氯仿、乙醚等有机溶剂,不会受到乙酸乙酯萃取的影响,故在萃取工艺中选择乙酸乙酯作为萃取溶剂,并采用少量多次萃取的策略。
大孔吸附树脂法是目前常用的花色苷类成分纯化方法[10-11]。一方面,大孔吸附树脂对花色苷类物质具有良好的吸附作用,不仅吸附快,而且吸附量大;另一方面,在吸附后,通过简单水洗即能有效去除花色苷提取物中的糖类、无机盐类等水溶性杂质,且解吸效率高[12-13]。Amberlite XAD-7HP型大孔吸附树脂是一种以聚甲基丙烯酸酯为骨架的大孔吸附树脂,孔径一般为20~60目,比表面积大,化学稳定性高、机械强度好、耐高压和高温。且XAD-7HP 属于中等极性的吸附剂,相比其他柱层析,如凝胶排阻、硅胶吸附、离子交换树脂层析等,特别适合从天然植物中分离花色苷这样极性适中的多酚黄酮苷类化合物。因此,本文选择Amberlite XAD-7HP型大孔吸附树脂用于黑枸杞花色苷萃取液的纯化。经上样、洗涤和洗脱3个阶段不同工艺参数的优化,有效去除了萃取液中的糖类等亲水性杂质,纯化产物经冷冻干燥后,能够获得干燥疏松的粉末,且不易吸潮,便于后续的纯化和定量分析。同时,产物的纯度明显提高,2个主成分的HPLC色谱峰峰面积比萃取液中的增加了10.8倍和9.4倍。此外,产物的抗氧化活性也明显增加,DPPH自由基清除率和ABTS阳离子自由基清除率分别达到相同浓度萃取液的2.9倍和27.8倍。
综上所述,本研究建立的黑枸杞花色苷纯化工艺操作简便,技术路线合理,易于放大,明显提高了产物的纯度和抗氧化活性,从而为黑枸杞花色苷的抗氧化活性物质基础研究和产业化开发奠定了坚实的基础。
(致谢:衷心感谢药用菌与中药生物技术研究所的张弦老师在实验中给予的指导和帮助!)