利用胚胎实时观测技术预测早期胚胎的发育潜能
郑爱燕,孟庆霞,丁洁,蒲艳,廖桂芝,李红,王玮
(南京医科大学附属苏州医院,苏州市立医院生殖与遗传中心,苏州 215002)
随着囊胚培养技术的发展,通过囊胚培养可以选择更具生长发育潜能的胚胎,提高胚胎种植率。但是,延长胚胎在体外培养和发育的时间,不仅会延长治疗周期、增加治疗成本,还会增加体外培养过程中可能导致的胚胎表观遗传学的改变和其它潜在风险。因此,我们希望能找到一种预测早期胚胎发育潜能的新方法。
胚胎实时观测技术(Time-lapse)是一种瞬间曝光连续拍摄的成像技术,可以对胚胎进行动态监测。与传统的形态学评分比,不仅能够保证胚胎观察评估过程中培养环境的稳定,而且可以获得胚胎连续动态发育图,观测胚胎发育过程中的非正常发育行为,如多核、异常分裂、混乱分裂、逆分裂等,进而为选择高发育潜能胚胎提供更多参考信息。研究表明利用Time-lapse得到的早期胚胎发育分裂时间点和异常发育行为可以预测囊胚形成和种植[1-4],但是受培养体系和培养环境的影响,这些研究建立的模型并不适用于所有实验室。因此,我们亟需利用Time-lapse技术找出胚胎形态动力学图谱的特异参数,建立自己的Time-lapse预测模型。
本研究回顾性分析了2016年7月至2017年6月101例IVF Time-lapse周期,共687枚胚胎,其中532枚进行囊胚培养,分析了胚胎形态动力学图谱和异常发育行为对可用囊胚及优质囊胚形成的影响,试图利用Time-lapse寻找本中心培养体系和培养环境下预测早期胚胎发育潜能的指标。
资料与方法
一、研究对象
本中心2016年7月到2017年6月101例IVF Time-lapse周期,共687个胚胎,532枚胚胎进行囊胚培养,将这些养囊的胚胎根据发育速度和发育质量分为以下三组。A组:D3细胞数≥6,且胚胎碎片≤20%的胚胎,共385枚;B组:D3细胞数≥6,且胚胎碎片>20%的胚胎,共57枚;C组:D3细胞数<6的胚胎,共90枚。
二、研究方法
1.取卵受精:取卵后行常规IVF,精子浓度为5×106/ml,受精后4 h去除颗粒细胞。
2.胚胎培养:脱颗粒细胞的卵子放入 Embryoslide培养皿(Vitrolife,丹麦),置于Embryo Scope 时差培养箱(Vitrolife,丹麦)进行培养,培养液为Global Total(LifeGlobal,美国),培养箱环境:6.0% CO2,5.0% O2,37℃。设置拍摄间隔为10 min,连续拍摄6 d。
3.Time-lapse监测系统和胚胎评分:运用Viewer D图像分析软件,收集2PN 胚胎资料,记录每个胚胎的原核消失时间(tPNf)和2细胞、3细胞、4细胞、5细胞、8细胞的细胞分裂时间点(t2、t3、t4、t5、t8),同时观察胚胎发育异常行为,包括多核(Multi Nucleation,MN)、异常分裂(Abnormal Cleavage,AC)和逆分裂(Reverse Cleavage,RC)。本研究用以评价胚胎形态动力学的变量包括:发育至2细胞、3细胞、4细胞、5细胞和8细胞的时间(t2、t3、t4、t5和t8)、cc2(t3-t2)、cc3(t5-t3)、s2(t4-t3)和s3(t8-t5)。囊胚评分用Gardner评分体系[5],本中心的可用囊胚标准为3BC及以上级别胚胎;优质囊胚为3BB以上级别胚胎;非优质囊胚为不够优质囊胚标准的可用囊胚; 废弃胚胎为未长成可用囊胚的胚胎。
三、统计学分析
采用SPSS 16.0软件进行统计学分析,组间均数比较采用t检验,率的比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
一、D3不同发育速度和发育质量胚胎的囊胚形成
A组无论是可用囊胚形成率,还是优质囊胚形成率,均显著高于B组和C组(P均<0.05);B组的可用囊胚形成率显著高于C组(P<0.05),但是优质囊胚形成率在两组间无显著性差异(P>0.05)(表1)。
二、D3不同发育速度和不同发育质量胚胎的形态动力学指标和异常发育行为
对于A组的胚胎,可用囊胚的t5、cc2和cc3显著大于废弃胚胎(P<0.05),而t2、s2、s3、AC和RC
显著小于废弃胚胎(P<0.05),其余指标在两者间无显著性差异(P>0.05)(表2);进一步,在可用囊胚中,优质囊胚的t5、cc2、cc3显著大于非优质囊胚(P<0.05),s2、s3、AC和RC显著小于非优质囊胚(P<0.05),其余指标在两者间无显著性差异(P>0.05)(表3)。

表1 D3不同发育速度和发育质量胚胎的囊胚形成率[n(%)]
注:与其他两组比较,*P<0.05;与C组比较,#P<0.05

表2 A组不同质量胚胎的发育速度及异常行为发生率[h,(x-±s),n(%)]
注:与废弃胚胎组比较,*P<0.05。

表3 A组不同等级囊胚的发育速度及异常行为发生率[h,(x-±s),n(%)]
注:与非优囊胚组比较,*P<0.05
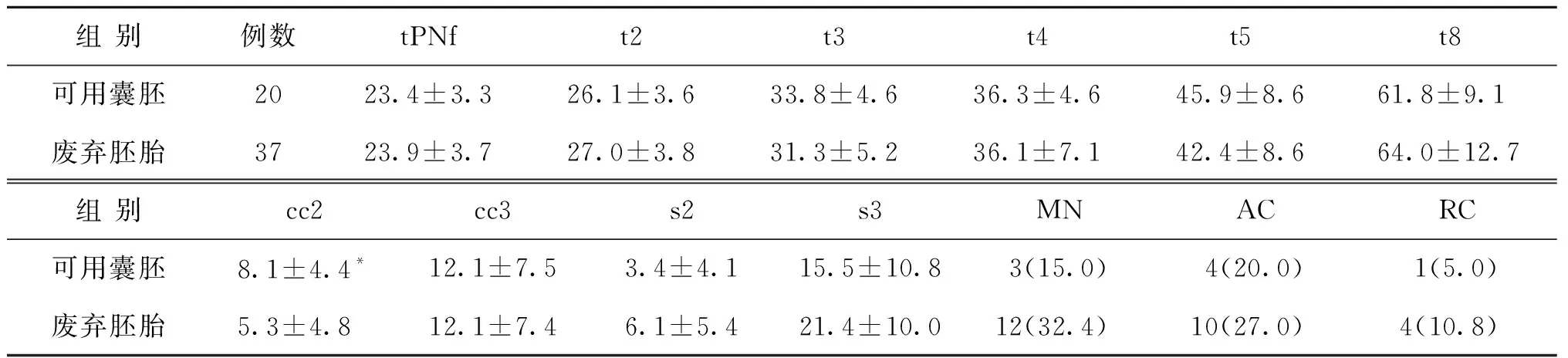
表4 B组不同质量胚胎的发育速度及异常行为发生率[h,(x-±s),n(%)]
注:与废弃胚胎组比较,*P<0.05
对于B组,可用囊胚的cc2显著大于废弃胚胎(P<0.05),其余指标在两组间均无显著性差异(P>0.05)(表4)。由于可用囊胚仅20枚,未对可用囊胚进一步分组比较。
对于C组,由于部分胚胎存在发育停滞,因此形态动力学时间点仅分析到t4。所有指标在两者间均无显著性差异(P>0.05)(表5)。同B组原因,也未对可用囊胚行进一步分组比较。

表5 C组不同质量胚胎的发育速度及异常行为发生率[h,(x-±s),n(%)]
讨 论
本研究将胚胎根据D3形态学进行分组,探讨不同类型D3胚胎的形态动力学和异常发育行为对囊胚形成的影响。结果显示,就形态动力学而言,A组中,t5、cc2、cc3、s2和s3不仅能够反映囊胚形成率,而且可以预测囊胚质量;在B组,仅cc2能提示囊胚形成;而在C组,并没找到预测囊胚形成的有效指标。Conaghan等[6]将D3胚胎的形态学评分结合cc2、cc3,更好地预测了囊胚形成结局。Meseguer等[2]建立了一套预测胚胎种植能力的体系,在这套体系中,t5是主要指标,然后依次是s2、cc2。而Desai等[7]则认为tPNf、t2、t4、t8、s1、s2、s3和cc3均是预测囊胚形成的指标。可以看出,目前预测囊胚形成的形态动力学指标并不一致,我们推测可能原因是:(1)不同实验室间培养液和培养环境存在差异。研究已证实胚胎培养液对Time-lapse数据存在影响[8];(2)本研究将D3胚胎根据发育速度和发育质量进行了分组,发现各组间差异比较大,而已有文献并未分组,因此可能研究的样本间存在差异。值得一提的是,尽管s2和s3在B组中无显著性差异,但是其值的变化趋势与A组存在一致性。分析原因可能是B组样本量不足所导致,如果将样本量扩大,s2和s3可能会出现显著性差异。
在异常分裂行为方面,A组中,AC和RC影响了囊胚形成与囊胚质量,而MN无此影响。这与以往大多数研究[9-11]结果一致。尽管如此,存在异常卵裂行为的胚胎,若发育至囊胚也具有一定种植能力,并可能出生健康婴儿[12]。原因考虑AC1和AC2出现在胚胎发育的不同阶段,在胚胎发育中排除异常细胞的阶段不同,故而对整个胚胎发育的影响也不同。关于MN的影响,有研究认为在胚胎发育的早期阶段,绝大多数MN胚胎具有自我修复能力,可以发育为正常二倍体囊胚[13]。另一些研究表明,两细胞阶段的MN会影响胚胎种植率和胎儿出生率[14]。我们认为这种不一致可能是收集MN的细胞阶段和细胞内存在MN数量的不同引起的。一个卵裂球中出现两个细胞核比出现多个细胞核染色体正常的概率更大[15]。本研究中,B组和C组的MN、AC和RC均不影响囊胚形成能力,但是由于这两组样本数量较少,要确定异常分裂行为是否对其囊胚形成存在影响,还有待进一步扩大样本量进行研究。
综上,本研究中,利用Time-lapse技术可以预测6细胞以上碎片少的形态学优质胚胎的发育潜能;而对于D3细胞数少或碎片多的形态学非优质胚胎,需扩大样本进一步研究。另外,本文仅探讨了Time-lapse系统中,胚胎形态动力学参数和异常发育行为对胚胎发育潜能的影响,关于这些指标是否影响胚胎种植率以及胚胎染色体核型,还需要进一步探讨。

