脑微出血对帕金森病认知功能的影响
龚艳 刘春风 王艳玲 李建平
帕金森病(Parkinson disease,PD)是中老年人常见的神经退行性疾病,认知障碍是PD最常见的非运动症状之一[1]。脑微出血(cerebral micro-bleeds,CMBs)是脑内微小血管病变所致的一种以微量血液外漏为特征的脑实质的亚临床损害[2]。研究表明CMBs患者均有不同程度的认知功能损害表现[3]。尽管脑血管病在PD患者中不常见,但PD合并有脑白质损害和腔隙性脑梗死的情况并非少见[4],且在PD痴呆患者中发现存在更多的白质高信号、腔隙性及CMBs的影像学改变[5]。进一步研究发现与无痴呆的PD患者相比,CMBs更常见于PD痴呆患者,因此推测CMBs可能对PD患者认知功能产生影响[6],但也有研究显示CBMs的出现对原发性PD患者的认知无明显影响[7],确切结论尚不统一。目前国内采用磁敏感加权成像(susceptibility weighted imaging,SWI)技术对CMBs与PD认知功能关系的研究较少。本研究采用SWI技术观察PD患者合并CMBs情况以及CMBs的分布部位,并采用蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)评估患者的认知功能,以探讨合并CMBs以及不同部位CMBs的PD患者的临床特点以及CMBs对PD患者认知功能的影响,为全面评估PD患者的认知功能提供新的理论依据。
1 对象和方法
1.1对象回顾性收集2016-09—2018-03以下两家医院神经内科收治的PD患者112例,其中来自苏州高新区人民医院68例,南京医科大学附属苏州医院44例,均符合英国脑库PD诊断标准[8]。排除标准:(1)脑血管病、脑炎、外伤、药物所致的帕金森综合征及帕金森叠加综合征,恶性肿瘤、癫痫、药物或酒精依赖,以及合并糖尿病、严重心肺疾病的患者;(2)患有房颤及正在服用抗凝、抗血小板药物的患者[9];(3)不能配合量表评估及SWI等检查者;(4) 病史资料不完整者。根据是否合并CMBs病灶将PD患者分为PD合并CMBs组和PD未合并CMBs组。根据CMBs的分布区域不同[10],将PD合并CMBs组进一步分为:(1)单纯性脑叶CMBs亚组:病灶仅分布在额叶、顶枕叶、颞叶、大脑皮层及皮层下脑白质区;(2)深部CMBs或脑叶及深部均存在CMBs(以下简称非单纯脑叶CMBs)亚组:病灶分布在基底节区、丘脑、胼胝体区的白质、内囊、外囊、脑干以及小脑,以及包括CMBs在脑叶和深部域均有分布的情况。
1.2方法
1.2.1 病史资料收集:收集患者一般资料,包括性别、年龄、受教育程度、合并症等。均于“关”期采用统一帕金森病评分量表(UPDRS)评价运动功能,采用Hoehn-Yahr(H-Y)进行分级评定。体位性低血压的定义:患者3 min内从仰卧位到站立位时,收缩压下降幅度≥20 mmHg(1 mmHg=0.133 kPa)或舒张压下降幅度≥10 mmHg。计算每例患者的左旋多巴等效剂量(LED)。采用MoCA(北京版) 对PD患者的认知功能以及各认知领域进行综合评价。比较各组间临床特征、UPDRS评分、H-Y分级、MoCA评分等差异,并对影响PD认知功能障碍的相关因素进行分析。
1.2.2 磁共振SWI检查:采用西门子1.5T MRI,进行T1加权成像(T1WI)、液体衰竭反转恢复成像(FLAIR)、T2加权成像(T2WI)、弥散加权成像(DWI)以及SWI扫描。CMBs定义为在SWI上呈圆形的信号缺失区,直径≤10 mm[11]。由磁共振室专业医师对CMBs的部位和数量进行盲法评定。脑白质病变(white matter hyperintensities,WMH)主要根据其在FLAIR序列上呈现高信号,根据Fazekas评分方法[12]分别计算侧脑室周围白质病(periventricular white matter hyperintensity,PWMH)和深部白质病变(deep white matter hyperintensity,DWPH)得分情况。腔隙性梗死病灶(lacunar infarcts,LI),定义为MRI图像中表现为T2W1呈高信号,T1W1呈低信号以及FLAIR呈等信号,直径3~15 mm的界限清楚的病灶[13]。
1.3统计学处理采用SPSS17.0版统计软件进行统计学分析,正态分布的计量资料以均数±标准差表示,采用两独立样本的t检验;非正态分布的计量资料以中位数(四分位数间距)表示,采用Mann-Whitney检验;计数资料采用χ2检验;采用非条件多因素Logistic回归分析影响PD认知障碍的相关因素。取α=0.05。
2 结果
2.1各组临床特征比较
2.1.1 是否合并CMBs组比较:PD患者中合并CMBs 31例(PD合并CMBs组),未合并CMBs 81例(PD未合并CMBs)组。与PD未合并CMBs组比较,PD合并CMBs组MoCA评分更低、服用LED更大,PWMH和DWMH 的Fazekas得分均更高(均P<0.05)。结果见表1。
2.1.2 不同部位CMBs亚组患者临床特征比较:31例PD合并CMBs患者中,单纯脑叶CMBs亚组10例,非单纯脑叶 CMBs亚组21例。与单纯脑叶CMBs组比较,非单纯脑叶CMBs组体位性低血压比例明显升高(P<0.05),MoCA评分升高(P<0.01)。具体结果见表2。
2.2不同部位CMBs亚组PD患者认知功能各项评分比较与单纯脑叶CMBs组比较,非单纯脑叶CMBs组PD患者的视空间与执行、语言方面的MoCA亚项评分升高(均P<0.05),而命名、注意、抽象、延迟回忆及定向评分无统计学变化(均P>0.05)。结果见表3。
2.3PD患者认知障碍影响因素分析将年龄、性别、教育年限、PD病程、UPDRS评分、H-Y分级、DWMH和DWMH 的Fazekas得分以及是否出现CMBs等作为自变量,分类变量均以亚变量形式带入方程,并以各变量的第1个亚变量作为参
照,进行Logistic单因素回归分析,选择单因素Logistic回归有统计学意义的因素再进行非条件Logistic多因素回归分析,结果显示CMBs和年龄是PD患者发生认知障碍的主要影响因素(表4)。
3 讨论
影像学上CMBs最常见于皮质-皮质下交界处、大脑半球深部灰质或白质、脑干及小脑等小血管及侧支循环丰富区域,其中分布于皮质-皮质下交界处的CMBs称为脑叶CMBs,被认为主要与脑淀粉样血管病(cerebral amyloid angiopathy,CAA)相关,然而分布于基底节、丘脑、脑干及小脑的CMBs称为深部CMBs,主要与高血压相关[14]。目前CMBs已被认为是导致认知障碍的重要因素之一,其研究领域主要以血管性认知障碍为主,阿尔茨海默病患者也存在CMBs的改变,在PD患者CMBs也并非少见,且与血管性PD有着不同的临床特征[7]。因此,CMBs被认为是血管性疾病与神经变性疾病潜在联系的重要环节,也是进一步深入研究神经变性疾病的一个重要方向[9]。
本研究结果显示合并CMBs的PD患者认知功能更差,并且分布在脑叶区域的CMBs对PD患者的视空间与执行和言语等认知领域的影响较大,这与脑叶部位CMBs参与了CAA的发病机制的观点相符。
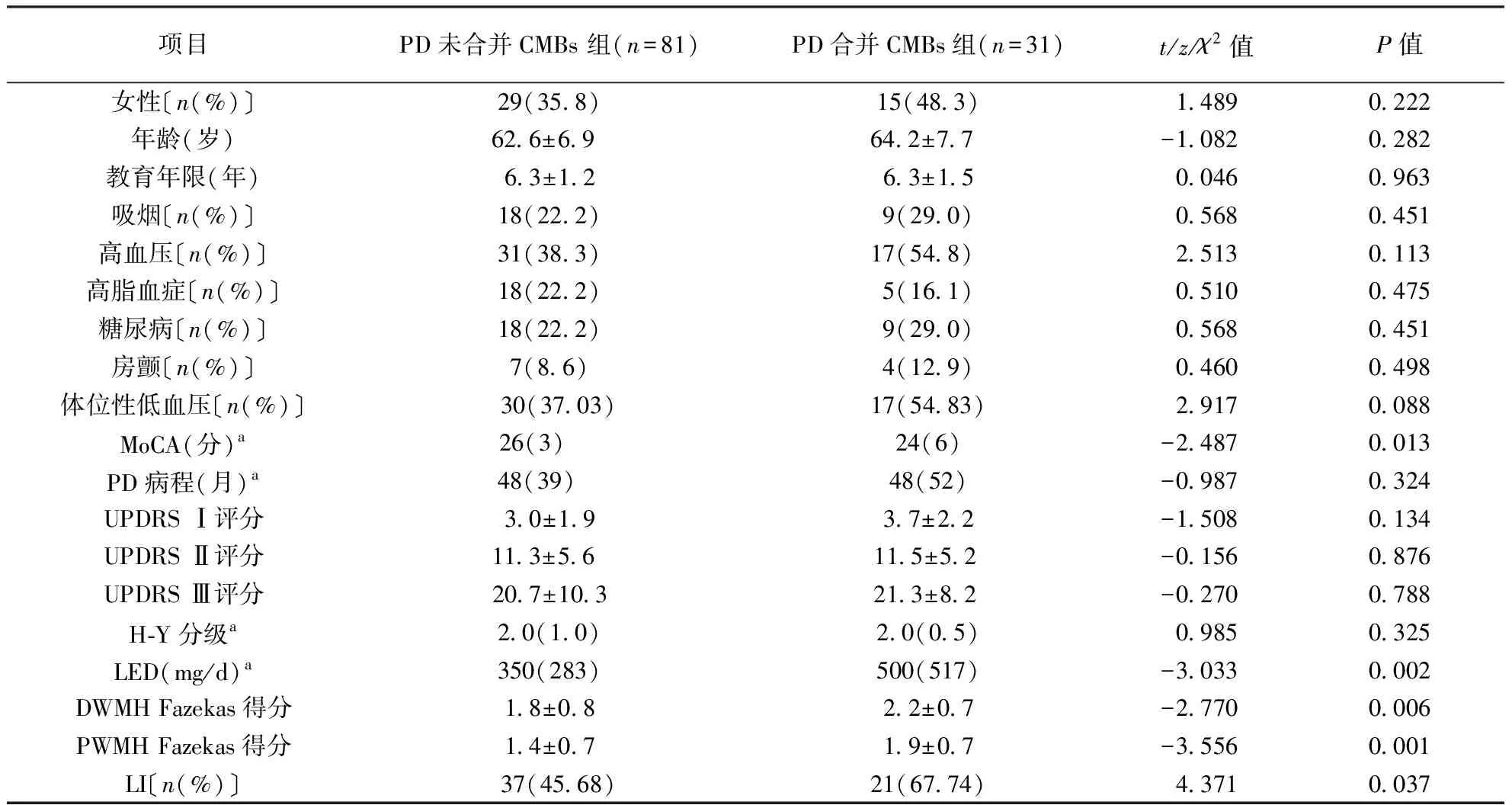
表1 两组PD患者临床特征比较
注:PD:帕金森病,CMBs:脑微出血;表2~4同。UPDRS:统一帕金森病评定量表,DWMH:深部白质高信号,PWMH:侧脑室周围白质高信号;表2、4同。MoCA:蒙特利尔认知评估量表(北京版),LED:左旋多巴等效剂量,LI:腔隙性脑梗死,a数据以中位数(四分位数间距)表示;表2同
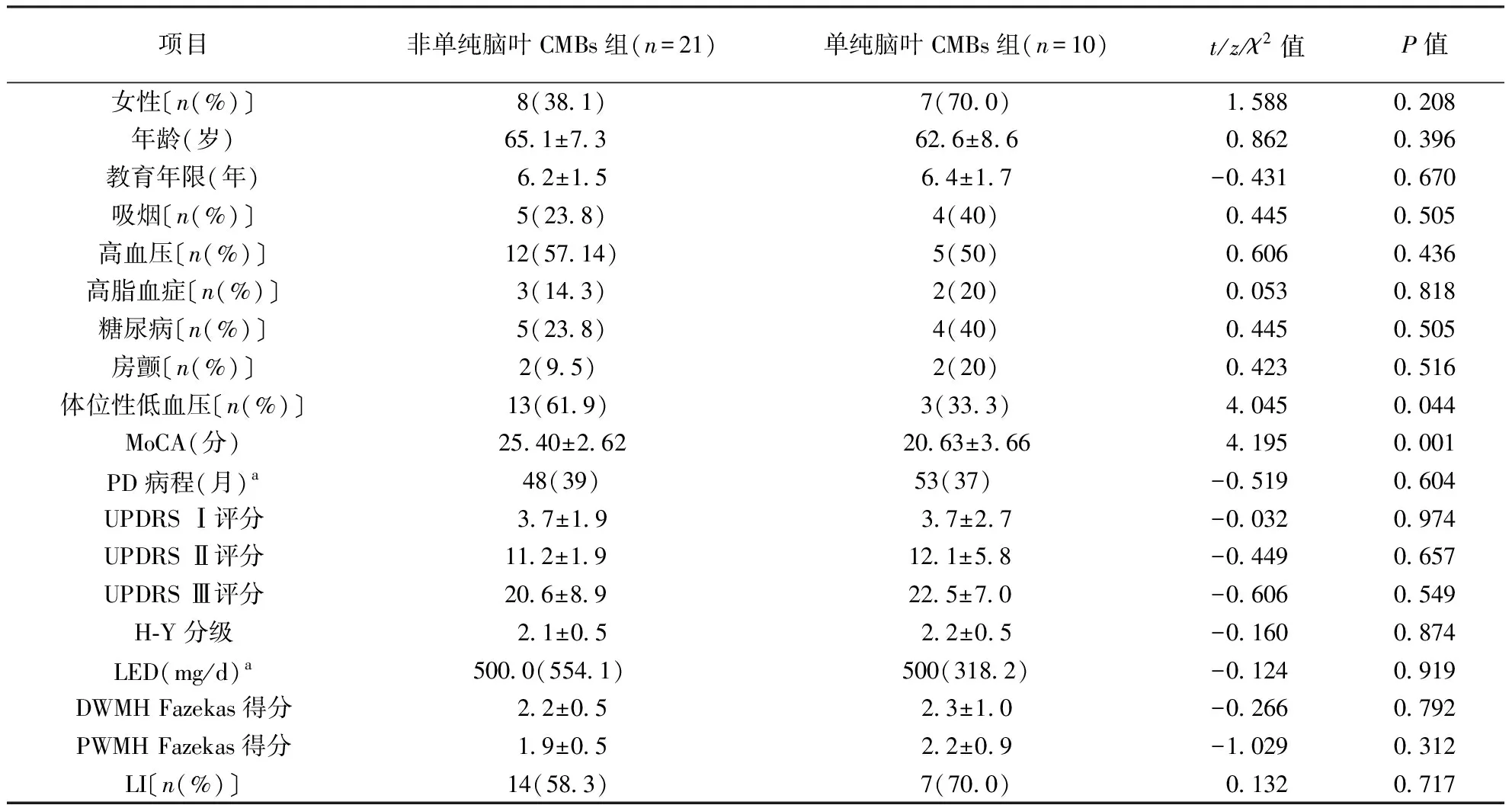
表2 PD合并CMBs患者不同部位CMBs亚组临床特征比较

表3 PD认知功能在CMBs的不同部位分布方面的异质性分析(±s)
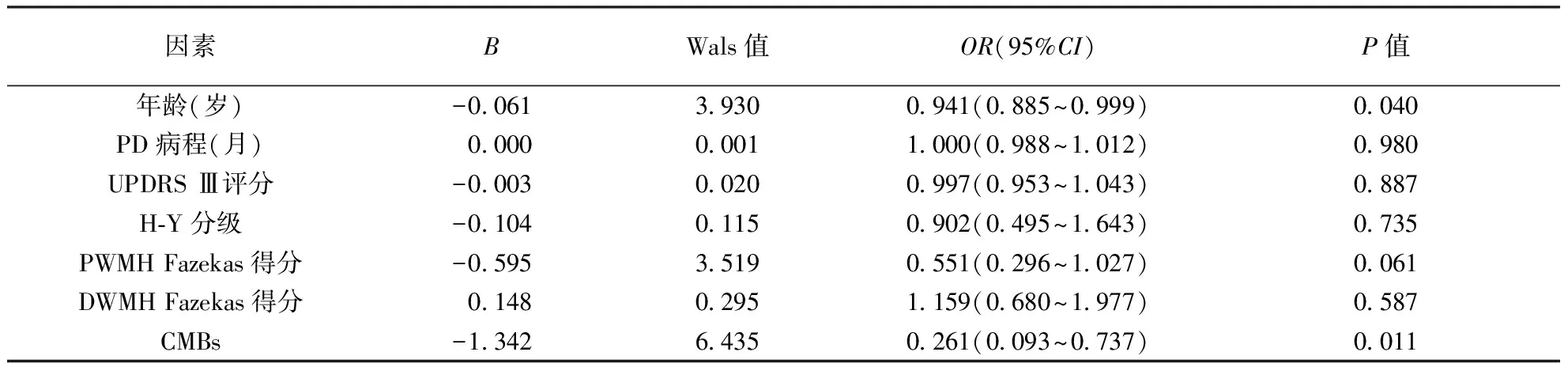
表4 非条件多因素Logistic回归分析PD患者认知障碍的影响因素
也有研究发现,与无痴呆的PD患者相比,PDD患者中出现CMBs更频繁,因此CMBs可能参与PD患者认知功能损害的发生机制[6]。但目前关于CMBs是如何导致PD患者认知功能损害的具体机制不明确。鉴于CMBs与白质损害具有共同的微小血管病的病理生理机制,因此二者常常具有紧密联系[15]。本研究中也发现合并CMBs的PD患者的白质病变更严重。通过MRI等相关影像技术发现CMBs 中白质结构的完整性被破坏[16],因此CMBs与白质损害类似,可能对PD患者的认知功能均具有重要的影响。但也有研究发现CMBs对PD患者认知功能的影响独立于白质损害[6],CMBs可能还有其他的机制对认知功能产生影响,其中CMBs可通过损害部位干扰皮质与皮质下的纤维连接,包括从前脑的基底投射到皮层的胆碱能纤维[17]。因此CMBs可能存在独特的机制对认知功能产生重要的影响。
目前普遍认为CMBs不同的病灶部位其形成的机制也不同,病灶部位能够反映不同的病理变化。有研究结果显示不同部位的CMBs与PD认知功能损害的表现有所不同,其中额颞叶区的CMBs与全脑的认知功能、心理反应速度、注意力等认知领域有关[18]。本研究中,脑叶区CMBs的患者视空间和执行能力、语言能力受损更明显,也进一步支持这一论点。一项大型研究发现,脑叶区的CMBs患者认知受损仅体现在信息处理速度和执行能力的下降,且不依赖于年龄、高血压及WMH严重程度;深部区CMBs对认知功能的影响较小[3]。因此不同部位的的CMBs具有不同的特点,在临床工作需引起一定的关注。
目前CMBs 与PD患者认知功能的关系尚无统一定论,这可能与研究对象的年龄、种族等不同,以及采用的MRI技术水平不同(包括采用的MRI扫描序列及评估参数等不同)有关;其次,与认知评定工具不同有关,既往研究多采用简易精神状态量表(MMSE)[6,14]。本研究采用的MoCA量表相对精确性更高。大多数的研究结果仍显示CMBs与PD认知障碍具有联系。
综上所述, 本研究结果显示,合并CMBs的PD患者认知功能更差,对药物反应性越差,WMH和LI的程度越重,并且CMBs的分布区域不同,认知损害的领域及程度也有所不同。本研究从血管因素分析了PD患者认知功能障碍可能的发生机制,为临床全面评估PD患者认知障碍提供新的依据,为临床早期识别、早期干预以及预防帕金森病痴呆的发展提供方向。由于本研究属于回顾性、单中心的研究,未将LI、WMH等因素对PD患者认知功能影响进行综合分析,未对PD疾病本身与CMBs引起的认知障碍进行区分。因此,今后需结合影像学等方法进一步分析和比较PD疾病本身与CMBs引起的认知障碍的特点和差异,以深入认识和阐明CMBs与PD认知障碍之间的关系;同时,还需进行多中心的前瞻性研究和相关的基础实验来明确CMBs与认知功能之间的联系及其具体机制。

