脑深部电刺激术治疗肌阵挛肌张力障碍综合征三例并文献复习
李继平 张宇清 张晓华 王云鹏
肌阵挛肌张力障碍综合征(myoclonus dystonia syndrome,MDS)是一种少见的原发性的肌张力障碍叠加综合征[1],主要以肌阵挛和肌张力障碍为惟一或主要症状[2],药物治疗效果差。目前脑深部电刺激术(deep brain stimulation,DBS)被证实是治疗肌张力障碍疾病有效的治疗方式[3]。但由于MDS较少见,目前有关DBS治疗的病例报道较少,且最佳的手术靶点仍不是很清楚,国内尚未检索到相关报道。本研究采用DBS治疗3例MDS患者,对其疗效及随访结果进行观察,并结合文献进行复习。
1 对象和方法
1.1对象收集2011—2015年北京宣武医院功能神经外科诊治的3例MDS患者,均为男性,年龄为17~34岁,发病年龄11~24岁,病程6~18年。除例1患者未行基因检测外,另2例行基因检测结果均显示DYT1和DYT11双阳性。3例患者均存在明显的肌张力障碍性震颤,就诊前患者均接受药物治疗。3例患者具体临床表现见表1。
1.2方法
1.2.1 DBS治疗:3例患者均给予DBS治疗,均分两期完成。一期在局麻下植入颅内电极:采用美国Radionics公司的CRW立体定位系统,术前进行高场强头部MRI(Siemens 3.0 Tesla, Sonata, Germany)扫描,手术当天佩戴CRW头架行CT扫描,运用术中导航计划系统重建影像并计算靶点的坐标。

表1 3例MDS患者临床症状
注:MDS:肌阵挛肌张力障碍综合征;表2同
手术采用丘脑腹外侧中间核(ventra lintermediate nucleus,Vim)靶点,Vim定位在中线旁开14 mm,ACPC线上后连合前5 mm。术中采用尖端直径约20~30 μm的微电极,使用Alpha Omega(Alpha Omega Engineering, Nazareth, Israel)单针道微电极记录,自靶点上10 mm开始记录。同时做肌电图记录。靶点定位完成后植入DBS电极(使用美敦力3389电极),使用该电极进行宏刺激测出副作用阈值,必要时做微小调整达到最佳电极位置。术后第1天进行CT扫描确认电极位置。一期手术后,颅内电极连接体外刺激器进行预测试,若在试验期观察到症状减轻,则二期手术植入延长线和脉冲发生器。其中病例2先接受了双侧Vim-DBS术,术后30个月出现新发部位的严重肌张力障碍,在保留原有Vim-DBS基础上,行双侧苍白球内侧部(globus pallidus internus,GPi)-DBS术,GPi靶点定位在中线旁开20 mm,ACPC中点前2 mm,ACPC线下6 mm,采用双侧Vim+双侧Gpi联合刺激。
1.2.2 疗效评估及随访:采用UMRS(unified myoclonus rating scale)的第2部分(静止性肌阵挛严重程度)及第4部分(动作性肌阵挛严重程度)评估肌阵挛症状,采用Burke-Fahn-Marsden肌张力障碍量表(Burke-Fahn-Marsden dystonia rating scale,BFMDRS)的运动评分(the movement subscore)评估肌张力障碍的运动功能,BFMDRS的功能障碍评分(the disability subscore)评估功能损害和生活质量。分别于术前、术后3个月、末次随访进行评分,以量化评估DBS临床效果。
2 结果
术前,3例患者UMRS(第2+4部分)平均评分40分,BFMDRS运动障碍评分平均26分,BFMDRS功能障碍评分平均14.7分。在一期手术测试期间,3例患者症状明显减轻,测试时间7~12 d,平均10 d。患者均二期手术植入延长线和脉冲发生器,术后即开启刺激器,程控治疗。术后患者未再服用相关药物,无严重并发症,均顺利出院。DBS刺激参数在随访中根据患者情况进行调整,以达到对肌张力障碍和肌阵挛的最佳控制并避免副作用。
术后3个月,3例患者肌阵挛和肌张力障碍症状均较术前有明显改善:肌阵挛平均改善率为99.1%,肌张力障碍量表运动障碍评分平均改善率为87.7%,功能障碍评分平均改善率为80.9%。具体结果见表2。病例1在术后3年出现单侧电极断裂而更换颅内电极,并在术后5年出现电量耗竭而手术更换脉冲发生器;病例2术后30个月开始出现左上肢肌张力障碍,并逐渐加重累及双下肢,但原头颈部及右上肢症状仍能得到很好控制。此患者术后43个月BFMDRS运动评分42分,BFMDRS功能障碍19分,于术后第43个月接受双侧Gpi-DBS手术,采用双侧Vim+双侧Gpi联合刺激。3例患者最终术后随访分别为84、80、30个月,平均64.7个月,肌阵挛平均改善率为99.1%,肌张力障碍量表运动障碍评分平均改善率为85.3%,功能障碍评分平均改善率为78.8%。
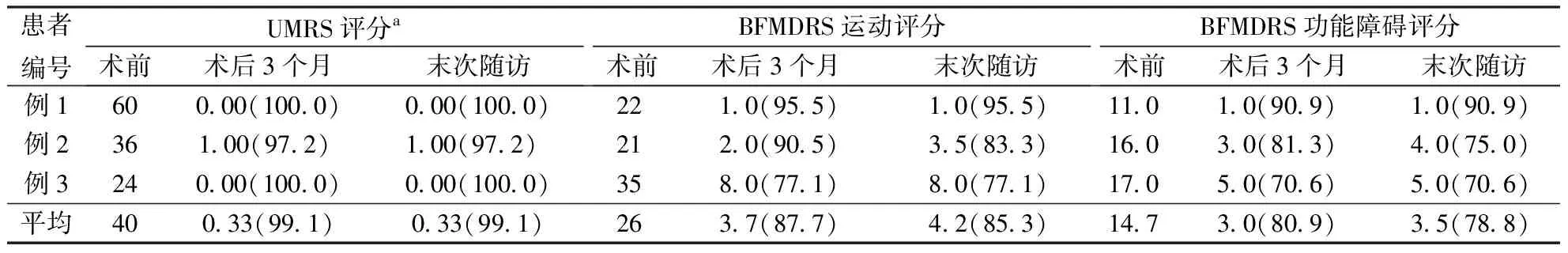
表2 3例MDS患者DBS手术前后临床疗效评分
注:DBS:脑深部电刺激术;UMRS:unified myoclonus rating scale;BFMDRS:Burke-Fahn-Marsden dystonia rating scale;a为UMRS量表第2+4部分评分;( )内为与术前比较的改善率(%)
3 讨论
MDS是常染色体显性遗传性运动障碍病,由位于7q21染色体上的SGCE基因变异导致[4]。多在儿童期或青少年早期发病,研究显示此病的发病年龄一般在10~20岁之间[5]。本组3例患者临床症状出现的年龄分别为11、12、24岁,其中1例于成年后发病。MDS表现为各种形式的皮层下肌阵挛和肌张力障碍。诊断标准[5]为:(1)肌阵挛伴有肌张力障碍;(2)20岁以前发病,但不绝对;(3)脑电图检查正常。诊断标准虽简明,但诊断不易。肌张力障碍是主动肌与拮抗肌收缩不协调或过度收缩引起的以肌张力异常的动作和姿势为特征的运动障碍,其症状的临床辨识度相对较高;肌阵挛是一种短暂、快速、闪电样的肌肉收缩,症状辨识度不高,原因在于:(1)未导致功能障碍的肌阵挛症状易被忽视;(2)肌阵挛可有节律,有时会被误以为是震颤。MDS的诊断难点在于对肌阵挛症状的观察与识别。本组3例患者以“肌张力障碍”的诊断收治入院,均是在入院后的病情观察中,发现肌阵挛的症状,并借助肌电图-脑电图偶联技术进行鉴别,以及进行基因检测,最终明确诊断MDS。MDS最常见的临床表现是累及头、颈和上肢的肌阵挛,有时也会波及下肢;而肌张力障碍常表现为斜颈或书写痉挛。本组3例患者中,只有病例2最初就诊时具有相对典型的MDS临床表现,肌张力障碍以书写痉挛和斜颈并伴震颤为表现,同时合并累及上肢、颈部的肌阵挛;病例1情况少见,为累及躯干、下肢为主的肌阵挛,合并躯干的肌张力障碍性震颤;病例3表现为双上肢的肌阵挛,其肌张力障碍表现包含了多种成分:双上肢肌张力障碍性震颤,右上肢手足徐动,双下肢轻微的扭转痉挛,咽喉部构音障碍。在肌张力障碍的基础上叠加肌阵挛症状,往往可呈现出多样化的临床表现。本组3例患者临床表现各异,医生需要认真观察,透过复杂多样的临床症状,可看到MDS临床表现的本质是肌阵挛叠加肌张力障碍。
目前共有48例DBS治疗MDS的病例报道,绝大多数采用GPi为治疗靶点, 仅4例为Vim[10-13], 9例为GPi+Vim联合靶点[10,14]。Rughani等[15]分析了1966-01—2012-07的17篇文献共40例患者,手术治疗肌阵挛的总体改善率为72.6%,肌张力障碍为52.6%,DBS对于肌阵挛和肌张力障碍均有明显改善,但肌阵挛的疗效优于肌张力障碍;通过比较GPi与Vim两个靶点的DBS对MDS的疗效发现,两者在改善肌阵挛方面作用相当,但GPi刺激对肌张力障碍的改善较Vim刺激更有效。但由于Rughani等分析的Vim-DBS治疗病例数仅4例,其结论尚不足以令人信服。Gruber等[10]观察了10例MDS患者,其中8例采用了双侧Vim-GPi双靶点DBS,全面比较了关机、Vim刺激、GPi刺激和Vim+GPi联合刺激的情况,研究发现:单侧Vim和GPi刺激治疗MDS的疗效相当,但Vim刺激引起的副反应多于GPi刺激。若肌张力障碍合并严重的肌阵挛,GPi+Vim双靶点联合刺激会让患者的收益更大。
总体来说,GPi被认为是DBS治疗肌张力障碍的首选靶点,而Vim是治疗各种震颤的首选靶点。此外,Vim也是治疗包括书写痉挛[16]、肌张力障碍性震颤[17]和DYT6型肌张力障碍[18]的有效手段。就诊主诉往往反映了引起功能障碍的主体症状,患者的主诉是进行靶点选择的一个重要出发点。选择靶点的基本原则:以肌阵挛、书写痉挛或肌张力障碍性震颤为主,选择Vim核团;以肌张力障碍占主导,选择GPi。根据上述基本原则,本组3例患者的治疗靶点均选择Vim,结果显示:(1)Vim-DBS对于肌阵挛症状疗效肯定,3例患者的肌阵挛改善率可达99.1%,有两例患者肌阵挛完全消失;(2)Vim靶点对书写痉挛、肌张力障碍性震颤症状同样疗效肯定;(3)但值得注意的是,本组中病例2患者在接受双侧 Vim-DBS术后,原有的头颈部及右上肢症状持续缓解,但从术后30个月开始出现左上肢的扭转痉挛并逐渐累及双下肢,且Vim-DBS对新发肌张力障碍症状改善欠佳。虽然有文献报道Vim-DBS刺激可造成肌张力障碍加重,但此患者为DYT1和DYT11双基因突变患者,再度出现的扭转痉挛症状出现于之前未累及的身体部位,这可能与疾病进展有关。DYT1与DYT11双阳性病例较少,目前手术治疗经验不多,仅检索到本中心的这两例[19],此类患者的临床症状如何演变,还有待进一步临床观察。不过此例患者经再次行双GPi-DBS手术,采用双侧Vim+GPi双核团刺激后症状得到明显改善,提示Vim-DBS可持续缓解肌阵挛症状,而GPi-DBS对于之前Vim-DBS治疗无效或治疗后再度出现肌张力障碍者是一种有效的治疗手段。
综上所述,本研究提示DBS是治疗MDS的有效方法,以肌阵挛、书写痉挛或肌张力障碍性震颤为主要症状者优先考虑Vim核团为靶点的DBS;若同时存在严重肌阵挛和肌张力障碍症状,且两项症状均导致功能障碍者,或许应考虑行Vim+GPi联合靶点的DBS植入术。

