微管蛋白、水通道蛋白4和K+通道蛋白4.1在大鼠脊髓损伤后不同时间的表达变化①
陈铁戈,郭永强,王明,张东亮,夏亚一,汪静,伍亚民,党跃修,张海鸿
1.兰州大学第二医院骨科,甘肃兰州市730030;2.甘肃省骨关节疾病重点实验室,甘肃兰州市730030;3.中国人民解放军陆军军医大学大坪医院野战外科研究所三室,创伤、烧伤与复合伤国家重点实验室,重庆市400042
脊髓损伤后恢复一直是医学界的难点与热点,脊髓水肿是脊髓继发性损伤非常重要的病理生理基础,水肿、血肿及血管的扩张使损伤后脊髓体积增加,脊髓内压增高,髓内微循环障碍,加重缺血缺氧,最终导致脊髓液化坏死。
水通道蛋白4(aquaporins-4,AQP4)与K+离子通道4.1(potassium ion channel protein-4.1,Kir4.1)主要表达于星形胶质细胞,参与损伤后水肿的形成与消散[1-3]。微管作为细胞骨架最重要的组成部分,见于所有真核细胞,其功能包括胞质内运输、细胞器定位、细胞形态与运动性的维持和改变[4]。有研究表明[5],应力作为刺激因子被细胞骨架感知,细胞骨架的改变可引起效应酶及细胞膜离子通透性发生变化。我们推测,微管作为细胞骨架重要的组成部分,可能参与脊髓损伤后AQP4和Kir4.1的表达及水肿的形成。
1 材料与方法
1.1 实验动物及分组
90只成年雌性Sprague-Dawley大鼠,体质量220~250 g,由兰州大学医学部动物中心提供。实验前2周饲养于实验室,自然昼夜采光,自由饮食饮水,室温25℃。大鼠饲养及实验过程均遵守实验动物管理及保护的有关规定。大鼠随机分为假手术组(n=30)和损伤组(n=60),损伤组再分为6 h、1 d、3 d、5 d、7 d五个亚组,每个亚组12只。实验大鼠依照实验动物相关福利与伦理原则进行处理。
1.2 主要试剂与仪器
RM2007 Allen打击器:美国新泽西州大学。CM1950冰冻切片机:LEICA公司。Finesse325石蜡切片机:THERMO公司。荧光显微镜:OLYMPUS公司。α-Tubulin:EP1332Y,ab52866,美国ABCAM公司。AQP4:BF-9104,美国AFFINIT公司。Kir4.1:12503-1-AP,美国PROTEINTECH公司。小鼠抗大鼠GAPDH单克隆抗体:美国PROTEINTECH公司。兔SP试剂盒(SP-9001)、小鼠SP试剂盒(SP-9002):北京中杉金桥生物技术公司。RIPA裂解液:碧云天公司。无毒环保苏木精-伊红(HE)染剂、BCA蛋白定量测试盒、PVDF膜:北京索莱宝科技公司。ECL发光液:美国MILLOPORE公司。
1.3 模型制作
动物常规术前准备,术前禁食12 h。1%戊巴比妥钠40 mg/kg腹腔注射麻醉,待角膜反射消失、持针器夹持尾端无反应表明麻醉成功。背部剃毛备皮,俯卧固定于手术台;碘伏术区皮肤消毒。两耳尖连线偏尾侧三横指处定位T10,以T10做3 cm背部正中切口,逐层分离筋膜及椎旁肌肉组织,暴露T9~T11椎体,咬除T9~T11椎板,仔细暴露T10脊髓,注意勿伤及硬脊膜。将实验组大鼠固定于Allen打击器,调整打击棒末端;使其对准T10脊髓,打击力度20 g×2.5 cm[6],打击后立即移开打击棒,打击棒与脊髓接触时间1 s。
打击成功表现为大鼠双下肢痉挛性抽搐后瘫软,尾巴左右摆动后下垂,被打击部位脊髓表现为充血水肿。
两组均用无菌生理盐水冲洗伤口,逐层缝合肌肉和皮肤,用碘伏棉球擦拭手术伤口后将大鼠在复温垫上复温1 h后放回笼中。术后腹腔注射青霉素16万U/d至术后3 d。按摩膀胱挤尿,每天3次至术后7 d。
1.4 脊髓含水量测定
造模后6 h、1 d、3 d、5 d、7 d,每个亚组各取3只大鼠,1%戊巴比妥钠40 mg/kg腹腔注射麻醉后活取脊髓,取脊髓打击部位上下各0.5 cm。取出后在微量天平上称取湿重,将称取湿重的脊髓用锡纸小心包好,放入恒温烤箱,温度调至80℃,烘烤48 h至恒重后取出[7],称取干重。

1.5 HE染色
造模后6 h、1 d、3 d、5 d、7 d,每个亚组各取3只大鼠,1%戊巴比妥钠40 mg/kg腹腔注射麻醉,0.01 mmol/PBS 250 ml和4%多聚甲醛200 ml经左心室快速灌注固定。取出损伤端脊髓组织(上下各0.5 cm)6~8 mm,4%多聚甲醛固定24 h,OCT包埋剂包埋,连续切片,厚度20 μm,HE染色,光镜下观察。
1.6 免疫组织化学染色
造模后6 h、1 d、3 d、5 d、7 d,每个亚组取3只大鼠,上述麻醉方法麻醉后,分别用0.01%mmol/PBS 250 ml和4%多聚甲醛250 ml经左心室灌注固定。以损伤点为中心,头端侧和尾端侧各延伸0.5 cm选取脊髓,取出后放入4%多聚甲醛,4℃冰箱中固定24 h,将组织修成合适大小后放入包埋盒进行脱水,脱水后石蜡包埋,用预冷冰切机进行切片,室温脱蜡、水化。二甲苯1号10 min,二甲苯2号8 min,二甲苯3号8 min,无水乙醇5 min,90%乙醇3 min,80%乙醇3 min,70%乙醇3 min。96~98℃柠檬酸钠热抗原修复,灭活内源酶活性后滴加山羊血清封闭液,室温封闭10 min;甩掉封闭液滴加一抗α-Tubulin(1∶200)、AQP4(1∶200)、Kir4.1(1∶200),4 ℃冰箱孵育过夜,室温复温,吸弃一抗,0.01 mol/L PBS清洗3次,双蒸水清洗3次;选取合适SP试剂盒滴加二抗,室温孵育10 min,PBS清洗3 min×3次,双蒸水清洗3次;滴加链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min,PBS清洗3 min×3次,双蒸水清洗3次;DAB溶液染色,显微镜下观察,合适后终止,苏木素复染后清洗,盐酸酒精分化,脱水,中性树胶封片后显微镜下观察。
1.7 Western blotting
各亚组另取大鼠3只,麻醉后活取脊髓,立即放入液氮备用。称量组织后以1∶10加入RIPA裂解液,玻璃研磨器研磨组织后超声碎细胞仪破碎细胞,4℃、1200 r/min离心30 min,收集上清液,加入蛋白上样缓冲液30 μl(1/3蛋白原液),100℃煮沸5 min。BCA试剂盒测定蛋白浓度,于-80℃冰箱保存。
行10%SDS-PAGE电泳,浓缩胶80 V/30 min,分离胶120 V/60 min,将蛋白质电转至甲醛浸透的PVDF膜上,5%脱脂奶粉室温封闭2 h,TBST洗涤,每次10 min,共3次;加兔抗大鼠α-Tubulin多克隆抗体 (1∶ 4000)、 AQP4 小 鼠 单 克 隆 抗 体 (1∶ 1000)、Kir4.1兔抗大鼠多克隆抗体(1∶500)、GAPDH小鼠抗大鼠单克隆抗体(1∶5000),4℃冰箱过夜孵育。TBST洗涤,每次10 min,共3次;加辣根过氧化物酶标记的山羊抗兔或抗小鼠lgG(1∶5000),室温下2 h;TBST洗膜10 min,共3遍;暗室曝光,滴加ECL发光液,X线胶片曝光,计算目的蛋白灰度值与内参GAPDH蛋白灰度值之比。
1.8 统计学分析
采用SPSS 22.0统计软件进行统计学分析。计量资料均用(xˉ±s)表示,多组间比较均采用方差分析。显著性水平α=0.05。
2 结果
2.1 一般情况
假手术组苏醒后即可活动,无后肢功能障碍,无血尿尿储留,无明显腹部胀气,排便困难。损伤组大鼠苏醒后精神状态较差,双后肢运动功能完全丧失,钳夹尾部无反应,出现血尿尿储留腹部肿胀等;部分大鼠出现血尿,每日按摩大鼠膀胱3次,协助其排尿。
2.2 脊髓含水量
与假手术组相比,损伤组损伤后6 h含水量即增加,3 d迅速增加,第5天达到高峰,且到第7天时略有下降(P<0.05)。见表1。
2.3 脊髓各组HE染色
假手术组脊髓组织无损伤坏死及出血,结构完整,灰质白质边界清晰,细胞排列有序,细胞核形态正常。
损伤组急性脊髓损伤后6 h,脊髓灰质和中央管开始出血,与白质边界不是很清晰,细胞间隙发生肿胀,神经元肿胀;损伤后1 d,脊髓灰质出血严重、结构紊乱,细胞间隙肿胀较6 h明显,神经元较6 h相比减少,白质也有少量出血;损伤后3 d,灰质白质坏死面积增大,细胞肿胀明显,神经元因肿胀加重发生细胞核固缩;损伤后5 d、7 d,脊髓灰白质出血减少,结构紊乱、坏死严重,有囊腔和空泡形成,神经元和细胞水肿明显,神经元数量明显减少。见图1。
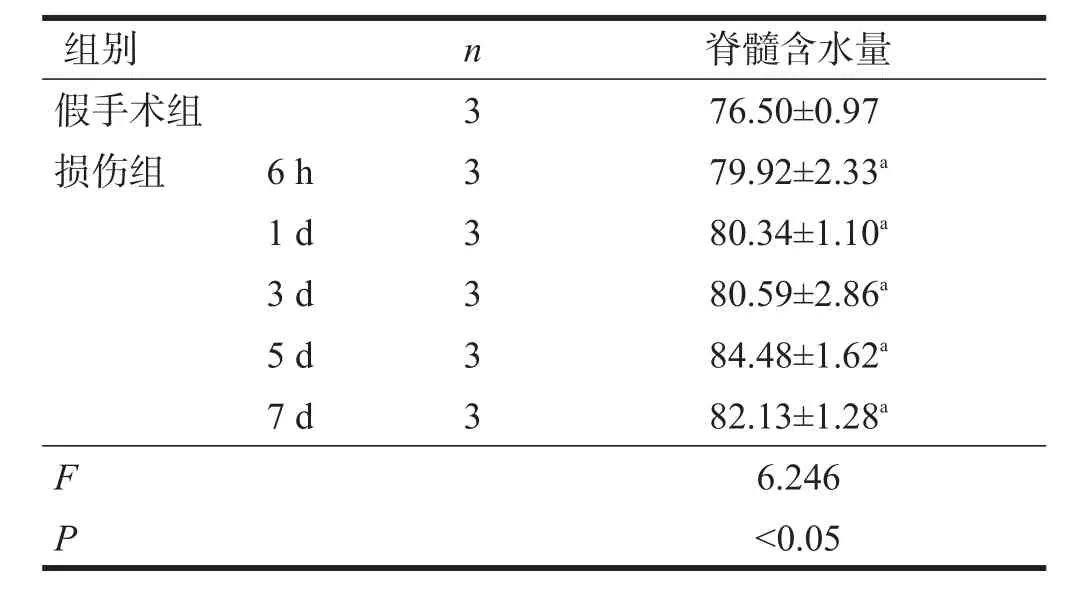
表1 各组脊髓含水量(%)
2.4 免疫组织化学染色和Western blotting
α-Tubulin在假手术组表达高于各损伤组,损伤组术后6 h与假手术组表达基本相同,1 d、3 d表达趋势相似,但术后5 d表达明显下降,到第7天时表达又有所回升。AQP4在假手术组脊髓组织中低度表达,主要分布于灰质和中央管,损伤组损伤后6 h表达下降,1 d后表达略有升高,3 d后表达显著增高,5 d时达到高峰,7 d略有下降,灰质较白质分布明显,多定位于细胞膜处。Kir4.1表达趋势与α-Tubulin相似,在假手术组表达高于各损伤组,术后6 h、1 d,Kir4.1表达略有下降,3 d表达下降较明显,5 d表达量最低,7 d表达量又有所升高。见图2~图4、表2。
Western blotting表达情况同免疫组化染色。见图5、表3。
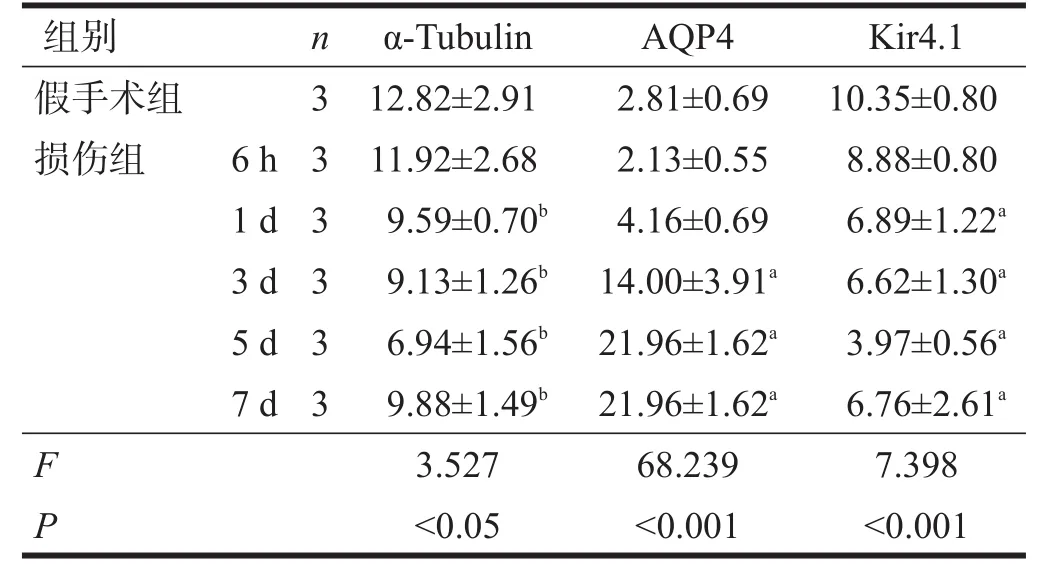
表2 各组α-Tubulin、AQP4和Kir4.1阳性百分比(%)

图1 各组脊髓HE染色(100×)

图2 各组α-Tubulin免疫组织化学染色(400×)

图3 各组AQP4免疫组织化学染色(400×)

图4 各组Kir4.1免疫组织化学染色(400×)

图5 各组Western blotting检测
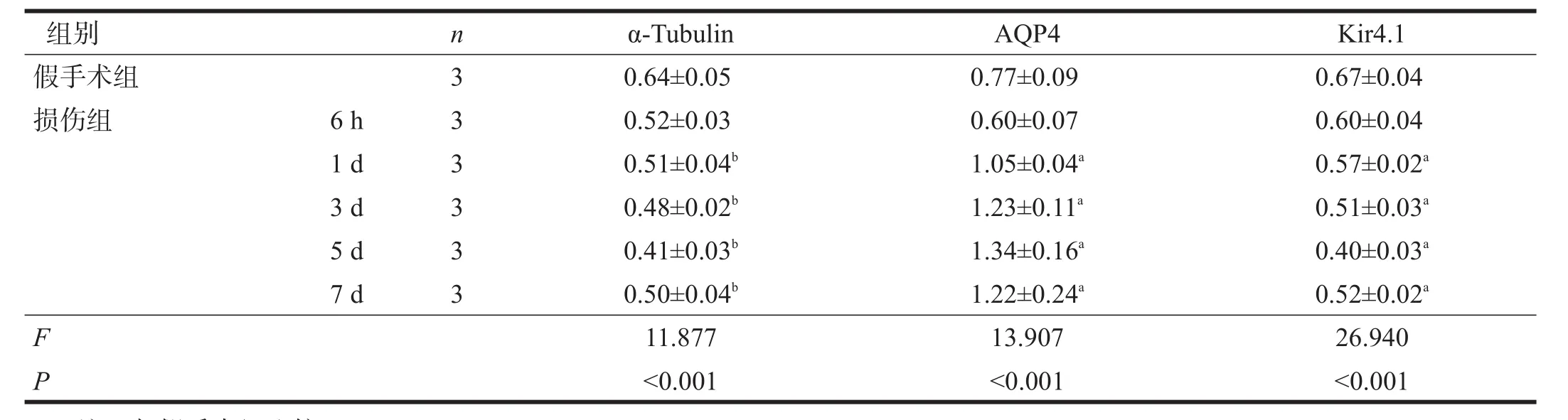
表3 各组α-Tubulin、AQP4和Kir4.1蛋白表达(Western blotting)
3 讨论
脊髓损伤分为原发性损伤和继发性损伤,继发性损伤包括出血、水肿、炎症及毒物的积累。其中,脊髓水肿是继发性损伤的基础;水肿、血肿及损伤部位血管的扩张使局部脊髓体积增加,但因硬脊膜的存在使脊髓无代偿空间,导致脊髓内压升高,髓内微循环障碍,缺血缺氧更加严重,最终导致损伤局部脊髓液化坏死[8-9]。
水通道蛋白是机体重要的水调节蛋白,且AQP4主要分布于哺乳动物中枢神经系统,首次由Hasegawa等[10]在大鼠肺脏中发现。AQP4在脊髓中主要分布于脊髓灰质、胶质界膜的星形胶质细胞以及由星形胶质终足包绕的毛细血管部[11]。在中枢神经系统中,Kir4.1与AQP4的表达存在相关性[12],主要表达于脊髓中的星形胶质细胞。在正常生理条件下,AQP4主要调节脑脊液的形成与吸收,Kir4.1通过对K+吸收影响渗透压,从而调节水的运输。二者在调节水分布方面具有偶联效应[13]。但二者在中枢神经损伤后的表达变化不同,有研究表明,脊髓损伤后在血源性水肿期AQP4表达会暂时下降,而随着时间推移,表达逐渐增高,原因在于血源性水肿的消散依赖AQP4,而细胞毒性水肿由AQP4导致[14]。而Oklinski等[14]、Olsen等[15]和Najafi等[16]发现,脊髓损伤后会引起Kir4.1的广泛性消失,最终导致脊髓水肿和脊髓空洞症(post traumatic syringomyelia,PST)的形成,而PST被认为是脊髓内流体的流入与流出之间不平衡导致的。
细胞骨架蛋白作为细胞的“生命之柱”,广泛存在于真核细胞,其主要由微管、微丝和中间丝组成。微管作为细胞骨架最重要的组成部分,主要由异二聚体α和β-Tubulin组成;涉及细胞形态变化,胞内物质运输及胞内蛋白的表达[17],同时还在组织内环境信息与能量传递中起重要作用[5]。Ruschel等[18-19]发现,脊髓损伤后α-Tubulin的表达下降,在应用微管解聚抑制剂后α-Tubulin表达增高,同时脊髓损伤大鼠后肢功能得以提高。Crunkhorn等[20]也认为稳定重塑微管可修复脊髓损伤。Zelinski等[21]和Akhmanova等[22]认为,外力可导致微管解聚,表达下降,且随着损伤加重表达降低。近年研究发现,应用微管解聚剂可调节AQP1和AQP2在大鼠肾脏主细胞胞膜上的定位[23-25],应用秋水仙素解聚微管后,AQP1、AQP2在肾脏细胞中过表达,但对于α-Tubulin与AQP4和Kir4.1之间的关系尚无研究报道。
本研究发现,α-Tubulin与AQP4和Kir4.1对大鼠脊髓损伤后水肿的形成三者相互关联。AQP4在大鼠脊髓损伤后6 h内表达稍降低,从1 d开始表达逐渐增高,到5 d达到顶峰,于7 d稍有下降,而α-Tubulin和Kir4.1二者表达相似,即在假手术组中高表达,损伤后6 h表达略有下降,且在5 d表达最低,7 d表达略有回升。可以看出α-Tubulin与Kir4.1表达呈正相关,与AQP4表达呈负相关,且与脊髓损伤后脊髓含水量的形成相反。我们推测外力损伤作为机械刺激因子导致微管细胞骨架解聚降解,而微管的解聚扰乱正常细胞内环境,导致胞内蛋白表达和包膜蛋白定位发生改变,从而引起内环境变化。
本研究证实,外力引起脊髓损伤时机械刺激因子导致微管解聚,作为胞内蛋白运输通道的微管断裂降解可能导致离子通道Kir4.1的表达下降和膜蛋白AQP4在胞膜的定位增加,从而导致水肿。
目前,针对脊髓损伤后水肿的治疗尚无切实有效的办法,甲泼尼龙因其严重的副作用现已被禁止用于脊髓损伤后的临床治疗[26]。我们推测,利用大鼠脊髓损伤后给予微管细胞骨架解聚抑制剂和微管聚合抑制剂,可进行进一步观察三者的表达变化关系,探究损伤后脊髓水肿的原因。
——水芹主要害虫识别与为害症状

