不同品种染色葡萄转色期花色苷积累的差异性研究
李惠清,杨航宇,陈为凯,王 宇,高晓彤,何 非,段长青,王 军*
(1.中国农业大学 食品科学与营养工程学院 葡萄与葡萄酒研究中心,北京 100083;2.农业部葡萄酒加工重点实验室,北京 100083)
花色苷是葡萄果实中重要的水溶性呈色多酚类物质,属于类黄酮化合物,是植物的次生代谢产物[1-2]。除赋予果实颜色外,还具有抗氧化、抗炎症、抗癌、预防糖尿病、软化心脑血管、改善动脉硬化等保健功能,已被应用于食品、保健品、化妆品、医药等行业[3-5]。一般而言,葡萄花色苷大多在有色品种的果皮中积累,通过浸渍过程进入葡萄酒。葡萄果皮花色苷的合成路径已被广泛研究,花色苷合成受到结构基因与调节基因的共同作用[6]。二磷酸尿苷(uridine diphosphate,UDP)-葡萄糖-类黄酮-3-O-葡萄糖基转移酶基因(UFGT)是葡萄花色苷合成的关键结构基因[7],类黄酮-3',5'-羟基化酶基因(F3'5'H)和类黄酮-3'-羟化酶基因(F3'H)的表达量主要影响葡萄果皮中花色苷的种类[8-9],前者表达量高则花翠素类、甲基花翠素类以及二甲花翠素类花色苷含量较高,后者则对应花青素类和甲基花青素类花色苷的合成[10]。此外,花色苷的合成同样受到转录因子的调控[11],其中研究最为广泛的是R2R3-MYB、bHLH(又称MYC)和WDR三个家族[12]。
然而在自然界中也存在一类葡萄,除在果皮中合成花色苷外,在果肉中也能合成花色苷,这种葡萄被称为染色葡萄[13]。Tintorera(西班牙名)常被称作紫北塞(Alicante Bouschet),是法国的古老染色品种,高产易种植,是歌海娜(Grenache)和Petit Bouschet的杂交后代,被广泛应用于红葡萄酒的混酿[14];Kolor是德国育成的稀有染色品种,2011年从新西兰引进中国,是黑比诺(Pinot Noir)与名称不详的染色品种的杂交后代,但目前对其研究较少[15];烟73是1996年由烟台张裕葡萄酒公司培育的优质染色品种[16],为玫瑰香与紫北塞的杂交后代[17],其果肉颜色呈深紫色[18]。继葡萄果皮之后,有关染色葡萄果肉中花色苷合成基因表达的相关研究指出,果肉中花色苷合成与UFGT和VvMybA1的组织特异性表达有关[19-20]。
葡萄酒的颜色是重要的感官指标,受葡萄中的花色苷含量和组成的影响[21]。染色品种与常见欧亚种酿酒葡萄相比,具有更高浓度的花色苷[13,19,22],因此常用于红葡萄酒的调色,可以赋予葡萄酒以更深的色泽,使酒体颜色呈现深红色。染色葡萄果肉中的花色苷组成与果皮相似,但在含量上存在较大差异,果皮中含量最多的是二甲花翠素类花色苷,而果肉中含量最丰富的则是甲基花青素类花色苷[13,17],其果皮和果肉中的花色苷组成和含量可能对红葡萄酒的颜色参数有显著影响。因此研究染色葡萄在成熟过程中花色苷的积累动态,不仅在染色葡萄的商业化栽培上具有指导意义,而且通过染色葡萄果皮和果肉花色苷在转色期积累的差异性研究,为染色葡萄果肉的转色机理提供参考。
本研究采集转色期3个不同品种的染色葡萄,利用离子阱高效液相色谱-质谱联用仪对其果皮和果肉中的花色苷进行检测,分析染色葡萄不同品种、不同组织在转色期的花色苷组成和含量,实验结果将为染色葡萄转色机理研究提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集

图1 转色5%(a)、50%(b)、100%(c)时期的染色葡萄样品Fig.1 Teinurier grape samples collected at veraison of 5%(a),50%(b)and 100%(c)
3个染色葡萄样品(烟73(Y)、Kolor(K)和Tintorera(T)):于2016年6~8月采自北京市海淀区中国农业大学上庄实验站(N40°08′12″,E116°10′45″)的智能玻璃温室中。葡萄植株定植于2012年,南北行向,株行距为2.5×4.0 m,水平棚架,每株留约80支新梢,每新梢留2个果穗。采样时期根据浆果果皮转色的程度(见图1),分别为5%转色(E-L 35,6月5日)、50%转色(E-L 36,7月6日)、100%转色(E-L 37,7月30日)。
1.1.2 化学试剂
氢氧化钠、邻苯二甲酸氢钾(均为分析纯):北京化工厂;酚酞(分析纯):天津市科密欧化学试剂有限公司;花色苷标准品、二甲花翠素-3-O-葡萄糖苷(malvidin-3-O-glucoside):美国Sigma公司;乙腈、甲酸、甲醇(均为色谱纯):美国Fisher公司。
1.2 仪器与设备
Agilent1100系列LC/MSDTrap-VL离子阱高效液相色谱-质谱(highperformanceliquid chromatography-massspectrometry,HPLC-MS)联用仪(配有G1379A真空溶剂脱气机,G1312B二元高压梯度泵,G1313A自动进样器,G1316A柱温箱以及G1315A二极管阵列检测器(diodearray detector,DAD)):美国Agilent公司;FA 2004电子分析天平:上海舜宇恒平科学仪器有限公司;PAL-1手持糖度计:日本Atago公司;PB-10 pH计:德国Sartorius公司;FD-1C-50冷冻干燥机:北京博医康实验仪器有限公司;KQ3200DE超声波清洗器:昆山市超声仪有限公司;GL-20G-Ⅱ离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 采样方法
每个品种随机采集100粒发育良好且无病虫伤害的浆果,重复3次。采后的样品迅速放入冰盒中低温转移到实验室中,用液氮进行速冻,在-40℃冰箱中保存[23]。
1.3.2 花色苷提取方法
根据本实验室已建立的方法提取样品果皮和果肉花色苷[17,24]。称取50~60 g完整葡萄果实,分离果肉和果皮并除去种子,分离后的果皮和果肉分装并用液氮速冻,研磨成粉后,冷冻干燥24 h,质量不变后收集得到的干粉。准确称取果皮或果肉的冻干粉0.100 g置于2 mL离心管中,加入1 mL体积分数为50%甲醇水溶液,避光条件下低温超声提取20 min,然后10 000 r/min离心5 min,上清液转移至5 mL离心管中,残渣再提取一次,合并提取得到的上清液。样品用0.22μm醋酸纤维素膜过滤后在-40℃冰箱保存待测。花色苷含量表不为mg/kg果实鲜质量。
1.3.3 花色苷测定方法
花色苷提取液的测定通过液相色谱-离子阱质谱联用仪检测,每个样品重复进样两次作为技术重复。
花色苷检测液相色谱条件:色谱柱为Kromasil C18(250mm×4.6 mm,5μm),柱温50℃。流动相为A、B相,均为乙腈、甲酸的水溶液,A相为6%乙腈、2%甲酸、92%水,B相为乙腈54%、甲酸2%、水44%。流动相洗脱梯度设置为:0~4 min,6%~10%B;4~12 min,10%~25%B;12~13 min,25%B;13~20 min,25%~40%B;20~35 min,40%~60%B;35~40 min,60%~100%B;40~45 min,100%~6%B。进样量30μL,检测流速为1mL/min,波长的范围为200~900nm,检测器检测波长为525 nm。质谱检测设定条件如下:电喷雾离子源(electrospray ionization,ESI)开启正离子模式,离子的扫描范围是100~1 500 m/z,雾化器压力30 psi;干燥器流速10 L/min;干燥气温度325℃[26]。
1.3.4 花色苷定性定量方法
花色苷的定性根据中国农业大学葡萄酒研究中心建立的“葡萄与葡萄酒花色苷指纹谱库”和保留时间相互比对进行鉴定。定量采用外标法,配制1~1 000 mg/L不同浓度的二甲花翠素-3-O-葡萄糖苷标准品溶液制作标准曲线,所有花色苷均以二甲花翠素-3-O-葡萄糖苷的含量作为标准计算,标准曲线分为高浓度与低浓度两个,公式分别为:峰面积(<300 0)=32.737×质量浓度(mg/L)+8.049 9,相关系数为0.997;峰面积(>300 0)=38.896×质量浓度(mg/L)-227.690,相关系数为0.997。
1.3.5 理化指标测定方法
百粒浆果质量及可溶性固形物测定:每重复随机取100粒浆果,用分析天平称质量;称质量后从每次重复的样品中随机选取10粒浆果,带皮挤出果汁,使用手持糖量仪测定果汁的可溶性固形物含量[24]。
pH和总酸的测定:每重复随机选取10粒浆果,带皮挤出果汁,将葡萄汁收集到离心管中,使用pH计直接测定果汁pH;pH测定结束后,果汁用于可滴定酸的测定,总酸(以酒石酸计)的测定采用指不剂法[25]。计算公式如下:
1.3.6 数据处理方法
平均值、标准差、标准曲线均在Microsoft Excel 2016和Microsoft Word 2016软件中进行;单因素方差分析、主成分分析(principal component analysis,PCA)使用SPSS 23.0统计软件完成。
2 结果与分析
2.1 理化指标的测定
葡萄果实在成熟过程中理化指标的测定可以监测其成熟度,为葡萄酒酿造提供符合要求的原料[27-28]。烟73、Kolor和Tintorera在转色过程中的理化指标如表1所不。

表1 3种染色葡萄的采样日期、百粒质量、可溶性固形物含量、可滴定酸含量和p HTable1 Sampling date,the mass of 100 grapes,soluble solid content,titratable acid content and pH of three kinds of teinturier grapes
由表1可知,温室中生长的Kolor在转色开始时百粒质量>100g,显著高于其余两个品种(P<0.05),其他转色时期的Kolor浆果质量都显著低于其余两个品种(P<0.05)。对比3个品种的染色葡萄,Tintorera的浆果质量在转色完成后最大,百粒质量达到190.85 g,其余两个品种在转色结束时的浆果百粒质量约为150~160 g。三个染色品种的可溶性固形物含量在整个转色期都呈现上升趋势,转色完成时达到15%以上;浆果转色50%~100%时糖分积累迅速,可溶性固形物含量增长1倍以上,说明转色期间浆果的糖分与花色苷大量累积的时期基本同步。染色葡萄浆果果汁的pH在转色期不断升高,而可滴定酸含量下降。转色期开始时,烟73可滴定酸含量(41.25 g/L)显著高于Kolor(36.59 g/L)和Tintorera(29.62 g/L)(P<0.05);转色结束时的可滴定酸含量下降至12.60~13.74 g/L,三个品种间无显著差异(P>0.05)。综上,烟73、Kolor和Tintorera的理化指标在转色过程呈现相似变化动态,即浆果质量增加,果汁可溶性固形物不断积累、可滴定酸含量下降、pH上升。
2.2 花色苷组成和含量分析[29]
2.2.1 花色苷定性分析
从3个品种的葡萄果皮和果肉中共检测到16种不同种类的单体花色苷(见表2),包括5种非酰基化单葡萄糖苷花色苷和11种酰基化单葡萄糖苷类花色苷。这些酰基化的单葡萄糖苷中的酰化取代基各不相同,分别为乙酰化单糖花色苷5种、咖啡酰化单糖花色苷1种、香豆酰化单糖花色苷5种,其中二甲花翠素-3-O-香豆酰葡萄糖苷分为顺式与反式两种。

表2 高效液相色谱-质谱联用检测3种染色葡萄果皮和果肉中的花色苷Table2 Anthocyanins in the peels and pulps of three kinds of teinturier grapes detected by HPLC-MS
Kolor、Tintorera和烟73转色100%时的果皮和果肉花色苷检测色谱图见图2。由图2可知,Kolor果肉中乃检测到11种花色苷(无6、8、11、12、14号峰),果皮中检测到15种花色苷(无12号峰),Tintorera和烟73的果肉中检测到12种花色苷(无11、12、13、14号峰),而果皮中乃检测到14种花色苷(无13、14号峰)。
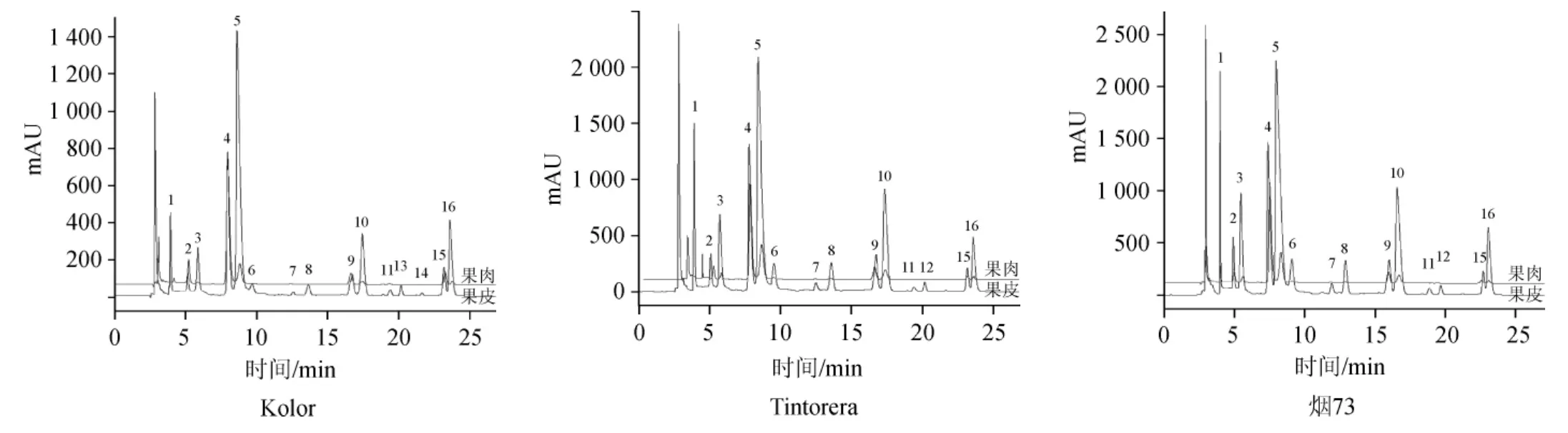
图2 3种染色葡萄果皮和果肉中花色苷高效液相色谱图Fig.2 HPLC chromatogram of anthocyanins in the peels and pulps of three kinds of teinturier grapes
2.2.2 花色苷总量分析

图3 3种染色葡萄果皮和果肉中不同转色期花色苷含量比较Fig.3 Comparison of anthocyanins contents in the peels and pulps of three kinds of teinturier grapes at different veraison
由图3可知,Tintorera果实中的花色苷总含量达到4 153.10 mg/kg;烟73果实中的总花色苷含量最高,为4 541.89 mg/kg;Kolor的花色苷含量低于其余两个染色品种,在转色100%的果实中,花色苷含量为2 543.42 mg/kg,仅为其他2个品种的50%~60%,从红葡萄酒增色角度来说,其潜在的增色效应低于其他2个品种。根据文献报道,转色期的染色葡萄与同时期的欧亚种酿酒葡萄赤霞珠、内比奥罗等相比(花色苷含量为300~700 mg/kg),其花色苷含量也远高于这些红色酿酒品种[30-31]。染色葡萄的花色苷积累主要集中在转色50%~转色100%两个时期之间,花色苷含量迅速增加。在转色50%以前,染色葡萄果肉中的花色苷含量显著高于果皮中的花色苷含量(P<0.05),约占总花色苷含量的85%。当到达转色100%时,果皮中花色苷的含量高于果肉,占浆果总花色苷含量的55%左右,说明染色葡萄果肉中的花色苷积累先于果皮,花色苷的积累动态在染色葡萄中具有组织特异性。
2.2.3 花色苷组成与含量分析

表3 3种染色葡萄转色期果皮与果肉中花色苷含量和总花色苷含量Table3 Anthocyanins and total anthocyanins content in the peels and pulps of three kinds of teinturier grapes at veraison mg/kg
烟73、Kolor和Tintorera三个品种的果皮和果肉中花色苷的分布与积累既存在共性,又表现出极大的差异性。由表3可知,转色期内3个染色葡萄的果肉中含量最多的是甲基花青素-3-O-葡萄糖苷,约占果肉中花色苷含量的1/3~1/2;果皮中含量组多的为二甲花翠素-3-O-葡萄糖苷,约占果皮中花色苷含量的1/3,与文献报道相同[13,32],且这两种花色苷伴随浆果的转色不断积累。花翠素-3-O-香豆萄糖苷乃出现在烟73和Kolor果皮中,但在其的果肉和Kolor浆果中并未检测到。二甲花翠素-3-O-咖啡酰葡萄糖苷在烟73果皮中从转色5%就开始积累,而其乃在Kolor和Tintorera转色100%的果皮中检测到。
由表4可知,按照花色苷分子B环取代的不同,转色期三个染色品种葡萄果皮中不同种类花色苷含量所占比例具有一致性,即二甲花翠素类花色苷(包括二甲基花翠素-3-O-葡萄糖苷及其乙酰化和香豆酰化的花色苷衍生物)含量最高,其含量占果皮中花色苷总量的52%以上;其次是甲基花青素类(包括甲基花青素-3-O-葡萄糖苷及其乙酰化和香豆酰化的花色苷衍生物),含量占果皮花色苷总含量的10%~23%。烟73转色5%果肉中花色苷组成比例与果皮相似,其转色50%葡萄的果肉中,二甲花翠素类与甲基花青素类花色苷的含量基本一致,均占47%左右。其余染色葡萄的果肉中,含量最多的是甲基花青素类,占果肉总花色苷含量的50%以上;其次是二甲花翠素类,与果皮中的花色苷组成有显著差异。说明在果皮与果肉中,氧甲基转移酶(oxymethyltransferases,OMTs)的表达可能具有组织特异性[19]。其余种类的花色苷含量在不同品种的果肉中存在差异,Kolor的果肉中花青素类花色苷的含量较多,而这类花色苷在另外两个品种的果肉中含量最低。在转色期的早期,Kolor果皮与果肉中的花色苷种类较少,但果肉中花翠素类花色苷从转色5%就开始积累,而这类花色苷在其他葡萄中的积累时期较晚。对比3个染色品种果皮和果肉中二甲花翠素类与甲基花翠素类花色苷的比例可以发现,在染色葡萄中,3'甲基取代比例明显低于3',5'位的二甲基取代,与前人研究相符[19]。

表4 3种染色葡萄果皮与果肉中各类花色苷比例Table4 Ratios of different kinds of anthocyanins in the skins and pulps of three kinds of teinturier grapes%
根据花色苷酰基化类型所占比例可知,染色葡萄果皮和果肉中存在的未酰化花色苷比例较高,大体在50%以上,尤其是在果肉中,未酰化花色苷占60%以上,且比例随转色过程呈上升趋势。果肉中的香豆酰化花色苷积累较早,其比例呈下降趋势,有趣的是,染色葡萄果肉中没有检测到咖啡酰化的花色苷。在果皮中,Kolor和Tintorera咖啡酰化的花色苷乃有在转色期的后期才开始积累,但比例较低;烟73中的咖啡酰化花色苷从转色期的初期就有积累,但在整个转色期比例呈逐渐下降趋势。三个染色葡萄中乙酰化花色苷的比例变化并不明显,但在转色开始的烟73果皮中含量较多,Tintorera果肉在这个时期没有检测到乙酰化花色苷。
按照花色苷B环羟基取代数量与位置可以分为两大类:3',4'取代花色苷(包括花青素类和甲基花翠素类花色苷);3',4',5'取代花色苷(包括花翠素类、甲基花翠素类和二甲花翠素类花色苷)。对这两类花色苷所占的比例进行分析,发现3种染色葡萄具有相似的规律,即果皮中3',4',5'取代的花色苷含量较多,占果皮中总花色苷70%以上;而除转色5%时期的烟73外,果肉中则是3',4'取代的花色苷含量占50%以上。有研究表明,B环的羟基取代数量对花色苷的最大吸收波长有一定影响,3',4'取代花色苷带来更多红色色调,而3',4',5'取代的花色苷会带来更多蓝紫色色调[17]。
2.2.4 主成分分析
为了更好地区分不同品种染色葡萄果皮和果肉中花色苷积累的差异,对3个染色品种转色期果皮和果肉中花色苷含量进行主成分分析,结果如图4所不。

图4 3种染色葡萄花色苷含量的主成分分析散点图(A)与载荷图(B)Fig.4 Principal component analysis scatter plot(A)and loading diagram(B)of anthocyanins contents in three kinds of teinturier grapes
主成分1(PC1)的贡献率为71.74%,主成分2(PC2)为13.99%,两个主成分共同解释了总方差的85.73%,能够很好地揭不转色过程中不同染色品种果皮和果肉花色苷组成的差异。由图4可知,除转色100%时期的样品外,3个品种在转色5%与转色50%两个时期的果皮和果肉全部被分到第三象限中(5-50),且聚集度较高,与转色100%的果皮和果肉中花色苷含量与组成差异较大。对3个品种转色100%的果皮和果肉进行分析,主成分1将烟73、Kolor和Tintorera的果肉和果皮分开,果皮位于x轴的负半轴,而果肉位于x轴的正半轴。利用主成分1和主成分2可以将所有的样品分成四类,其中果皮集中在第二象限,烟73和Tintorera的果肉被分到第一象限,第四象限中乃有Kolor的果皮。
主成分分析散点图和载荷图共同反映三个染色品种的果皮和果肉中各类花色苷的重要性。烟73和Tintorera无论是果皮还是果肉,含量丰富的花色苷种类比较相似,在主成分分析的散点图中的位置也相对接近,但Kolor果皮和果肉中花色苷含量与种类与这两个品种的差异较大。从载荷图可以看出,烟73和Tintorera的果皮中的花色苷主要来源于F3'5'H路径,包括花翠素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷,以及一些花青素类花色苷;而Kolor果皮中,各类花色苷的贡献率均较低,故在散点图中与其余两个品种不在同一个象限中,说明Kolor果皮中的花色苷含量与组成与烟73和Tintorera差异较为明显。Kolor、烟73和Tintorera果肉中甲基花翠素-3-O-香豆酰葡萄糖苷和二甲花翠素-3-O-顺式-香豆酰葡萄糖苷的贡献率较高。之外,Kolor果肉中其余种类的花色苷贡献率也较高。
3 结论
通过对Kolor、烟73和Tintorera三个染色品种转色期的理化指标和花色苷含量的测定,研究了不同品种染色葡萄花色苷组成与含量差异。染色葡萄在转色期的发育与大多数酿酒葡萄相似,即果实质量不断增加、糖分积累、酸含量下降和pH上升。在染色葡萄的果皮和果肉中共检测出16种单体花色苷,但在不同品种以及不同组织中存在差异,果皮中含量最高的是二甲花翠素-3-O-葡萄糖苷,果肉中则是甲基花青素-3-O-葡糖苷含量最多。Kolor浆果中花色苷含量较低,其果肉中的花翠素类花色苷的积累时期较早,且含量较高,但咖啡酰化的花色苷积累时期较晚,含量极少;果皮中则是F3'5'H路径合成的香豆酰化后的花色苷含量丰富。烟73和Tintorera的花色苷含量与组成较为相似,花色苷含量是Kolor的近1.5倍,其果皮中含量最丰富的是F3'5'H路径的花色苷,果肉中含量最多的则是甲基花青素-3-O-葡萄糖苷。由此推测,在染色葡萄果皮和果肉的花色苷合成路径中,相关结构基因的表达量可能存在较大的差异,甚至存在组织特异性表达的结构基因和转录因子。因此,对染色葡萄果肉的花色苷合成分子机理仍需要进一步研究。综上所述,染色葡萄花色苷含量高,在红葡萄酒的调色中具有很好的应用前景。

