ATRA通过ERK/MAPK通路调控AS兔心脏MLCK的表达
王 雪,余 沛,王 怡,周 青,汪 渊,朱华庆
动脉粥样硬化(atherosclerosis,AS)是一种由于脂质沉积于动脉管腔,阻碍血液的供应进而出现一系列症状的疾病,复杂性和慢性进行性是其最主要的特点,对人民健康危害甚大。肌球蛋白轻链激酶(myosin light chain kinase,MLCK)是一种钙调素依赖酶,通过磷酸化肌球蛋白轻链(myosin light chain,MLC)增强血管内皮的收缩及张力,进而增强血管内皮的通透性,导致脂质更加易于透过血管内皮并且附着在血管内皮,逐渐形成粥样斑块,血管管腔变窄[1]。全反式维甲酸(all-trans-retinoic acid,ATRA)是维生素 A 的一种衍生物,研究[2]显示ATRA可以改善内皮细胞凋亡、平滑肌细胞增殖、氧化应激、炎症浸润等多种作用。该研究通过喂养高脂饲料复制AS兔模型,提取心脏组织并且体外培养H9c2心肌细胞,研究ATRA是否通过细胞外信号调节激酶(ERK)/丝裂原活化蛋白激酶(MAPK)通路调控心脏中MLCK的表达,为进一步探究AS发病机制提供依据并且为临床治疗AS提供新靶点。
1 材料与方法
1.1主要材料与试剂普通雄性新西兰大白兔,体质量(1.8±0.2)kg,购自山东青岛康大集团;普通饲料购自安徽医科大学实验动物中心;H9c2细胞购自中国科学院上海细胞库;DMEM高糖培养基干粉购自美国Gibco公司;棕榈酸及ERK/MAPK选择性抑制剂PD98059购自美国Sigma公司;ATRA购自安徽医科大学临床药理研究所;胆固醇购自中国医药(集团)上海化学试剂公司(AR级);ERK、p-ERK、MLCK、GAPDH抗体购自美国Santa Cruz Biotechnology公司;HE染色试剂盒和BCA定量试剂盒均购自上海碧云天生物技术公司;Masson染色试剂盒购自南京建成生物工程研究所;免疫组化试剂盒购和二抗均购自北京中杉金桥公司。
1.2主要仪器与设备制冰机(AF100,意大利SCOTSMAN公司);酶标仪(Thermo MultiskanGO,美国Thermo-Fisher公司);石蜡切片机(YT-7C型,湖北省孝感市亚光医用电子技术有限公司);正置式生物显微镜(DM4000B,德国Leica公司);CO2培养箱(MCO-20AIC,日本Panasonic公司),电泳仪(DYY-11型,北京六一仪器厂);转移电泳槽(DYY-Ⅲ408);摇床(TS-1型,海门其林贝尔仪器制造有限公司)。
1.3方法
1.3.1模型的建立 普通级雄性新西兰大白兔共24只,通过10 d的适应性喂养后,将其随机分为3组。正常组用普通饲料喂养;模型组用普通饲料、1%胆固醇和5%猪油喂养;ATRA组在用普通饲料、1%胆固醇和5%猪油喂养的同时给予ATRA灌胃治疗5 mg/(kg·d),12周以后,所有动物全部处死。
1.3.2H9c2细胞的培养 复苏H9c2细胞,在37 ℃和5%CO2条件下用细胞瓶培养,当细胞数量达到80%左右,模型组、ATRA组及PD组给予棕榈酸(10 μmol/L)刺激,6 h后ATRA组给予ATRA(10 μmol/L);PD组给予PD98059(40 μmol/L),12 h后提取细胞蛋白进行Western blot分析。
1.3.3标本的制备 3%戊巴比妥将所有动物麻醉,腹部解剖,取出心脏,将用PBS漂洗好的心脏组织用10%福尔马林溶液固定,随后用石蜡进行包埋,切片后进行免疫组织化学染色、Masson染色及HE染色;剩余心脏组织放入-80 ℃备用。
1.3.4油红染色 采用油红O粉配制油红O工作液,将动脉壁纵向切开后整体放入油红O工作液液中浸泡3 min,随后用60%乙醇调色,苏木精用于复染,复染完成后盐酸酒精分化,自来水冲洗,保存在甲醛溶液中。
1.3.5HE染色 采用石蜡切片机切片,厚度为5 μm,切片脱蜡,梯度至水,苏木精染色,自来水冲洗,盐酸乙醇分化,伊红染色,自来水冲洗,脱水透明,中性树脂封片,镜下观察。
1.3.6Masson染色 采用石蜡切片机切片,厚度为5 μm,切片脱蜡,梯度至水,核染液染1 min,冲洗液冲洗,浆染液染40 s,冲洗液冲洗,分色液分色8 min,倾去勿洗,复染液复染5 min,无水乙醇冲洗,中性树脂封片,镜下观察。
1.3.7免疫组织化学法检测MLCK的表达 采用石蜡切片机切片,厚度为5 μm,切片脱蜡至水;枸橼酸缓冲液煮沸至95 ℃,将切片放入枸橼酸缓冲液煮沸15 min进行抗原修复,冷却到室温,滴加3% 过氧化氢去离子水孵育 10 min,TBS冲洗3遍;滴加一抗,室温孵育2 h或者4 ℃过夜,TBS 冲洗3遍; 滴加聚合物辅助剂,室温孵育10 min,TBS冲洗3遍;滴加二抗,室温孵育 15 min,TBS冲洗3遍,滴加DAB显色,自来水冲洗、苏木精复染、梯度脱水、中性树脂封片,镜下观察。
1.3.8Western blot 法检测 称取100 mg心脏组织,PBS洗去血渍,用滤纸将组织上残留的PBS吸干后,放进研磨器,加入1 ml裂解液,于冰上充分研磨成匀浆,研磨完成后,将匀浆吸入EP管中,-80 ℃、4 ℃中反复冻融3次后保存在-80 ℃中。将经12 h处理好的细胞用PBS洗3遍,加入200 μl裂解液,冰上裂解30 min,用细胞刮将细胞蛋白刮下,将蛋白液吸入EP管中。4 ℃、14 000 r/min离心30 min,弃去组织沉淀及细胞沉淀,吸取上清液,用BCA法测定蛋白浓度并用生理盐水配置成同体积同浓度蛋白液,加入蛋白上样缓冲液,混匀后煮沸变性,放于-80 ℃保存。配制SDS-PAGE凝胶,各组等量上样电泳,电泳完成后转移入PVDF膜。5%脱脂牛奶(TBST溶)室温封闭2 h后TBST摇床洗一遍,TBS洗一遍,进行一抗(GAPDH、ERK、p-ERK、MLCK)4 ℃ 孵育,一抗孵育完成后TBST摇床洗3遍,TBS洗一遍,于37 ℃二抗孵育2 h ,二抗孵育结束后,TBST摇床洗3遍,TBS洗一遍,于暗室滴加ECL发光剂,观察荧光结果,并覆盖X胶片显影。胶片用扫描仪扫描后用QuantityOne软件分析各条带的灰度值,以GAPDH为参照,计算ERK、p-ERK、MLCK的相对灰度值。
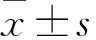
2 结果
2.1油红染色结果正常组动脉壁光滑并且无明显斑块,而模型组出现大量斑块,结果显示造模成功(图1)。
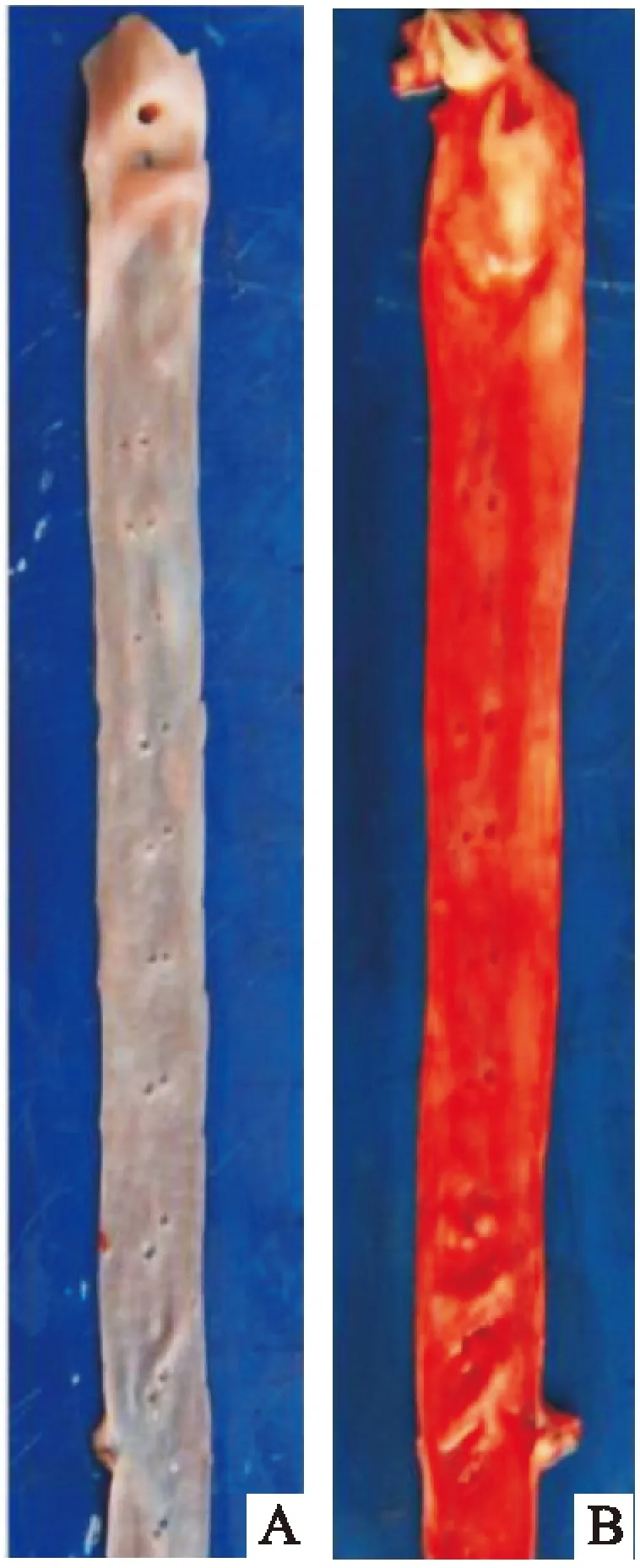
图1 动脉油红染色结果A:正常组;B:模型组
2.2HE染色结果正常组心肌组织排列规则有序,给予高脂饲料后,心肌组织排列出现严重紊乱且细胞核排列杂乱无章;给予ATRA后,相比模型组,心肌组织排列较整齐 (图2)。
2.3Masson染色结果正常组无明显胶原纤维堆积,模型组胶原纤维堆积程度升高,与模型组比较,ATRA组心肌胶原纤维堆积明显减少 (图3)。
2.4免疫组化结果模型组MLCK表达量明显高于正常组,ATRA组相对于模型组而言,MLCK表达量有所降低 (图4)。
2.5Westernblot结果与正常组比较,给予高脂饲料12周以后,MAPK通路相关蛋白ERK的磷酸化水平明显升高,给予ATAR以后,ERK的磷酸化程度降低(F=62.464)(图5)。与正常组比较,模型组MLCK表达增加,给予ATRA 以后,MLCK表达显著降低(F=246.168)(图6)。与正常组比较,给予棕榈酸刺激后,MLCK表达水平升高;与模型组比较,经ATRA给药及PD98059后,MLCK表达水平显著降低(F=134.130)(图7)。
3 讨论
随着人们生活水平的提高和饮食的多样化,AS引起的死亡已成为当今人口死亡的主要原因,并愈发趋向年轻化。目前AS最主要的治疗手段是靠他汀类和血管紧张素抑制剂类等药物缓解[3],但是AS发病机制的复杂性与多样性,他汀类和血管紧张素抑制剂尚不能起到有效的治疗,多数AS患者仍旧遭受疾病的折磨。近年来,相关领域研究热点多集中在动脉内皮,然而在相关的死亡调查中发现70%与心脏受损有关。心脏是人体中非常重要的一个器官,是人体中各个器官、组织的血流量的来源,其形态和功能的完整性对于机体进行正常的生命活动和维持正常的生理功能起着至关重要的作用。
AS极易引发多种心血管疾病如心绞痛、心力衰竭等从而降低心脏的顺应性;心脏缺血,影响心脏收缩功能,导致机体各组织和器官无法正常工作,最终导致死亡[4]。因此采取相应预防措施,减轻心脏受损很有必要。
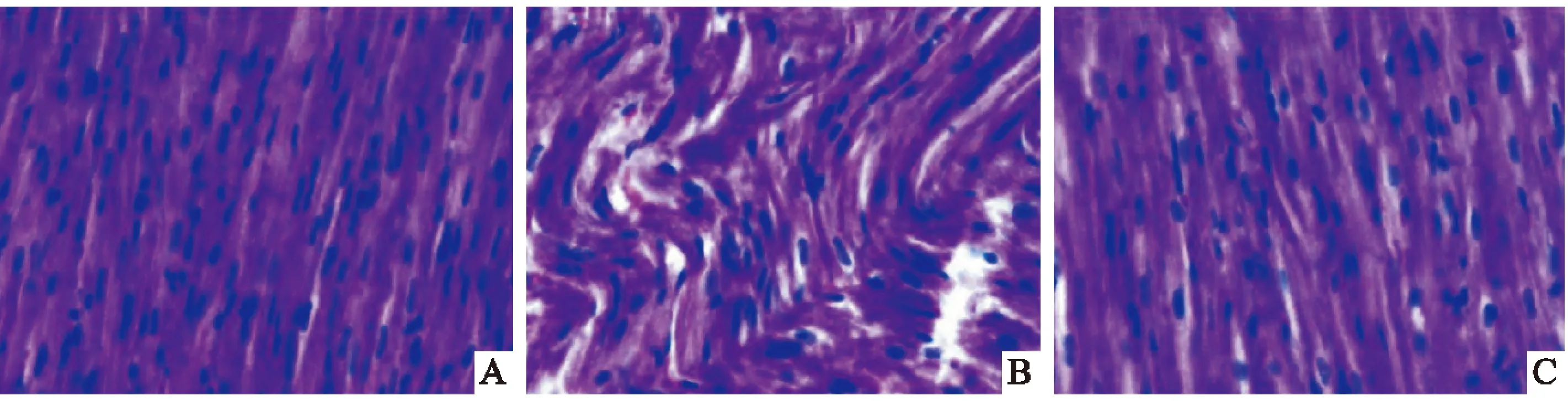
图2 各组兔心肌形态变化 HE×400A:正常组;B:模型组;C:ATRA组
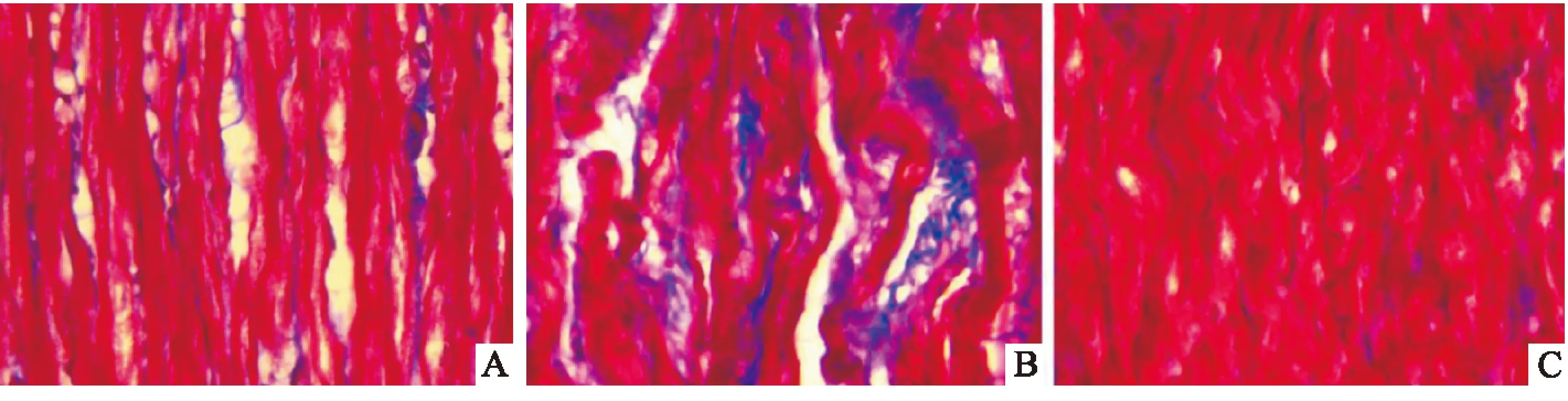
图3 各组兔心肌胶原纤维的变化 Masson×400A:正常组;B:模型组;C:ATRA组

图4 各组兔心肌的免疫组织化学染色 ×400A:正常组;B:模型组;C:ATRA组

图5 ATRA对MAPK 途径中ERK磷酸化的影响
A:正常组;B:模型组;C:ATRA组;与正常组比较:*P<0.05;与模型组比较:#P<0.05

图6 ATRA对MLCK蛋白表达的影响
A:正常组;B:模型组;C:ATRA组;与正常组比较:*P<0.05;与模型组比较:#P<0.05

图7 PD98059对MLCK蛋白表达的影响
A:正常组;B:模型组;C:ATRA组;D:PD组;与正常组比较:*P<0.05;与模型组比较:#P<0.05
MLCK是一种存在于哺乳动物中的丝氨酸/苏氨酸蛋白激酶,参与许多重要的生命活动,主要由MLCK1基因和MLCK2基因编码[5],MLCK2因编码产物大多分布在横纹肌细胞而MLCK1基因编码产物在许多组织如骨骼肌、心肌中均表达[6]。MLCK主要通过磷酸化平滑肌和非平滑肌的肌球蛋白进而调控肌球蛋白与肌球蛋白之间的细胞黏附、神经突起生长及内皮细胞和上皮障碍的形成等一系列骨架活动,对肌肉收缩产生重要影响[7-9]。研究[10-12]显示高血脂、高血糖和高血压均会引起MLCK发生不同程度的表达,并且MLCK的不同程度表达对心脏的形态结构及功能产生不同的影响。本研究中免疫组化实验结果显示模型组MLCK蛋白的表达量明显高于正常组,给予ATRA后表达量明显下降。因此推测AS心肌损伤与MLCK的表达有关。
ATRA是维生素A在体内经两步代谢而来的产物,临床主要用于治疗急性早幼粒细胞白血病[13],近年研究[14]显示ATRA灌胃后能减轻内膜增厚和平滑肌细胞增生,在肥胖和AS及其并发症防治方面的作用被越来越多的相关专业关注。本研究HE染色和Masson染色结果显示模型组心肌纤维发生一定程度的紊乱与堆积,给予ATRA后,紊乱与堆积程度减轻,表明ATRA可以减轻AS兔心肌损伤情况。
丝裂原活化蛋白激酶(mitogen-activatedproteinkinases,MAPKs) 是一种将信号从细胞外传到细胞核的并引起一些列细胞生物学反应的重要信号调节酶。MAPK信号通路主要是由ERK、JNK、p38介导的三条级联反应,参与多种细胞反应及机体多种生理病理过程[15]。研究[16]表明MAPK信号通路受到多种刺激发生级联磷酸化被激活,促进细胞因子的生成导致炎症的发生。AS的发病原因复杂多样,目前没有确切的说法,但是炎性反应与氧化应激一直是导致AS发生的关键原因,因此,MAPK信号通路与AS的发生发展密切相连。Benson et al[17]发现ATRA可以通过MAPK通路途径抑制血管平滑肌的增生从而有助于AS的防治。ERK主要参与生长因子介导的细胞增殖,而且ERK部分参与心肌细胞基因的表达,是一条经典的MAPK信号通路。所以推测ATRA是通过ERK/MAPK通路调控MLCK的表达。Western blot结果表明在给予高脂饲料喂养后,ERK磷酸化水平和MLCK的表达呈现一致性,均发生升高,给予ATRA治疗后,磷酸化程度和MLCK的表达水平同时都发生降低。并且,HE染色和Masson染色结果均显示给予ATRA治疗后,心肌损伤程度减轻,免疫组化结果显示ATRA组心肌中MLCK表达量减少。
综合本实验结果和相关文献,本研究显示ATRA能降低MLCK的表达可能是通过ERK/MAPK通路途径进行调控。至于是否通过其他途径进行调控需要进一步研究,而ATRA是否可以作为临床抗AS药物,明确其作用机制有待深入的探讨。

