慢性肾脏病高血压大鼠主动脉收缩高反应的机制
胡 娟 杨真祯 邝素娟 连智雯 柯贵宝 廖如意 陈雪芹 马建超 黎思嘉张 丽 李 卓 冯仲林 梁华般 林 婷 董 伟 李锐钊 李志莲 章 斌梁馨苓 史 伟 邓春玉1, 刘双信
慢性肾脏病(CKD)已成为严重危害人类健康的疾病之一,我国CKD的发病率高达10.8%,其中约1%患者发展为终末期肾病(ESRD),且患病人数还在不断增加中[1]。高血压是CKD常见的并发症,也是影响CKD患者肾功能进展的危险因素[2]。CKD患者发生高血压的机制很多,常见因素包括体液潴留、肾素-血管紧张素-醛固酮系统(RAAS) 激活、血管顺应性改变、血管钙化等[3]。近年来研究发现,一些血管活性剂亦会通过影响血管舒缩功能来参与调节CKD患者的血压[4]。血管张力是影响血压的重要因素,受到多种机体内源性的活性物质调节,如苯肾上腺素、血栓素等,它们通过平滑肌细胞上相应的受体及偶联G蛋白信号通路等机制,介导血管收缩。
本实验通过比较CKD高血压大鼠与对照组大鼠离体血管环对常见的体内血管活性剂刺激的反应性及血管壁上相关受体蛋白的检测,旨在进一步探究CKD高血压的发生机制,为临床治疗提供新思路。
材料与方法
实验动物SPF级雌性SD大鼠24只,6~8周龄,体重约180~200g,由南方医科大学实验动物中心提供,实验动物合格证编号:44002100010960。
实验药物和试剂苯肾上腺素(phenylephrine,Phe)、血栓素A2类似物(9,11-dideoxy-11,9-epoxymethanoprostaglandin,U46619)、乙酰胆碱(acetylcholine,Ach)和硝普钠(sodium nitroprusside,SNP)均购于Sigma公司,抗α1肾上腺素能受体抗体和抗血栓素A2受体抗体购于Abcam公司,抗L型电压依赖性钙离子通道抗体购于Proteintech公司,其余试剂为国产分析纯。K-H液:NaCl 119 mmol/L,MgCl2·6H2O 1 mmol/L,CaCl22.5 mmol/L,KCl 4.7 mmol/L,KH2PO41.2 mmol/L,NaHCO325 mmol/L,Glucose 11.1 mmol/L;高钾 K-H 液:KCl 60 mmol/L,NaCl 63.7 mmol/L,CaCl22.5 mmol/L,KH2PO41.2 mmol/L,MgCl2·6H2O 1 mmol/L,NaHCO325 mmol/L,Glucose 11.1 mmol/L;高钾无钙K-H液:即不含CaCl2的高钾 K-H 液。以上混合液体均通5%CO2和95%O2混合气体30 min至饱和。
实验仪器智能无创血压计BP-98A型(北京软隆生物技术有限公司);610M型多通道血管张力测定仪(丹麦DMT公司);PowerLab8/30生物信号采集处理系统(澳大利亚AD公司)。
CKD模型制备24只雌性SD大鼠在南方医科大学实验动物中心屏障环境中适应性饲养1周,自由摄食和饮水。1周后采用随机数字法分为正常对照组及CKD组。对CKD组大鼠施行5/6肾切除,正常对照(假手术)组同期行手术,每次仅打开腹腔、暴露肾脏,关腹。分别于术前、术后第8、16周末取血测定各造模组大鼠血清肌酐(SCr)、血钙、血磷及血清甲状旁腺激素(PTH)水平。最终模型组大鼠1只因麻醉过量死亡,1只在第12周死亡,第16周时模型组大鼠存活10只,对照组大鼠全部存活(n=12)。
尾动脉收缩压测量术前、术后第16周,采用标准尾部测压法测量,每只大鼠测量3次,每次间隔5 min,取平均值作为大鼠尾动脉血压。
大鼠胸主动脉张力测定
离体胸主动脉环制备 采用颈椎脱臼法处死大鼠,迅速打开腹腔,取下胸主动脉,放入4℃、经混合气(含95%O2+5%CO2)饱和过的K-H液中,仔细分离周围组织,剪取1.8~2.0 mm 长的血管环,将其固定于610M血管张力测定仪上,施予15 mN前负荷,每隔15 min换液1次,平衡60 min后,在浴槽中加入药物进行实验。实验全程持续通以混合气至浴槽内的溶液中,保持温度在(37±0.5)℃[5]。
血管活性及内皮完整性测定[6]用高钾溶液(KCl 60 mmol/L)刺激胸主动脉环,待达到收缩稳定后,用K-H液置换浴槽内溶液,使血管张力恢复基线水平,平衡30 min后,重复上述实验至前后两次高钾刺激的血管收缩幅度相差不超过10%,则可进行下一步实验。用血管收缩剂Phe 1 μmol/L收缩胸主动脉,待血管达到最大收缩幅度并稳定后,加入血管舒张剂Ach 1 μmol/L舒张血管,若舒张幅度大于60%视为内皮完整,若舒张程度小于10%或不舒张视为内皮去除完全。
CaCl2对血管张力的作用 用高钾无钙K-H溶液置换浴槽内溶液,每隔10 min置换一次,直至血管张力恢复基线水平,再平衡30 min后,在浴槽中加入浓度梯度的CaCl2(0.001~3 mmol/L),记录血管张力的变化。
Phe和U46619对血管张力的作用 用K-H液置换浴槽内溶液3~4次,使血管张力恢复基线水平,平衡30 min后,在浴槽中分别加入各浓度梯度的血管收缩剂Phe(0.001~3 μmol/L)、U46619(0.001~1 μmol/L),观察其作用的量效曲线。
血管舒张功能的变化 用血管收缩剂U46619 100 nmol/L收缩胸主动脉,待血管达到最大收缩幅度并稳定后,分别加入各浓度梯度的血管舒张剂Ach (0.001~1 μmol/L)、SNP(0.03~10 nmol/L),记录血管舒张的变化。
Western Blot检测两组大鼠胸主动脉上相应的受体蛋白浓度取大鼠胸主动脉血管环约5~8 mm,加入细胞裂解液,将组织进行充分研磨裂解。匀浆好的组织液于离心后取细胞上清测蛋白浓度(BCA 法),将样品调至等量等体积,加入变性液 100 ℃加热变性,然后进行聚丙烯酰胺凝胶电泳。用聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)转膜,5% 脱脂奶粉封闭1h,分别用相应的抗α1肾上腺素能受体抗体(1∶ 1 000)、抗血栓素A2受体抗体(1∶ 1 000 )和抗L型电压依赖性钙离子通道抗体(1∶ 2 000) 4 ℃ 孵育过夜。缓冲液洗膜后,相应二抗(1∶ 5 000)室温孵育1h。用化学发光试剂盒显影,以β-actin(1∶ 5 000)作内参照,扫描灰度值并测定蛋白表达相对含量。
统计方法应用SPSS 20软件对数据进行统计分析。数据分析与统计学处理标准值100%为连续两次高钾所诱发的最大收缩张力的均值,用测得的收缩值/标准值的百分比来表示收缩幅度。Emax表示最大收缩/舒张幅度,pEC50为产生最大效应的50%时激动剂摩尔浓度的负对数。均数据以均数±标准差表示,采用SigmPlot软件对数据进行曲线拟合。两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
两组大鼠血液学指标及血压对比与造模前及同期正常对照组相比,造模8周时模型组出现了SCr升高、PTH升高、低钙高磷的典型CKD早期表现。随着病程的发展,第16周时模型组SCr升至78.1±18.70 μmol/L,较术前及同期对照组大鼠SCr均明显上升,提示模型组大鼠已进入CKD,并出现继发性甲状旁腺功能亢进(PTH 53.88±12.88 pg/ml)及高钙高磷等CKD相关并发症。同时,第16周时模型组大鼠尾动脉收缩压及舒张压较对照组均显著升高(收缩压160.50±17.33 mmHgvs137.00±7.65 mmHg,P<0.05;舒张压95.17±8.13 mmHgvs82.80±8.87 mmHg),提示造模成功(表1)。
血管收缩剂及舒张剂对血管张力的影响
高钾溶液、CaCl2诱导两组大鼠胸主动脉收缩反应的差异 在高钾及CaCl2刺激下,两组大鼠血管收缩无明显差异(表2、图1)。高钾及CaCl2均主要通过直接引起钙离子内流从而触发血管收缩,该结果提示模型组大鼠胸主动脉对钙离子敏感性及反应性未发生改变。
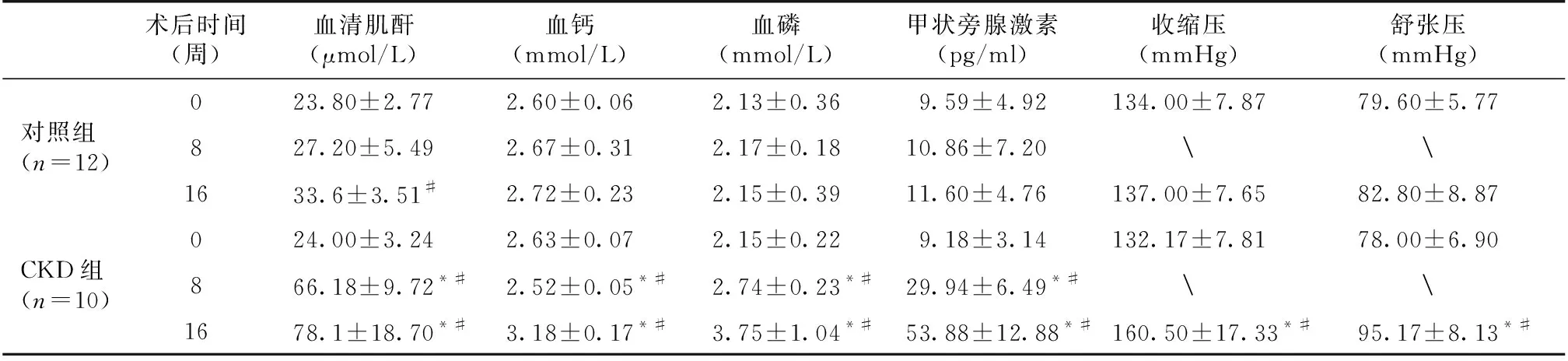
表1 两组大鼠血清肌酐、钙、磷、甲状旁腺激素及收缩压的比较
CKD:慢性肾脏病;*:与对照组比较,P<0.05;#:与0周比较,P<0.05
表2两组大鼠胸主动脉对血管收缩剂的敏感性及最大收缩力

处理分组pEC50Emax高钾溶液对照组33.24±6.56CKD31.57±4.63CaCl2对照组3.20±0.05103.75±14.51CKD3.05±0.03110.33±14.41Phe对照组7.21±0.0665.49±27.02CKD7.14±0.0660.31±13.54U46619对照组7.35±0.11121.39±15.47CKD7.51±0.04162.66±14.29**
CKD:慢性肾脏病;CaCl2:氯化钙溶液;Phe:苯肾上腺素;U46619:血栓素A2类似物;pEC50:产生最大效应的50%时激动剂摩尔浓度的负对数;Emax:最大收缩/舒张幅度;**:与对照组比较,P<0.01

图1 高钾、氯化钙作用下两组大鼠胸主动脉张力变化CKD:慢性肾脏病;A:高钾溶液(60 mmol/L)刺激下两组大鼠胸主动脉张力变化相似,无统计学差异;B:累计浓度梯度CaCl2(0.001~3 mmol/L)刺激下两组大鼠胸主动脉张力变化拟合图相似,无统计学差异
Phe、U46619诱导两组大鼠胸主动脉收缩反应 由表2、图2可知,在Phe刺激下,两组大鼠血管收缩无明显差异。而在U46619作用下,CKD组大鼠血管收缩量效曲线的Emax明显高于对照组(162.66±14.29vs121.39±15.47,P<0.01),两组间pEC50无明显差异,说明在同剂量的U46619刺激下,CKD大鼠胸主动脉会产生更强的收缩力。
Ach及SNP对胸主动脉舒张功能的影响 表3、图3提示CKD组大鼠胸主动脉在Ach和SNP作用下,其最大舒张幅度均小于对照组(P<0.01)。其中Ach介导的内皮依赖性舒张功能下降较明显 (67.78±6.18vs83.92±5.42,P<0.01),但两组pEC50无差异;SNP作用时,CKD血管舒张率亦有下降(95.45±1.33vs98.90±0.60,P<0.01),且其pEC50明显小于对照组(P<0.05),说明CKD大鼠胸主动脉对SNP的敏感性减弱。提示CKD大鼠胸主动脉舒张功能受损。
表3两组大鼠胸主动脉对血管舒张剂的敏感性及最大收缩力

处理分组pEC50EmaxAch对照组7.40±0.0483.92±5.42CKD组7.41±0.03 67.78±6.18**SNP对照组9.74±0.0298.90±0.60CKD组9.45±0.03*95.45±1.33**
CKD:慢性肾脏病;Ach:乙酰胆碱;SNP:硝普钠;pEC50:产生最大效应的50%时激动剂摩尔浓度的负对数;Emax:最大收缩/舒张幅度;与对照组比较,*:P<0.05,**:P<0.01
两组大鼠胸主动脉相关受体蛋白分布的差异TXA2受体蛋白为U46619的作用靶点,其在CKD组大鼠胸主动脉上的表达明显高于对照组,而KCl和Phe的作用靶点L-型钙通道蛋白和α1受体蛋白在两组的表达中没有差别(图4)。
讨 论
本研究通过测定血管张力,发现CKD大鼠胸主动脉对血栓素A2类似物刺激产生的收缩力明显增强,且其血管上TXA2受体蛋白亦明显增多。表明CKD大鼠高血压的发生可能与血栓素A2之间有一定联系。

图2 U46619、Phe作用下两组大鼠胸主动脉张力变化CKD:慢性肾脏病;Phe:苯肾上腺素;U46619:血栓素A2类似物;A~C:累计浓度梯度Phe(0.001~3 μmol/L)刺激下两组大鼠胸主动脉的收缩率变化(A、B分别为对照组和CKD组的张力变化图,C为拟合图);D~F:累计浓度梯度U46619(0.001~1 μmol/L)刺激下两组大鼠胸主动脉的收缩率变化(D、E分别为对照组和CKD组的张力变化图,F为拟合图);** :与对照组比较,P<0.01

图3 Ach、SNP作用下两组大鼠胸主动脉舒张功能变化CKD:慢性肾脏病;Ach:乙酰胆碱;SNP:硝普钠;A~C:累计浓度梯度Ach(0.001~1 μmol/L)刺激下两组大鼠胸主动脉的收缩率变化(A、B分别为对照组和CKD组的张力变化图,C为拟合图);D~F:累计浓度梯度SNP(0.03~10 nmol/L)刺激下两组大鼠胸主动脉的收缩率变化(D、E分别为对照组和CKD组的张力变化图,F为拟合图);** :与对照组比较,P<0.01

图4 两组大鼠胸主动脉相关受体蛋白分布的差异CKD:慢性肾脏病;α1:α型肾上腺素能受体蛋白;TXA2:血栓素A2受体蛋白;Cav1.2:L-型钙通道蛋白;** :与对照组比较,P<0.01,(n=3)
TXA2是花生四烯酸通过环氧合酶途径代谢后的产物,是一种有效的血管收缩剂和血小板聚集剂。其通过血栓素-前列腺素受体发挥作用,参与许多心血管疾病如缺血性心脏病、动脉粥样硬化和血管损伤等[7-8]。在肾脏方面,TXA2可引起肾血管强烈收缩,使肾血流量及肾小球滤过率下降[9]。有研究发现,CKD 3~4期患者尿液中血栓素代谢产物的排泄量较CKD 1~2期患者明显增加,说明随着肾功能的减退,CKD患者血液中TXA2的含量会进一步升高[10]。本研究表明,CKD大鼠胸主动脉对Phe及CaCl2刺激下的收缩力较对照组无明显变化,而对U46619反应明显增强,其主要原因正是由于CKD大鼠胸主动脉上TXA2受体较对照组增多。这提示我们在CKD个体不仅循环中的TXA2浓度升高,TXA2受体亦增多,两者相互作用,使TXA2的不良效应被双重放大,进一步强烈收缩血管,导致高血压,影响CKD患者预后。抑制TAX2生成或阻断其受体或许可延缓CKD的进展[11,12],一项瑞典的队列研究随访了801例CKD患者5~7年的肾功能变化,结果显示长期服用阿司匹林的患者其肾功能进展较未服药组减慢[13]。但对于CKD患者来说,常规剂量的阿司匹林可能不具备有效抑制循环中TXA2产生的效应,使得CKD患者CVD发生率及死亡率明显升高[14-15]。根据本研究结果,我们猜想可能是由于TAX2受体蛋白的增多,所以需采用较高剂量的拮抗剂才能抑制其不良效应,但其有效性还需进一步研究证实。
同时,本实验还研究了CKD高血压大鼠的血管舒张功能,发现CKD大鼠胸主动脉舒张功能减弱,其中对Ach介导的内皮依赖性舒张功能受损较明显,SNP介导的非内皮依赖性舒张功能亦有下降,但幅度较小。血管内皮是调节血管舒缩功能的重要因素,主要通过NO激活可溶性鸟苷酸环化酶合成环磷酸鸟苷,从而发挥舒张血管的作用[16]。CKD 患者常伴微炎症状态、尿毒症毒素及脂质代谢异常等,这些均会引起血管内皮的损伤[17]。内皮功能受损直接影响血管的舒张功能,导致血管顺应性下降,血压升高[18]。
综上所述,本研究发现CKD高血压大鼠胸主动脉TXA2受体蛋白增多,从而导致其对TXA2类似物刺激收缩力增强。提示CKD个体中高血压的发生除了常见的传统因素外,或许还跟TXA2及血管舒张功能减退相关,这一发现可能将丰富CKD发生高血压的机制,可为其治疗提供新思路。但至于CKD大鼠血管上TXA2受体蛋白增多的机制,该受体蛋白的增多在高血压的发生发展中起到多大的作用,使用TXA2阻断剂对治疗CKD个体的高血压是否有效,这些问题还有待进一步探究。

