心脏磁共振在狼疮性心肌炎诊断中的应用
董建华 罗 松 胡伟新 审校
系统性红斑狼疮(SLE)是一种多系统受累的自身免疫性疾病,心脏是常见的受累器官,患病率高达50%以上,心肌、心包、心内膜、心脏瓣膜、冠状动脉、传导系统均可被累及[1]。狼疮性心肌炎(LM)是狼疮免疫复合物介导的心肌组织炎症反应和心肌损伤。临床报道少见,近期研究中LM发病率仅9%[2-4],而早期尸检报告中LM发生率却高达57%[2],可见其在临床上发生率并不低。
LM的发病机制和临床表现
LM是由抗原抗体免疫复合物形成、补体激活、炎症细胞浸润导致的心肌损伤,同时免疫炎症反应致金属基质蛋白酶等细胞因子释放和激活,破坏间质胶原蛋白和弹性蛋白等心脏骨架结构,随后心肌纤维化、重构,影响心脏结构和功能,轻者心功能完全恢复或遗留一定程度心功能障碍,重者导致扩张性心肌病、心力衰竭,甚至死亡[5](图1)。抗核糖核蛋白抗体、抗心肌抗体、抗心磷脂抗体、抗Ro抗体和抗SSA抗体可能参与LM的发生发展[5],但不是存在这些自身抗体就一定会导致LM。
LM大多发生在SLE发病早期,也可以是SLE首发临床表现,SLE活动者易患LM。LM临床症状多不典型,轻者可无明显症状,重者可危及生命,甚至猝死。发热、呼吸困难、胸痛、心悸为常见症状。重者出现充血性心力衰竭时可有呼吸困难,心脏增大、心动过速、奔马律、肺部啰音、外周水肿等表现,临床最为常见;出现心源性休克时可有血压下降、脉搏细弱、四肢厥冷等表现;出现Ⅲ度房室传导阻滞时可有晕厥和Adams-Stokes综合征[3,6-7]。狼疮性肾炎(LN)患者易患LM[3,8],出现心力衰竭症状时,易被归因于肾性因素导致容量负荷过重;部分LM病变较轻者经免疫抑制治疗往往很快缓解,容易被忽略。
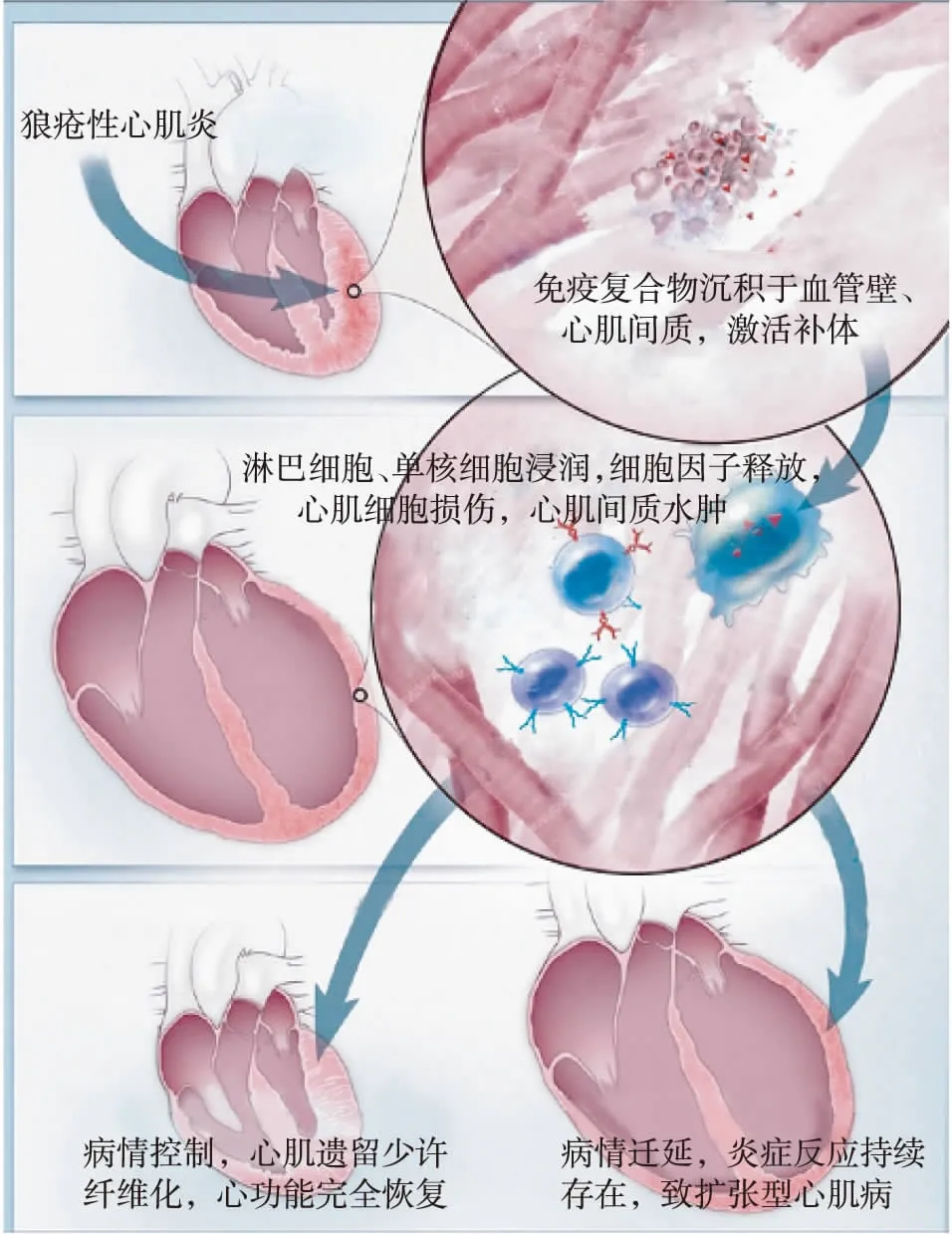
图1 狼疮性心肌炎发病机制示意图
心肌细胞损伤时,释放肌钙蛋白(cTn)、肌酸激酶(CK)及其同工酶(CK-MB)等心肌酶入血,cTn检测心肌病变的敏感度高于CK、CK-MB。LM时,血清心肌酶含量相对较少,且心肌病变轻重程度不同,不是所有心肌炎患者都会出现cTn升高,仅35%~45%出现cTn升高[3,9]。
LM的诊断
临床上尚未制订LM诊断标准,共诊断多参照病毒性心肌炎。在排除冠心病、高血压病、中毒、病毒性感染等因素引起的心肌病或心肌炎后,SLE患者出现呼吸困难、胸痛、肺部罗音、颈静脉怒张、新发心脏杂音等临床表现,心肌损伤标志物升高,临床应考虑疑似LM,除了临床症状外,LM诊断还包括心电图、超声心动图、心脏磁共振(CMR)和心内膜心肌活检(表1)。

表1 狼疮性心肌炎诊断标准
说明:在排除冠心病、高血压病、中毒、病毒性感染等因素引起的心肌病或心肌炎后,符合1+2+3可诊断疑似狼疮性心肌炎;符合1+2+4或1+2+3+4可临床诊断狼疮性心肌炎;符合1+2+5+或3、4可诊断狼疮性心肌炎。
心内膜心肌活检(endomyocardial biopsy,EMB)被认为是诊断心肌炎的金标准。目前沿用的心肌炎诊断标准是美国心脏病学会制定的Dallas标准[12],组织学检查心肌损伤部位应有心肌间质局灶或弥漫性炎症细胞浸润(淋巴细胞、浆细胞和巨噬细胞)、水肿,心肌细胞损伤(变性、坏死和纤维化)。免疫荧光可见免疫复合物和补体呈细颗粒状沉积在心肌血管壁和心肌间质[13]。虽然EMB特异度较高,但对心肌局灶病变的敏感度较低(10%~22%)[14]。并且EMB是一种有创性检查,可导致多种并发症(如心律失常、心脏穿孔、心包压塞、血栓栓塞等,发生率约6%)[14],限制了其在心肌炎诊断中的应用。
LM超声心动图可表现为心腔扩大、心室壁运动异常、心室壁增厚、左室射血分数下降、舒张功能减退等心肌结构、功能改变,可间接判断心肌损伤,是一种简便且准确性较高的诊断方法[8]。但是超声心动图检查缺乏特异性,急性冠状动脉综合征、心肌炎等心肌缺血病变,在超声心动图上均可表现为室壁运动减弱或消失或反常运动等心室壁运动异常,同时不能反映轻度的心肌病变。
多数心肌炎患者存在心电图异常[15],但缺乏特异性,LM心电图可表现为:窦性心动过速,ST-T改变,异常Q波,Q-T间期延长,房性或室性期前收缩,以及传导阻滞(窦房、房室及束支传导阻滞)等。在治疗过程中动态观察心电图变化,有助于判断心肌病变的变化过程。
LM会导致心律失常、传导阻滞、扩张型心肌病、心力衰竭,甚至猝死,故早期准确诊断LM及评估病情严重程度显得尤其重要。尽管部分患者可通过临床表现、心肌损伤标志物、心电图、心脏超声及心内膜心肌活检最终明确诊断,但由于各自局限性而容易漏诊误诊。
CMR作为新的诊断方法,有助于提高对疑似LM的诊断。心脏的解剖结构复杂,心脏跳动、血管搏动、呼吸运动会导致影像学图像形成运动伪影,而快速核磁共振心脏成像技术结合心电门控及呼吸门控,可获得清晰的CMR成像图像。CMR成像采用多个序列进行成像,常用的序列有T1和T2加权像序列(T1WI和T2WI)、电影序列、心肌灌注序列、延迟增强扫描序列,用于观察心脏形态结构,计算心脏射血分数、每搏输出量、心输出量、心肌质量,评估心脏收缩舒张功能、心脏瓣膜功能、心肌供血情况等。1998年首次使用心电触发的钆增强T1WI观察急性心肌炎的动态变化结果,清楚显示了炎症的位置、范围及严重程度,之后通过大量学者不断的深入研究,在此方面收获大量成果。
增强扫描在CMR检查中发挥重要作用。正常组织与病变组织的血流灌注水平存在差异,导致对比剂在病变区域分布量更大,即MRI强化。正常心肌组织,对比剂由血管进入组织细胞间隙而不再进入细胞内,对比剂迅速灌注也较快排出。LM病变时,血管通透性增加,心肌间质水肿使细胞组织间隙扩大,对比剂快速进入血管外间隙并聚集,即早期强化(early gadolinium enhancement,EGE);同时,由于心肌细胞膜的完整性遭到破坏,导致细胞膜通透性增高,造影剂可自由地进入细胞内部,并逐渐聚集,而排出速度较慢,即延迟强化(late gadolinium enhancement,LGE);病变后期,心肌细胞坏死,纤维瘢痕组织形成,导致细胞外间隙容纳更多的造影剂,根据强化程度,可初步判断病变的严重程度及其预后情况[16]。心肌炎患者进行CMR增强扫描时,首次灌注以5 ml/s速率注射对比剂钆喷酸葡胺(Gd-DTPA)0.1 mmol/Kg,4~5 min时行早期增强扫描,10 min时作延迟增强扫描。
根据2009年美国心脏病学会提出的心肌炎磁共振诊断标准,即Lake-Louise标准[11],CMR至少包括以下两个表现,心肌局灶性或全壁性T2加权像高信号,EGE或LGE。Lake-Louise标准的制订主要基于病毒性心肌炎(Viral myocarditis,VM),目前在LM方面的应用研究较少。Mavrogeni等[17]对20例疑似LM患者和40例VM患者行对比研究发现,LM临床表现较VM更不特异;T2WI和EGE均可见于LM和VM患者,LGE在VM患者多见,却少见于LM;Lake-Louise标准诊断LM和VM的阳性率分别为80%和87.5%。Barillas[18]研究发现LM患者临床以呼吸困难最常见,而VM患者以胸痛多见;LM患者LGE阳性率(63%)却明显高于VM(41%),强化部位无差异。通过特定软件测量延迟强化区域位置、面积及占全部心肌的百分比,以明确心肌损伤分布特征、范围及严重程度,评估风险和预后,指导治疗策略(图2)。
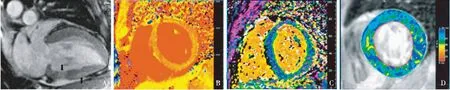
图2 A:狼疮性心肌炎心脏延迟强化,心底下壁透壁性延迟增强(左侧箭头),心脏中部下壁心外膜下延迟增强(右侧箭头);B:急性心肌炎T1-Mapping检查;C:急性心肌炎心肌细胞外容积比(ECV);D:急性心肌炎T2-Mapping检查
SLE既可出现LM,也可出现急性冠状动脉综合征,CMR均可表现为LGE,故临床需进行鉴别。LGE的部位和程度有助于区别缺血性和非缺血性心肌病。心肌冠状动脉闭塞15 min左右开始出现心肌细胞坏死,由心内膜下层开始逐渐向心外膜移行,直到累及心肌全层,心肌梗死显示心内膜下均匀分布的LGE是缺血性心肌病特征表现[19]。非缺血性心肌病如心肌炎等LGE位于心外膜下和肌壁间,呈不均匀增强改变或弥散性增强改变,其分布与冠状动脉走行关系不大[20]。因此,LGE的位置、程度及形态有助于区分心肌炎和缺血性心肌病。
Lake-Louise标准诊断心肌炎的准确度为70%~90%[21],可作为增加心肌炎诊断依据的一项辅助检查,而不能作为确诊或排除的标准。T2WI具有局限性,扫描时间长,影像解读具有主观性,心动过速或心律不齐时信号强度减弱,心室腔内缓慢/暂停流动的血液所致的高信号易干扰心肌信号。LGE也有一定的局限性。LGE诊断心肌炎的特异度高(100%),灵敏度却低(44%)[22]。心肌病变需要达到一定的程度才可能在核磁共振成像上表现出来,太小的病变由于空间分辨力有限及心脏扫描过程中心脏搏动及呼吸运动等因素可能造成伪影形成而不能显示或显示不佳。动物研究发现,心肌损伤范围达到或超过横断层面5%时,LGE才可以显示[23]。对局灶性心肌病变的诊断基于强化区域与正常心肌信号强度对比,故对弥漫性心肌病变的诊断存在不足。
新型CMR技术
纵向弛豫时间定量成像(T1-Mapping)技术是一种新近发展起来的CMR技术,通过直接测量心肌组织T1值,可定量评估心肌局部及弥漫性病变。其主要评价参数包括心肌平扫T1值、增强T1值和心肌细胞外容积比(extracellular volume fraction,ECV),在评估心肌细胞水肿、缺血、纤维化方面具有较大的临床价值(图2)。T1-Mapping平扫可重复性高,伪影少,临床应用较多。ECV是细胞外间质容积占整个心肌容积的百分比,通过测量平扫T1值、增强后T1值及血细胞比容计算出的一种相对稳定的指标,不易受磁场强度、成像序列的影响。T1-Mapping对心肌炎诊断的敏感度优于T1WI和LGE,诊断急性心肌炎的敏感度、特异度及准确性分别为 90%、91%和91%[24]。T1-Mapping可区分心肌炎急性期和慢性期,平扫T1值高于5SD可诊断急性心肌炎,平扫T1值高于2SD可诊断恢复期心肌炎[25]。Valentina等[26]研究发现SLE患者3.0T CMR平扫T1值1 152±46 ms、ECV值30%±6%较健康人群平扫T1值1 026±27 ms、ECV值26%±5%明显增加,而增强T1值较健康人群明显减低(411±62 msvs454±53 ms),因此T1-Mapping可检测SLE患者亚临床心肌损害。李松南等[27]发现健康男性平扫T1值、ECV值高于女性,增强T1值低于女性。LM患者的T1-mapping参数亦可能存在性别差异,目前暂未有研究明确。
横向弛豫时间定量成像技术(T2-Mapping)通过直接测量心肌组织T2值,可定量评估心肌水肿病变(图2)。Zhang等[28]研究发现SLE患者1.5T CMR平扫T2值较健康人群平扫T2值明显增加(58.2±5.6 msvs52.8±4.4 ms),因此T2-Mapping可检测SLE患者亚临床心肌损害。Hinojar等[29]对76例疑似LM患者和46例健康人群行T1和T2-Mapping平扫检查,健康人群T1值1 057±23 ms、T2值45±4 ms,SLE患者T1值1 176±55 ms、T2值65±8 ms,其中T1值诊断LM(T1值>5SD)的阳性率为71%,T2值>2SD的阳性率为83%,而Lake-Louise标准诊断LM的阳性率仅29%,T1和T2-Mapping技术是识别心肌炎症、水肿和纤维化病变的敏感技术;同时对35例随访患者(14例因狼疮活动行免疫强化治疗,21例治疗方案不变)于3~6月和15~18月复查CMR,免疫强化治疗者T1和T2值均明显下降,T1和T2-Mapping技术是LM治疗反应重要的预测因子。
小结:LM临床发生率高,症状不典型,缺乏有效诊断方法。CMR已成为评估、诊断LM的一种非侵袭性的重要工具,具有无创伤性、无放射性、无需碘类对比剂,能多参数、多方位成像,软组织对比度和高空间分辨率良好的优势。尤其是新型的定量成像技术T1-Mapping和T2-Mapping,可识别心肌炎症、水肿和纤维化病变。CMR对LM的早期诊断、风险评估、指导治疗策略和预后评估有着重要价值。

