一次性力竭运动对HIF-1α转基因鼠骨骼肌Nrf2抗氧化信号的影响
王林佳,张 缨
一次性力竭运动对HIF-1α转基因鼠骨骼肌Nrf2抗氧化信号的影响
王林佳,张 缨
北京体育大学 运动生物化学教研室 北京 100084
目的:探讨一次性力竭运动对HIF-1α转基因鼠骨骼肌Nrf2抗氧化信号的影响。方法:HIF-1α转基因鼠和野生型C57BL/6J小鼠各20只。随机分为野生安静组(WC组)、野生运动组(WE组)、转基因安静组(HC组)和转基因运动组(HE组)。正式实验时运动组小鼠做递增负荷跑台运动直至力竭,运动后即刻取材,脱颈处死后取两侧小腿骨骼肌。采用酶联免疫法(ELISA)测定骨骼肌Nrf2-ARE结合活性,实时荧光定量PCR测定骨骼肌Nrf2下游抗氧化基因表达,Western Blot法测定骨骼肌中蛋白表达,高质荧光测定法测定小鼠骨骼肌ROS。结果:1)与WC组相比,HC组小鼠骨骼肌Nrf2 mRNA和蛋白表达显著增加,Nrf2-ARE结合活性显著增加,靶基因SOD1、SOD2、NQO-1 mRNA表达显著增加,NQO-1蛋白表达显著增加,骨骼肌ROS水平极显著下降;2)与HC组相比,HE组小鼠骨骼肌核蛋白Nrf2含量显著性增加,SOD2和NQO-1 mRNA表达量显著增加,且NQO-1蛋白表达显著增加,ROS无明显变化;3)与WE组相比,HE组小鼠Nrf2 mRNA和蛋白表达显著增加,Nrf2核蛋白及P-Nrf2表达增加。骨骼肌SOD2和NQO-1mRNA表达增加,NQO-1蛋白表达显著增加,骨骼肌ROS含量极显著下降。结论:适当的HIF-1α高表达可提高安静状态下小鼠骨骼肌Nrf2-ARE通路的激活,且对一次力竭运动后骨骼肌ROS的消除也有积极的调节作用。
运动;氧化应激;核因子E2相关因子2;低氧诱导因子1-α亚基
低氧训练作为提高运动员运动能力的辅助措施,是运动员经常采用的训练方法之一[21]。运动和环境低氧可刺激机体使之产生适应[6,8]。低氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)是调节机体缺氧适应的核心转录因子。其功能性亚基HIF-1α发挥主要调节作用,低氧和运动均可促进其表达[4,12]。
核因子E2相关因子2(nuclear factor-erythroid 2 p45-related factor 2,Nrf2)是机体氧化应激中起着中枢调节作用的一个核转录因子[16]。在正常生理状态下,Nrf2与胞浆中的keap1蛋白结合并被固定在胞浆中,当细胞受到氧化应激刺激时,Nrf2与keap1蛋白解离并转移至细胞核,与核内Maf蛋白二聚化后可识别并结合靶基因DNA启动子序列——抗氧化反应元件(antioxidant response element,ARE),促进下游靶基因抗氧化酶基因的转录,如超氧化物歧化酶(SOD)、醌氧化还原酶(NQO-1)、过氧化氢酶(CAT)等一系列抗氧化和Ⅱ相解毒酶。提高机体对抗氧化应激的能力[9,15]。综上所述,Nrf2-ARE系统在机体抗氧化反应中发挥着非常重要作用[9]。
运动、低氧可导致机体内氧化还原平衡破坏[4,15]。目前有研究发现,HIF-1α的高表达可能在机体对低氧适应中起到保护作用,但HIF-1α高表达对力竭运动后小鼠骨骼肌Nrf2-ARE通路的影响目前并不清楚。本实验采用野生鼠与HIF-1α转基因鼠,探讨安静状态和一次性力竭运动后小鼠骨骼肌Nrf2-ARE抗氧化信号的变化,进一步揭示HIF-1α和骨骼肌Nrf2抗氧化信号的关系。
1 研究对象与方法
1.1 研究对象
健康8周龄C57BL/6J小鼠20只(W),诱导型HIF-1α转基因鼠20只(H),HIF-1α采用C57BL/6J小鼠制做HIF-1α转基因鼠[22]。所有小鼠均购于中国医学科学院医学实验动物研究所,体重为18±2 g。两种小鼠骨骼肌内HIF-1α蛋白检测结果如图1所示。

图1 小鼠骨骼肌HIF-1α蛋白表达
Figure 1. Expression of HIF-1α Protein in Mice
注:@表示与野生鼠比较<0.05,下同。
1.2 研究对象分组
HIF-1α转基因鼠和野生型C57BL/6J小鼠各20只。随机分为野生安静组(WC组)、野生运动组(WE组)、转基因安静组(HC组)和转基因运动组(HE组)。实验动物饲养于北京体育大学动物房,分笼饲养,每笼3~4只,温度保持在20~25℃,相对湿度保持在50%~70%,每天进行12 h模拟自然光照射。动物饲养采用国家啮齿类动物标准饲料,整个饲养过程中动物能够自由进食和饮水。
1.3 运动方式
HC组、HE组小鼠均进行一次性递增负荷至力竭跑台运动,坡度为5%,起始速度为10 m/min,每3 min增加1级,直至力竭(表1)。
表1 本研究小鼠递增负荷至力竭的跑台运动方案
Table 1 Exhaustion Exercise Running Scheme of Mice

适应性训练在正式实验开始前两天进行,共进行2天,时间为10 min/天。正式实验时,力竭判断标准为电击10 s仍不运动即视为已达到力竭。
1.4 取材
所有小鼠均采用脱颈处死,运动组小鼠运动后即刻取材,取小腿腓肠肌,用锡纸包裹,标记,投入液氮中。而后,将所有取好的组织存入-80℃冰箱,保存待用。
1.5 实验试剂、仪器及方法
1.5.1 酶联免疫法(ELISA)测定骨骼肌总蛋白Nrf2-ARE结合活性
采用美国Pierce公司生产的蛋白浓度试剂盒,通过BCA方法,测定蛋白匀浆液蛋白浓度。根据测定的蛋白浓度,计算各样品蛋白含量,调整为10 μg所需稀释比例。采用美国Active Motif公司生产的Trans AM Nrf2试剂盒测定Nrf2-ARE结合活性,操作完全按照试剂盒说明书进行。结果以(测定孔OD值-空白孔OD值)/[对照组(测定孔OD-空白孔OD值)平均值]表示。
1.5.2 骨骼肌蛋白提取
将100 mg骨骼肌加入800 μl裂解液A(已加入EDTA)中,匀浆机高速充分匀浆;于冰上静置10 min,涡旋振荡 5 s,再于冰上静置10 min,涡旋振荡5 s,15 000 rpm,4℃离心10 min;取上清即为胞浆蛋白,于-20℃冻存备用。
1.5.3 Western Blot测定骨骼肌蛋白表达
采用美国Pierce公司生产的蛋白浓度试剂盒,BCA法测定骨骼肌的胞浆蛋白及核蛋白浓度。根据测定的核蛋白浓度以及上样蛋白量20 μg计算上样的体积。采用美国life technologies 公司生产的Bolt 4%~12% Bis-Tris Plus凝胶,电泳分离目的蛋白及内参,而后采用美国Invitrogen公司的iBlot2进行转膜。5%的脱脂牛奶封闭1 h,加一抗于4℃孵育过夜。一抗稀释比例为:Nrf2(SC-722,1:200),p-Nrf2(Ser40)(BS-2013R 1:1 000),NQO-1(SC-16464,1:500),SOD1(SC-11407,1:500),SOD2(SC-30080, 1:3 000),CAT(SC-50508,1:500),内参蛋白β-actin(SC-47778,1:1 000),H1(SC-10806,1:1 500)。次日以1×TBST洗3次,每次10 min。加二抗室温孵育1 h,然后1×TBST洗3次,每次10 min。洗膜后,加入发光液(Thermo 34095),曝光结果采用Image Lab软件读取条带积分灰度值,结果用以下公式计算的比值表示。
1.5.4 实时荧光定量测定骨骼肌抗氧化基因mRNA表达量
取小鼠骨骼肌50 mg,沥干,加入0.8 ml Trizol试剂(美国Invitrogen公司),组织研磨、分相、分离、洗涤和提纯总RNA。采用日本Toyobo公司生产的荧光染料反应体系(SYBR Green Realtime PCR Master Mix)及引物Nrf2(QT00095270),SOD1(QT00165039),SOD2(QT00161707),CAT(QT01058106),NQO-1(QT00094357)。采用美国ABI7500荧光定量PCR仪测定SOD1等基因mRNA水平,用该仪器自带软件读取荧光定量CT值。目的基因结果以比较CT法相对定量表示。计算公式为:目的基因=2-△△CT。
1.5.5 荧光比色法测定小鼠骨骼肌ROS含量
采用GENMED高质荧光测定试剂盒测定小鼠骨骼肌ROS含量:取小鼠100 mg的腿部腓肠肌,匀浆,离心后测定蛋白浓度。现配染色液工作液2 000 μl:10 μl染色液+ 190 μl预热的稀释液C,加入190 μl的染色液,37℃水槽孵育20 min,避免光照。荧光分光光度计:激发波长490 nm,散发波长520 nm。
1.6 实验数据统计分析
使用SPSS 17.0统计软件对实验数据进行处理,使用双因素方差分析处理数据。若有交互作用则采用简单效应检验,若无交互作用则采用独立样本检验。最终实验结果用M±SE表示。<0.05和<0.01表示在统计学上有意义,其中,<0.05表示有显著性差异,<0.01表示有非常显著性差异。
2 研究结果
2.1 HIF-1α对小鼠骨骼肌Nrf2 mRNA和Nrf2、p-Nrf2、核蛋白Nrf2蛋白表达的影响
如图2所示,HC组与WC组相比,小鼠Nrf 2mRNA和蛋白表达明显增加(<0.05)。pNrf2和核蛋白Nrf2蛋白表达无明显变化。WE组与WC组相比,小鼠骨骼肌Nrf2 mRNA显著增加,Nrf2蛋白表达有增加趋势但无显著性,小鼠骨骼肌pNrf2和核蛋白Nrf2蛋白表达无明显变化。HE组与HC组相比,小鼠Nrf2 mRNA和蛋白表达均无显著性。HE组与WE组相比,小鼠Nrf2 mRNA和蛋白表达均显著增加(<0.05),P-Nrf2和核蛋白Nrf2蛋白表达显著增加(<0.05)。
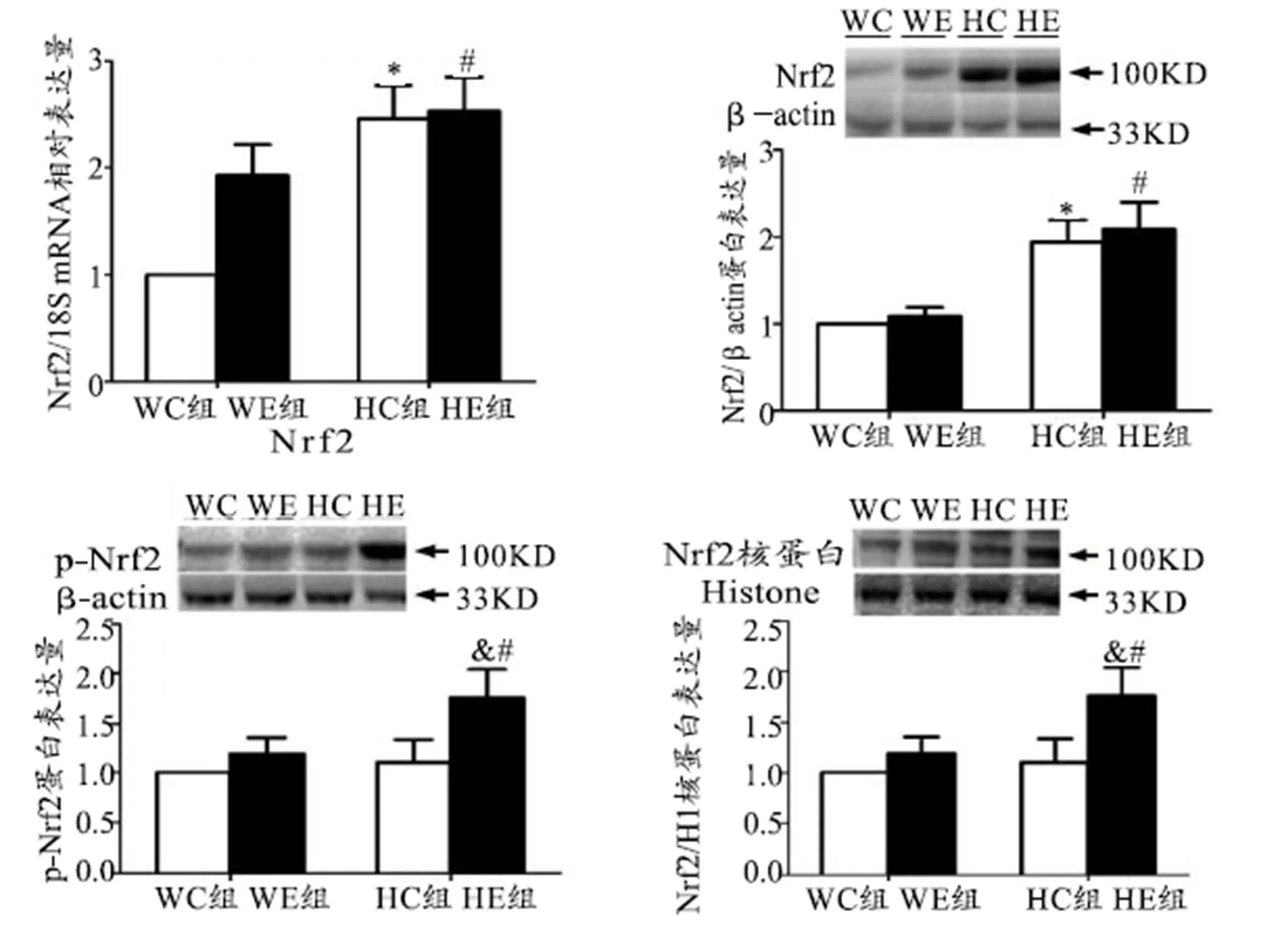
图2 小鼠骨骼肌Nrf2mRNA表达、Nrf2、p-Nrf2、核蛋白Nrf2蛋白表达
Figure 2. Expression of Nrf2 mRNA and Nrf2/p-Nrf2/ Nuclear Nrf2 Protein in Mice
注:*表示与WC组相比<0.05,#表示与WE组相比<0.05,&表示与HC组相比<0.05,下同。
2.2 HIF-1α对小鼠骨骼肌Nrf2-ARE结合活性和Nrf2靶基因mRNA表达的影响
如图3所示,HC组与WC相比,小鼠Nrf2-ARE结合活性显著增加,Nrf2下游靶基因SOD1、SOD2及NQO-1 mRNA表达显著增加。WE组与WC组相比,小鼠骨骼肌Nrf2-ARE结合活性显著增加,小鼠骨骼肌SOD1、SOD2 mRNA表达显著增加,CAT和NQO-1 mRNA表达量虽有增加趋势但无显著性。HE组与HC组相比,小鼠骨骼肌Nrf2-ARE结合活性无明显变化。HE组与WE组相比,小鼠Nrf2-ARE结合活性无明显变化,小鼠骨骼肌SOD2和NQO-1 mRNA表达显著增加,SOD1、CAT mRNA表达虽有增加趋势但无显著性。HE组与WE组相比,小鼠SOD1和CAT mRNA表达无明显变化,SOD 2mRNA表达量显著增加,NQO-1 mRNA表达极显著增加。

图3 小鼠骨骼肌Nrf2-ARE结合活性和Nrf2靶基因表达
Figure 3. Nrf2-ARE Binding Activity and Expression of Nrf2 Target Genes in Mice
2.3 HIF-1α对小鼠骨骼肌抗氧化酶表达的影响
如图4所示,HC组与WC相比,小鼠Nrf2下游靶基因SOD1、SOD2、CAT、NQO-1蛋白表达无明显变化。WE与WC相比,小鼠骨骼肌SOD1、SOD2、CAT、NQO-1蛋白表达无明显变化。HE组HC组相比,小鼠骨骼肌SOD1、SOD2、CAT、NQO-1均增加,但仅有NQO-1蛋白表达具有显著性增加。HE组与WE组相比,小鼠Nrf2下游靶基因SOD1、SOD2、CAT、NQO-1均出现增加,但仅有NQO-1蛋白表达具有显著性增加。
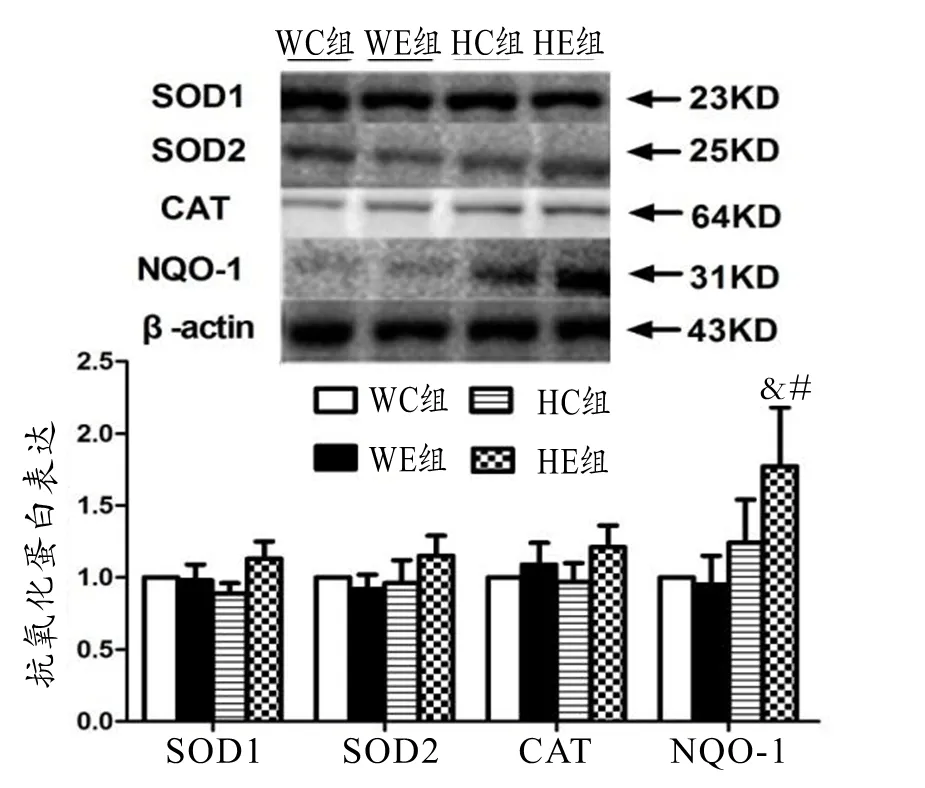
图4 小鼠骨骼肌抗氧化蛋白表达
Figure 4. Expression of Peroxiredoxins in Mice
2.4 HIF-1α对小鼠骨骼肌ROS水平的影响
由图5可知,HC组小鼠骨骼肌ROS水平极显著低于WC组。WE组与WC组相比,小鼠骨骼肌ROS出现增加趋势但无显著差异。HE组与HC组相比,小鼠骨骼肌ROS无明显变化。HE组小鼠骨骼肌ROS极显著低于WE组。

图5 小鼠骨骼肌ROS水平
Figure 5. The ROS Level in Skeletal of Mice
注:**表示与WC组相比<0.01,##表示与WE组相比<0.01。
3 分析讨论
3.1 安静状态HIF-1α高表达对小鼠骨骼肌抗氧化信号影响
目前研究发现,HIF-1α高表达对机体的多个方面都具有调节作用。通过转染使GRC-1细胞HIF-1α高表达,发现细胞内Ca2+的水平会受到HIF-1α的影响。HIF-1α可作用于内质网下调细胞内Ca2+水平,从而避免钙超载[3]。Lunde等[13]对成年大鼠诱导14天使HIF-1α高表达后发现,肌纤维横截面面积增加,氧化酶活性增强和肌凝蛋白增加。然而,HIF-1α高表达对抗氧化系统的影响,目前缺乏文献报道,因此,本研究试图通过对野生鼠和HIF-1α转基因鼠骨骼肌内Nrf2-ARE抗氧化信号通路各指标的对比,探究HIF-1α高表达对抗氧化系统的影响。
在本实验中,安静状态下,HIF-1α高表达小鼠骨骼肌Nrf2蛋白表达水平明显高于野生鼠。这可能是通过HIF-1α对其下游靶基因的调控来实现。促红细胞生成素(EPO)是位于HIF-1α下游的一种细胞因子,它可以刺激骨髓造血功能,促进红细胞生成。同时,它也被认为是一种具有抗炎和细胞保护作用的抗氧化剂,可以调控Nrf2的激活[5,11,12,17,24]。Genc等[7]研究发现,对人体SH-SY5Y细胞加入EPO孵育24 h后,Nrf2胞浆蛋白和核蛋白表达均升高。这提示,HIF-1α可能可以通过其下游的EPO促使Nrf2表达增加。此外,HIF-1α转基因鼠骨骼肌内Nrf2-ARE结合活性显著高于野生鼠,这可能如文献所述,Nrf2的活化与NF-κB这一炎性转录因子的活化存在着竞争性抑制作用[23],HO-1不仅是Nrf2的靶基因也是HIF-1α的靶基因。HIF-1α可上调血红素加氧酶(HO-1)表达。而较多的HO-1可抑制NF-κB活化从而促进上游蛋白Nrf2的解离及入核[2]。这也提示,HIF-1α对Nrf2-ARE结合活性的调控可以通过二者共同的靶基因HO-1来实现。
ROS是反映机体氧化应激程度的指标,Nrf2可通过激活其下游抗氧化蛋白的表达来清除机体内过多的ROS。李铁瑛[1]的研究发现,HIF-1α转基因鼠骨骼肌抗氧化蛋白SOD2显著增加,反映氧化应激程度的脂质过氧化物4-HNE蛋白表达量低于野生鼠。本研究中,HIF-1α转基因小鼠Nrf2靶基因mRNA(SOD1、SOD2、NQO-1)及抗氧化蛋白(SOD2、NQO-1)表达量显著升高。与WC组小鼠相比,HIF-1α转基因小鼠骨骼肌ROS水平极显著降低,与上述文献所述结果一致。这表明,HIF-1α的高表达可以使小鼠骨骼肌Nrf2-ARE转录活性提高,抗氧化蛋白表达增多,以及抗氧化能力提高。
3.2 一次性力竭运动对HIF-1α转基因鼠骨骼肌抗氧化信号的影响
HIF-1α是介导机体对低氧适应的重要调节因子。低氧可刺激HIF-1α的表达[18]。而剧烈运动可使体内自由基产生增多,过多的自由基会使机体出现氧化应激进而造成组织损伤[5]。目前有研究发现,在这种运动引起氧化应激中,HIF-1α的高表达可能具有一定的保护作用[20]。适度低氧(10% O2)干预后,PC12细胞HIF-1α蛋白表达增多,细胞总抗氧化能力增强[25]。以上研究表明,HIF-1α的增加对于机体氧化应激状态的调节具有积极作用,但它的增加是否通过Nrf2-ARE信号通路来调节氧化应激状态并不清楚。因此,本实验通过比较野生鼠与HIF-1α转基因鼠一次性力竭运动后骨骼肌内Nrf2 mRNA、蛋白表达、Nrf2-ARE结合活性及下游抗氧化靶基因及抗氧化蛋白表达的变化,来探讨在一次性力竭运动引起的氧化应激中,HIF-1α对机体的调节作用及对Nrf2-ARE信号通路的影响。
在本研究中,HIF-1α转基因小鼠经过一次性力竭运动后骨骼肌Nrf2核蛋白及p-Nrf2蛋白表达显著增加,而野生鼠在运动后并未出现变化。这可能是由于转基因小鼠体内的HIF-1α高表达在安静状态时已经造成了细胞内Nrf2蛋白有较多的累积,大强度的运动造成的氧化应激刺激促进了转基因小鼠骨骼肌内Nrf2的核易位及磷酸化。一次性递增负荷至力竭运动后,本研究中,HE组小鼠骨骼肌Nrf2 mRNA和蛋白表达明显高于WE组,且下游靶基因SOD2及NQO-1 mRNA表达及NQO-1蛋白表达水平也显著高于WE组。这提示,进行一次性力竭运动时,HIF-1α的高表达可以通过促进小鼠骨骼肌Nrf2 mRNA和蛋白表达,使小鼠在高强度的运动下依然可以保持较高的抗氧化能力,使机体免受氧化应激所造成的损伤。
4 结论
适当的HIF-1α高表达不但可提高安静状态下小鼠骨骼肌Nrf2-ARE通路的激活,而且对一次力竭运动后骨骼肌ROS的消除也有积极的调节作用。
[1] 李铁瑛.耐力运动对HIF-1α转基因鼠骨骼肌Nrf2及抗氧化蛋白表达的影响[D]. 北京:北京体育大学, 2016.
[2] 吴丹. HO-1调控Nrf2-ARE信号通路对脑出血后神经保护作用的实验研究[D]. 南昌:南昌大学, 2014.
[3] 杨清滔,谷江,张永春,等. 高表达HIF-lα对肾癌细胞增殖及细胞内STC-1、Ca2+水平的影响[J]. 贵阳医学院学报, 2013, 38(5): 461-464.
[4] AMELN H, GUSTAFSSON T, SUNDBERG78 C J,. Physiological activation of hypoxia inducible factor-1 in human skeletal muscle [J]. FASEB J, 2005, 19(8):1009-1011.
[5] BRINES M. Emerging biological roles for erythropoietin in the nervous system[J]. Nat Rev Neurosci, 2005, 6(6):484-94.
[6] FERICHE B, ARCFA A. Resistance training using different hypoxic training strategies: A basis for hypertrophy and muscle power development [J] . Sports Med Open, 2017, 3(1):12.
[7] GENC K, EGRILMEZ M Y, GENC S. Erythropoietin induces nuclear translocation of Nrf2 and heme oxygenase-1 expression in SH-SY5Y cells[J]. Cell Biochem Funct, 2010, 28(3):197-201.
[8] GIRARD O, BROCHERIE F, MILLET G P. Effects of altitude/hypoxia on single-and multiple-sprint performance: A comprehen-sive review[J]. Sports Med, 2017(6):1-19.
[9] ISHII T, ITOH K, YAMAMOTO M,. Transcription factor Nrf2 coordinately regulates a group of oxidative stress-inducible genes in macrophages [J]. J Biol Chem,2000,275 (21):16023-16029.
[10] KANG K W, LEE S J, PARK J W,. Phosphatidylinositol 3-kinase regulates nuclear translocation of NF-E2-related factor 2 through actin rearrangement in response to oxidative stress[J]. Mol Pharmacol, 2002, 62(5):1001-1010.
[11] KENSLER T W, WAKABAYASHI N, BISWAL S. Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway[J]. Annu Rev Pharmacol Toxicol, 2007, 47(1):89-116.
[12] KUMAR H, CHOI D K. Hypoxia inducible factor pathway and physiological adaptation: A cell survival pathway? [J]. Mediat Inflamm, 2015, 2015(3):1-11.
[13] LUNDE I G, ANTON S L, BRUUSGAARD J C,. Hypoxia inducible factor 1α links fast‐patterned muscle activity and fast muscle phenotype in rats[J]. J Physiol, 2011, 589(6):1443-1454.
[14] MAGESH S, CHEN Y, HU L. Small molecule modulators of Keap1-Nrf2-ARE pathway as potential preventive and therapeutic agents [J]. Med Res Rev, 2012, 32(4): 687-726.
[15] MOI P, CHAN K, ASUNIS I,. Isolation of NF-E2-related factor 2 (Nrf2) , a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/APl repeat of the beta-globin locus control region [J]. Proc Natl Acad Sci USA,1994,91(21):9926-9930.
[16] MUTHUSAMY V R, KANNAN S, SADHAASIVAM K,. Acute exercise stress activates Nrf2/ARE signaling and promotes antioxidant mechanisms in the myocardium [J]. Free Radic Biol Med, 2012, 2(2): 366-376.
[17] NAKASO K, YANO H, FUKUHARA Y,. PI3K is a key molecule in the Nrf2-mediated regulation of antioxidative proteins by hemin in human neuroblastoma cells[J]. Febs Lett, 2003, 546(2):181-184.
[18] O’ROURKE J F, TIAN Y M, RATCLIFFE P J,. Oxygen-regulated and transactivating domains in endothelial PAS protein 1: Comparison with hypoxia-inducible factor-1α[J]. J Biol Chem, 1999, 274(4):2060-2071.
[19] POLOTSKY V Y, SAVRANSKY V, BEVANSFONTI S,. Intermittent and sustained hypoxia induce a similar gene express-ion profile in human aortic; endothelial cells [J]. Physiol Genomic, 2010, 41(3):b306-314.
[20] SALCEDA S, BECK I, SRINIVAS V,. Complex role of protein phosphorylation in gene activation by hypoxia[J]. Kidney Int, 1997, 51(2):556.
[21] WILBER R L. Application of altitude/hypoxic: Training by elite athletes [J]. Med Sci Sports Exerc,2007, 39(9):1610-1624.
[22] ZHANG Y, JI W X, ZHANG L F. Effects of HIF-1α on ERRα/γ protein expression in mouse skeletal muscle [J] Edorium J Biomed Technol, 2015, 25(1):4-10.
[23] ZHANG F, WANG S, ZHANG M,. Pharmacological induction of heme oxygenase-1 by a triterpenoid protects neurons against ischemic injury[J]. Stroke, 2012, 43(5):1390.
[24] ZIPPER L M, MULACHYR T. Erk activation is required for Nrf2 nuclear localization during pyrrolidine dithiocarbamate induction of glutamate cysteine ligase modulatory gene expression in HepG2 cells[J]. Toxicol Sci, 2003, 73(1):124.
Effects of Acute Exhaustive Exercise on the Antioxidant Signal of Nrf2 in Skeletal Muscle of HIF-1α Transgenic Mice
WANG Lin-jia , ZHANG Ying
Beijing Sport University, Beijing 100084,China.
To examine the effect of HIF-1α on Nrf2-ARE antioxidant pathway in mice skeletal muscle after acute exhaustion exercise. Methods: HIF-1α high expression (H) and C57BL/6J mice (W) were used at 20 respectively and each kind of mice were randomly divided into two groups: control (C) and exercise (E). The treadmill exercise was preformed at the acute exhaustion exercise. On the day of acute exercise, mice allocated to perform treadmill running were subject to 5% incline and 5min at 10m/min, and then increased 3m/min every 3 minutes. Mice were sacrificed at the indicated time points following treadmill running.Nrf2, phosphor-Nrf2 (Ser40), nuclear Nrf2 protein were measured by Western Blot and Nrf2-ARE binding activity, the mRNA and proetin levels of Nrf2 target genes, key antioxidant enzymes (SOD1, SOD2, CAT, NQO-1) and ROS level, were also measured in skeletal muscles after the interventions. Results: 1) The results showed that compared with WC, RNA and protein expression level of Nrf2 were increased in HC skeletal muscles. Nrf2-ARE binding activity, Nrf2 target gene SOD1, SOD2, NQO-1 mRNA expression and NQO-1 protein expression were also increased in HC skeletal muscles. Meanwhile, ROS level in HC skeletal muscles decreased significantly. 2) After the acute exhaustion exercise, high HIF-1α expression mice (HE) had higher expression of p-Nrf2 (Ser 40) and nuclear Nrf2 protein than the wide type mice (WE). The mRNA expression of SOD1 and mRNA /protein of NQO-1 in HE increased as well. In contrast, ROS level decreased significantly in HE muscles. Conclusion: The result indicated that the proper high expression of HIF-1α could promote the antioxidant capacity of skeletal muscle in mice through Nrf2-ARE pathway.
G804.7
A
1000-677X(2018)11-0060-06
10.16469/j.css.201811006
2018-08-08;
2018-11-06
国家自然科学基金资助项目(31471134)。
王林佳,女,在读博士研究生,主要研究方向为运动生物化学,E-mail:489499191@qq.com。
张缨,女,教授,博士,博士研究生导师,主要研究方向为运动与骨骼肌代谢, E-mail:zhyi9256@126.com。

