低温胁迫下盐芥和拟南芥蜡质组成及相关基因的表达差异
唐 帅,陈 悦,陈宁美,松布尔巴图,何俊卿,周宜君,徐小静
(中央民族大学 生命与环境科学学院,北京 100081)
暴露在空气中的植物组织表面覆盖了一层脂类物质,这些脂类物质统称为蜡质。此外,蜡质还包括花粉粒、植物地下部分的木栓质基质、愈伤组织以及种皮中的脂类[1]。典型植物的蜡质主要由一系列伯醇、醛、烷烃、脂肪酸、酮和酯类的同系物组成,有时也会含有环状化合物,如三萜类化合物和甾醇[2]。植物表皮蜡质在植物各组织的表皮细胞中合成,然后被分泌到表皮细胞外,形成柱状、棒状、管状、垂直板状、树枝状、伞状等多种形态的蜡质晶体[3]。蜡质合成、分泌途径非常复杂,有多个酶参与其中,估计有几百个基因参与或调控这一过程。超长链脂肪酸的从头合成和延伸是蜡质合成途径的早期步骤[4]。丙二酸羧化生成的丙二酸单酰辅酶 A被脂肪酸合成酶复合物(Fatty acid synthase complex,FAS)催化成C16或C18脂酰链,再由脂肪酸延伸酶 (Fatty acid elongase,FAE)复合体催化其延长为超长链脂肪酸(VLCFAs)。涉及的关键基因有KCS、KCR1、PAS2、CER10、CER2-like[5]等。之后VLCFAs通过酰基还原或脱羰途径被修饰为各种衍生物。CER4编码的脂肪酰-CoA还原酶(Fatty acyl-CoA reductase,FAR)用于初级醇的形成[6]。WSD1负责蜡脂的形成。MAH1氧化酶催化生成仲醇和酮。CER1、CER3/WAX2编码的多蛋白酶复合物是超长链烷烃合成复合物的核心组分,其在烷烃合成中起着重要作用[7]。蜡质的分泌过程尚未明确,但有研究表明,ABC转运蛋白和脂质转移蛋白(LTP)分别涉及蜡质分子从内质网向质膜的运输和其在细胞外的转运[8-11]。另外,还有一些调控基因参与蜡质的代谢过程,包括CER2、CER7、MYB家族[12-13]等。
表皮蜡质在植物抗逆性中起着重要作用[14]。植物蒸腾作用包括气孔性失水和非气孔性失水2个方面,表皮蜡质对植物非气孔失水的控制最为直接,同时,气孔失水由气孔导度控制,表皮蜡质可能也参与这个过程。邓彦斌等[15]研究藜科植物叶片盐生结构发现,在盐胁迫环境中生长的植物叶片表皮蜡质化程度高,表明蜡质参与了植物适应盐环境的过程。蜡质是植物与外界接触的第一层屏障,温度的变化会引起植物表皮蜡质结构和含量的变化。Shepherd等[16]发现,温度的变化能够诱导植物蜡质晶体结构的重组,在高温条件下,晶体的结构形态一般呈现水平方向;而在低温条件下,蜡质晶体的结构形态一般为垂直方向。片层状蜡质晶体的出现能使角质层中的蜡质覆盖度增加,从而减少植物体的水分散失。Ladaniya[17]分别对除去蜡质和不除去蜡质的柑橘(Citrusreticulata)进行低温胁迫,结果显示,保留了蜡质的柑橘受冷害的影响程度低于除去蜡质的柑橘。Dou[18]发现,有蜡质覆盖的葡萄比无蜡质覆盖的葡萄具备更强的低温耐受性。这些研究都表明蜡质与植物对温度的适应相关。
盐芥(Thellungiellasalsuginea)是一种盐生植物,对于高盐[19]、低温[20]、干旱[21]、富含臭氧[22]和缺少氮[23]等极端环境均具有很强的耐受性。盐芥是拟南芥(Arabidopsisthaliana)的同源物种,同样具有基因组小、生活史短、种子丰富和易于被转化等作为实验室研究材料的优点[24]。尽管盐芥与拟南芥在生活史甚至在基因等方面具有统一性,但有研究表明,盐芥的耐盐、抗冷和抗旱能力均远远高于拟南芥。在低温条件下,与拟南芥相比,盐芥膜脂中的溶血磷脂对低温不敏感,磷脂酰胆碱与磷脂酰乙醇胺的比例高,磷脂酸能对低温快速做出响应,这些特征增加了盐芥细胞膜的完整性和稳定性,使盐芥的耐寒性优于拟南芥[25]。王增兰[26]在低盐、中盐、高盐3种溶液浓度下培养盐芥和拟南芥,发现盐芥仅在高盐溶液下生长受到抑制,而拟南芥在3种溶液下生长均受到抑制。Inan等[27]也证实了这一点。
植物响应低温的机制有很多种,如通过分泌一些抗氧化物质、提高保护酶活性来减少活性氧过量积累对细胞产生伤害[28],同时保护酶也可以抑制细胞膜的脂类过氧化反应,减少细胞失水,此外,植物受到低温胁迫时体内的渗透物质如糖、蛋白质、氨基酸也会大量积累[29]。目前,关于盐芥和拟南芥2种模式植物的蜡质成分、含量以及相关基因对低温的响应对比鲜有报道,鉴于此,以盐芥和拟南芥为材料,探讨了低温条件下2种植物的蜡质组成、含量以及相关基因的变化差异,旨在揭示参与植物抗寒的关键蜡质成分和基因,进一步理解植物表皮蜡质与低温的作用机制。
1 材料和方法
1.1 植物的培养和处理
盐芥和拟南芥材料的种子均为中央民族大学植物分子生物学实验室保存。种子种植前进行春化处理(拟南芥3 d,盐芥7 d)。将春化处理过的种子均匀播撒在含有蛭石与土等比混合的花盆里,并用塑料薄膜覆盖3 d,培养条件为光周期12 h、温度22 ℃、光照强度100 μmol/(m2·s)、空气湿度为30%~60%,每4 d浇一次营养液。拟南芥和盐芥长至4个叶片时,选取长势健康、大小相似的幼苗移栽入蛭石中,每盆4株,在上述培养条件下继续培养。拟南芥生长4 周,盐芥生长6周后,将长势和形态良好且一致的植株平均分成2组进行温度处理,分别为4 ℃(低温胁迫)和22 ℃(CK),培养条件同上,2个处理其他培养条件一致。温度处理1 周后,对CK组和低温胁迫处理组的拟南芥和盐芥进行取样测定叶表皮蜡组分及含量,每3株植物为1个重复,每个重复为生长状态一致性高的莲座叶叶片20~30片,每处理6个重复。
1.2 植物叶片表皮蜡质组分含量测定
依据Chen等[30]的方法对叶片表皮蜡质含量进行测定。将叶片浸泡在正己烷中30 s,在氮气下吹干浸泡过叶片的正己烷,加入50 μL N,O-双(三甲基硅烷)三氟乙酰胺(BSTFA),在100 ℃金属浴中衍生化15 min,再次氮气吹干,加入200 μL正己烷,转移至上样瓶,利用气相色谱-质谱法(GC-MS)进行蜡质含量及组分鉴定、分析。气相色谱仪(Gas Chromatography)设置的程序条件为:进样口和检测器温度设定为320 ℃;柱箱初始温度为80 ℃,停留2 min,以15 ℃/min的速率升温至260 ℃,停留10 min,以5 ℃/min的速率升温至320 ℃,保留24 min。GC气相色谱仪使用的是30 m,0.25 mm HP-5MS毛细管柱,载气为氮气。
1.3 总RNA的提取和mRNA的反转录
CK组和低温度胁迫试验组处理24 h后,每种植物取中部的莲座叶提取RNA。总RNA的提取和cDNA的制备分别使用北京全式金生物技术有限公司EasyPure®Plant RNA Kit,TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒,具体操作详见试剂盒说明书。
1.4 实时荧光定量PCR分析(qRT-PCR)
在NCBI网站(https://www.ncbi.nlm.nih.gov/)中对已报道的拟南芥蜡质相关基因cDNA进行检索,同时利用拟南芥蜡质相关基因序列对盐芥蜡质相关基因的cDNA或ESTs进行同源搜索。本试验检索并进行试验的28个蜡质相关的基因分别为:CER10/ECR、CER2、KCR1、KCS1、KCS10/FDH1、LACS1/CER8、LACS2、PAS2/HCD、PAS3/ACC1、FAR1、FAR3/CER4、WSD1、CER1、CER3/WAX2、ABCG11、ABCG12/CER5、LTPG1、MYB30、MYB94、MYB96/EsWAX1、SHN1/WIN1、SHN2、SHN3、WRI1、DEWAX、HDG1、CER9、BDG。用Primer 5对所得的cDNA或ESTs序列设计引物。先通过普通PCR对设计的引物进行扩增反应,然后将产物进行琼脂糖凝胶电泳,之后通过观察凝胶成像后的条带情况判断引物是否具有特异性。通过检验的引物则用于接下来的qRT-PCR程序。使用管家基因UBQ5作为内参基因,其上、下游引物分别为TsAtUBQ5 P1[5′-CAACCCTAACGGGGAAGAC-3′]、TsAtUBQ5 P2[5′-CCCGTCTTCTTCTTCCTCTTC-3′]。荧光定量PCR反应程序为:94 ℃预变性30 s;94 ℃ 5 s,60 ℃ 15 s,72 ℃ 10 s,循环40次。反应体系体积为10 μL,包括cDNA 1 μL、上/下游引物各 0.2 μL、2×TransStart®Top Green qPCR SuperMix(北京全式金生物技术有限公司) 5 μL、ddH2O 3.6 μL。使用Bio-Rad MyIQ2 完成数据采集和分析。采用基因表达相对定量分析,将对照样本的基因表达量设为1,处理样本中的基因表达量用2-△△Ct表示[31],以计算在不同处理组下基因的表达量,其中每个处理重复3次,每次重复每个基因3个平行。使用t检验进行差异显著性分析。
1.5 数据分析
采用Excel 对数据进行计算分析(包括方差分析及显著性检验等)。用Origin和Excel进行制图。通过Image J软件计算叶面积。
2 结果与分析
2.1 低温对盐芥和拟南芥叶片表皮蜡质组分含量及比例的影响
由图1可见,盐芥和拟南芥叶片表皮蜡质主要由烷烃、初级醇、脂肪酸、醛、酮5类物质组成,其中,烷烃、初级醇含量较高,脂肪酸、酮和醛的含量较少。4 ℃低温胁迫处理后盐芥和拟南芥的叶片表皮蜡质总量均较CK极显著增加,盐芥叶片表皮蜡质总量增加22.84 μg/dm2,增幅为47.66%,拟南芥叶片表皮蜡质总量增加17.31 μg/dm2,增幅为49.06%。盐芥和拟南芥表皮蜡质总量的增加主要是由于单位叶面积烷烃含量的绝对增加,2种植物分别增加了19.16 μg/dm2和14.06 μg/dm2,分别占各自总蜡质增加量的83.9%和80.2%。
4 ℃低温胁迫处理后,盐芥和拟南芥叶片表皮蜡质各组分含量均较CK增加。其中,盐芥叶片表皮蜡质组分中除了脂肪酸有微量增加外,烷烃、醛、初级醇和酮含量分别极显著增加49.68%、 231.76%、50.05%和103.41%;拟南芥叶片表皮蜡质组分中,烷烃、脂肪酸、醛、初级醇和酮含量分别极显著增加54.34%、29.61%、54.40%、24.07%和137.80%。
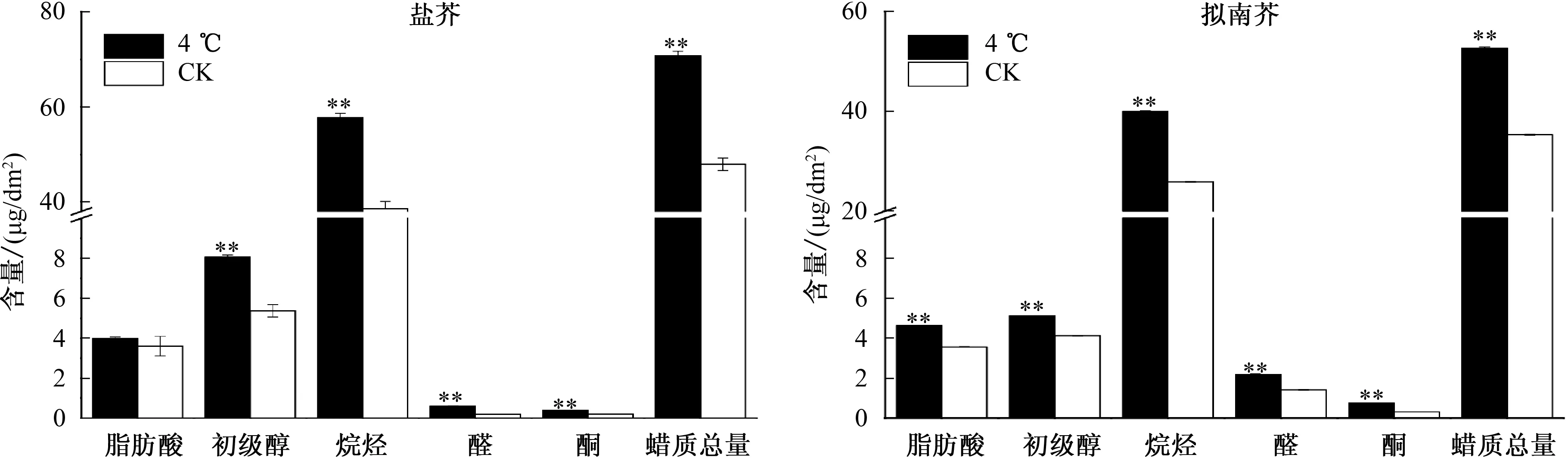
*、**分别表示低温处理与CK 在0.05、0.01水平上差异显著、极显著,下同
由图2可见,不同碳链长度的烷烃中,C29、C31和C33烷烃含量较高,低温胁迫后盐芥和拟南芥叶片表皮蜡质总量的增加主要是烷烃含量增加,而C29、C31和C33烷烃含量的大幅增加是烷烃增加的主要原因。低温胁迫后,盐芥所有烷烃含量均较CK增加,特别是C25、C28烷烃含量增加最多,分别极显著增加260.17%、122.63%;拟南芥除了C26烷烃含量较CK减少,其余烷烃组分含量均增加。就脂肪酸而言,低温胁迫后,盐芥C22、C24、C28和C30脂肪酸含量均较CK极显著或者显著增加,而C26脂肪酸含量减少;拟南芥中所有脂肪酸成分含量均较CK增加。就初级醇、酮和醛而言,低温胁迫后,盐芥和拟南芥不同碳链长度的初级醇、酮和醛含量均较CK增加,其中,盐芥中C24初级醇、C30醛增加最多;拟南芥中C24初级醇、C24醛增加最多。
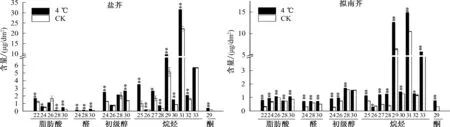
横坐标上的数字表示碳链长度;分别表示低温处理与CK在0.05、0.01水平上差异显著、极显著
从图3可见,盐芥和拟南芥叶片表皮蜡质组分中,烷烃、初级醇、脂肪酸均是优势组分,其中,4 ℃处理的盐芥中,3种组分含量分别占叶片表皮总蜡质含量的81.59%、11.39%、5.62%,CK组盐芥中,三者分别占80.51%、11.21%、7.51%;4 ℃处理的拟南芥中,三者分别占75.95%、9.71%、8.76%,CK组拟南芥中,三者分别占73.34%、11.67%、10.09%。可见,无论盐芥还是拟南芥,4 ℃低温胁迫后,叶片表皮蜡质成分比例与CK组相比没有明显改变。
2.2 低温对盐芥和拟南芥叶片表皮蜡质相关基因表达的影响
通过荧光定量PCR技术检测低温胁迫处理下盐芥和拟南芥叶片中蜡质相关基因的相对表达量,结果见图4。由图4可见,几种蜡质相关基因对温度的响应非常明显。在28个蜡质相关基因中,4 ℃胁迫处理下的盐芥有23个基因表达量较CK增加,特别是KCR1、KCS1、LACS1/CER8、WSD1、CER1、LTPG1、SHN1/WIN1、HDG1、CER9和BDG表达量增加超过4倍;4 ℃胁迫处理下的拟南芥仅有13个基因表现出表达量增加,包括CER10/ECR、KCR1、LACS1/CER8、PAS3/ACC1、CER1、CER3/WAX2、ABCG11、LTPG1、MYB94、MYB96/EsWAX1、SHN3、HDG1和CER9。盐芥和拟南芥的低温胁迫组中PAS2/HCD、FAR1、MYB30、SHN2、DEWAX基因表达量较CK组有明显较低的表达量,特别是DEWAX,无论在盐芥中还是在拟南芥中,其表达量甚至低于CK组10倍以上。
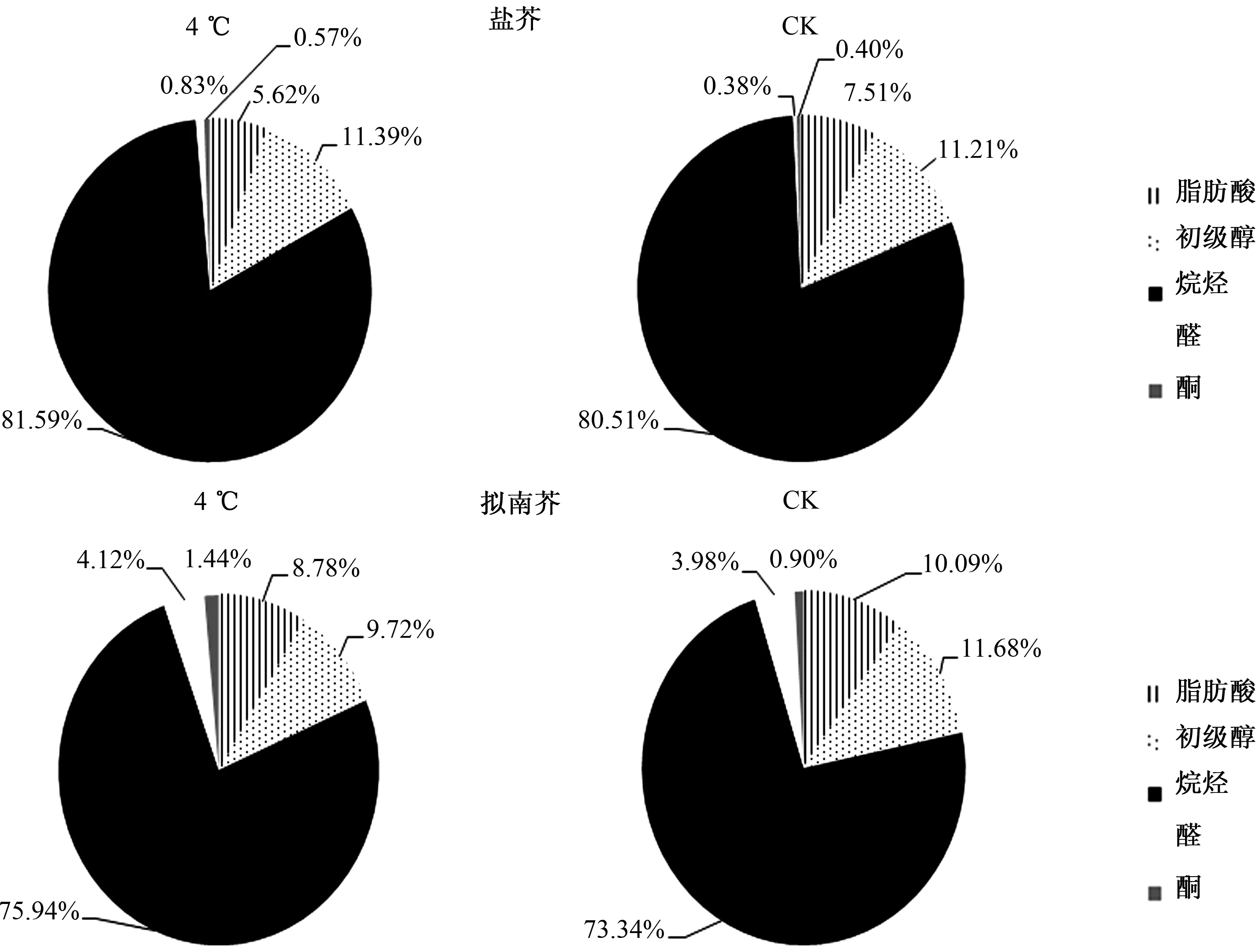
图3 4 ℃胁迫下盐芥和拟南芥叶片表皮蜡质组分比例
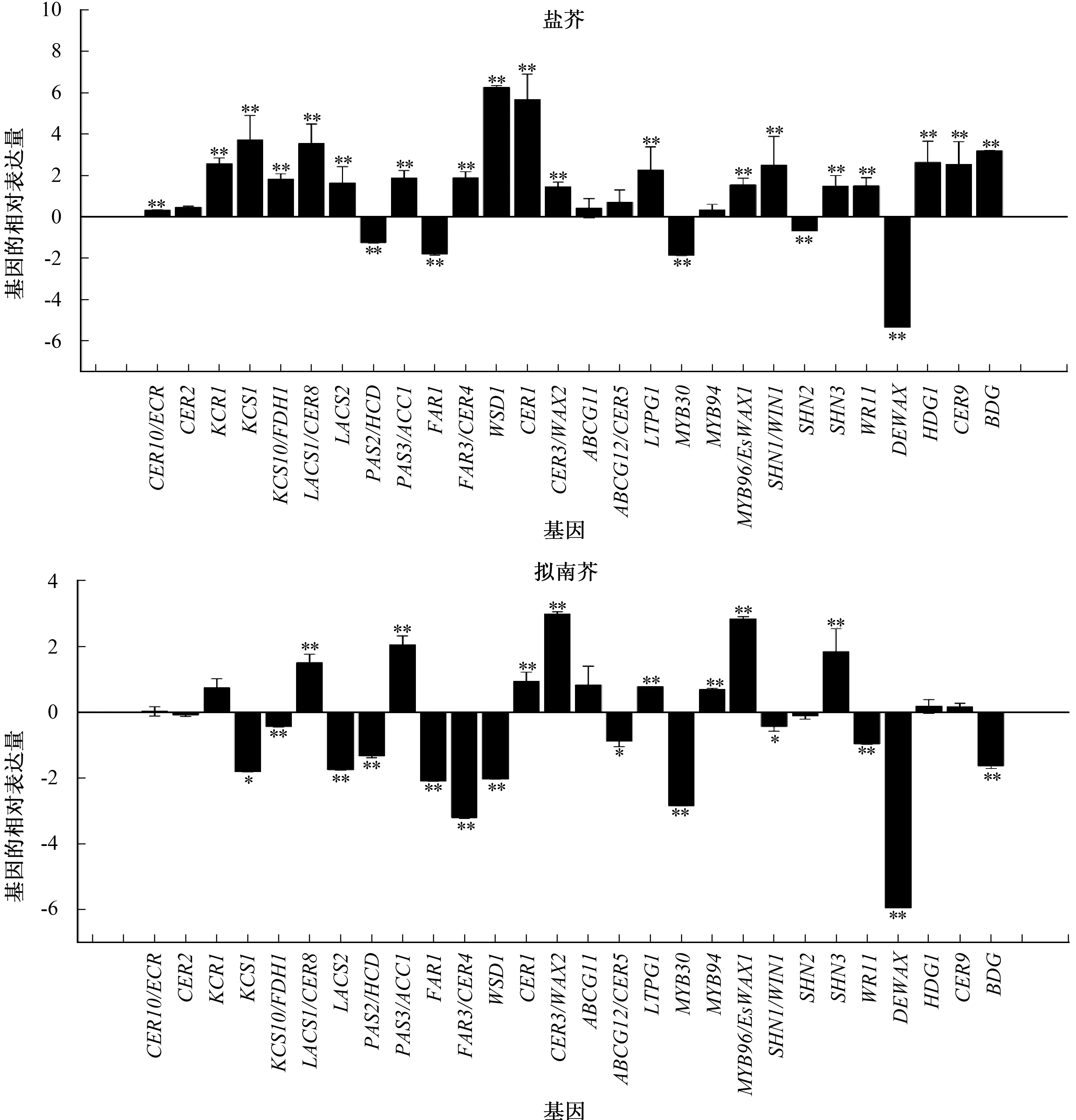
*、**分别表示低温处理与CK 在0.05、0.01水平差异显著、极显著;数据是3次试验的平均数并以log2的形式表示
3 结论与讨论
表皮蜡质是植物响应和抵抗生物、非生物胁迫的重要屏障。拟南芥在干旱和渗透胁迫下有大量的蜡质积累[32]。对比拟南芥野生型与蜡质合成酶缺失型对土壤缺水的响应发现,蜡质总量与抗旱性呈正相关[33-35]。植物表皮可通过调节表皮渗透性来抵抗水分的缺失。有研究表明,蜡质缺失突变体的表皮渗透性增加,渗透性会随蜡质总量的增加而减少[31-32]。蜡质与烟草(Nicotianaglauca)、芝麻(Sesamumindicum)、黄豆(Glycinemax)和现代月季(Rosahybrida)等很多植物抵抗水分缺失有关[36-39]。在本次研究中,低温胁迫处理后的盐芥和拟南芥叶片单位面积蜡质含量均增加,也证实蜡质在植物抗逆性中具有重要作用。
Kosma等[32]发现,在几乎所有非生物胁迫中,拟南芥表皮蜡质总含量的增加都伴随着烷烃的增加,Xu等[2]关于胡杨蜡质的研究也有类似的现象。本研究中,拟南芥低温胁迫处理后,烷烃的增加量占总蜡质增加量的80.2%;盐芥低温胁迫处理后,烷烃的增加量占总蜡质增加量的83.9%,表明烷烃在植物表皮对低温胁迫的响应中起着重要作用。
研究基因转录水平的变化有利于了解低温下蜡质代谢相关基因的表达变化情况,从而探究植物表皮蜡质对低温胁迫的应答。蜡质代谢基因涉及蜡质合成、运输和调控3个方面[40]。本研究挑选这3个过程中有代表性的蜡质代谢基因探究低温胁迫下其表达模式,结果表明,这些基因中的大部分在低温胁迫处理的盐芥中表达量都上调,如KCR1、KCS1、CER1、CER3/WAX2、ABCG11、ABCG12/CER5、MYB94、MYB96/EsWAX1等。CER1和CER3/WAX2编码的蛋白质共同参与烷烃的合成[7],二者基因表达量上调与烷烃含量升高相一致。KCR1、KCS1编码的延伸酶复合物亚基负责蜡质代谢的早期步骤。低温条件下延伸酶相关基因的表达量提高,这与海岸松(PinuspinasterAit.)在干旱胁迫下也表现出延伸酶相关基因表达量高诱导[41]类似,暗示植物可能通过激活蜡质代谢途径适应恶劣环境。ABCG11和ABCG12/CER5负责蜡质的转运,在将蜡质从内质网穿过质膜运输到细胞外的过程中发挥重要作用[42]。本试验结果中,低温胁迫处理下盐芥这2个基因表达量上调。
低温胁迫处理下,拟南芥叶片表皮蜡质化学成分及含量的变化趋势与盐芥类似,但从基因表达水平分析发现,低温胁迫处理下盐芥中大部分蜡质代谢基因表达量上调,而拟南芥中很多基因出现表达量下调趋势,但有些蜡质代谢关键基因也表现出上调,如CER10/ECR、KCR1、LACS1/CER8、PAS3/ACC1、CER1、CER3/WAX2、ABCG11、MYB94、MYB96/EsWAX1等,这些基因可能与蜡质化学成分含量的升高密切相关。
转录因子或调控蛋白在植物响应和适应环境变化中扮演重要角色[43-44]。MYB94、MYB96和CER9均已被证实与干旱条件下诱导植物产生蜡质有关[35,45-46]。本研究中,MYB94、MYB96/EsWAX1和CER9的表达量在低温胁迫处理的盐芥和拟南芥中都上调,暗示这3个基因不仅与植物抗旱性有关而且在抗寒性方面也发挥作用。Xu等[2]之前报道过,盐芥的2种生态型(Shandong型和Yukon型)在缺水条件下表皮蜡质相关基因表达量均上调[47],暗示这可能是盐芥响应逆境的普遍机制。拟南芥的抗逆性不及盐芥,对温度比较敏感,其蜡质相关基因在低温条件下出现多种响应方式,也表明拟南芥和盐芥对环境有不同的适应机制。
本研究比较了盐芥和拟南芥在响应低温胁迫中叶片表皮蜡质的组成变化及蜡质代谢相关基因的表达变化。结果显示,2种植物在低温胁迫下蜡质的组成成分及含量的变化趋势类似。4 ℃低温胁迫处理后,盐芥和拟南芥叶片表皮蜡质各组分总含量均较CK增加,且2种植物的优势组分与CK相比均未发生变化。但2种植物蜡质代谢基因对低温的响应存在明显差异,28个蜡质代谢基因的表达量变化显示,盐芥中有23个基因上调,拟南芥中有13个基因上调,表明拟南芥和盐芥在分子方面对环境有不同的适应机制。

