新发猪圆环病毒3型Cap蛋白的原核表达和纯化
连凯琪,周玲玲,张明亮,王英杰,张 慢,宋玉伟
(安阳工学院 生物与食品工程学院/河南省动物疫病防控与营养免疫院士工作站/河南省兽用生物制品研发与应用国际联合实验室,河南 安阳 455000)
猪圆环病毒(Porcine circoviruses, PCV)是一种无囊膜的单股环状负链的DNA病毒,属于圆环病毒科圆环病毒属[1]。2016年以前,在猪群中仅发现PCV-1和PCV-2两个基因型。其中,PCV-1对猪无致病性,而PCV-2在猪场能引起呼吸、繁殖、消化等多系统症状,对养猪业造成了重大的经济损失[2-3]。2016年,美国学者从患病母猪及流产胎儿体内鉴定并命名了一种新发猪圆环病毒3型(PCV-3)[4]。此后,多个国家均报道了PCV-3的感染病例,我国科研人员也相继检测到PCV-3,已有至少13个省猪场存在PCV-3感染,且主要分布于中东部地区[5-6]。波兰、韩国、泰国等也报道了猪群中存在PCV-3感染[7-8]。PCV-3的基因组长约2 000 bp,目前,只有2个开放阅读框ORF1(Rep)和ORF2(Cap)被鉴定[5,9]。与PCV-2相似,Rep蛋白主要参与病毒复制,Cap蛋白为PCV-3唯一的病毒衣壳蛋白[10]。PCV-2的Cap蛋白基因工程亚单位疫苗已经被广泛应用,且Cap蛋白也被用于开发成抗体检测试剂盒。因此,Cap蛋白成为PCV-3生产基因工程亚单位疫苗和诊断类试剂盒的首要候选抗原。
目前,关于PCV-3 Cap蛋白的研究还比较少,有学者使用原核表达系统表达了PCV-3 Cap蛋白或部分Cap蛋白,但都没有详细的报道,且表达量不高。PCV-3 Cap蛋白原核表达后主要用于制备单克隆抗体或开发抗体诊断方法方面,尚未见利用Cap蛋白制备基因工程亚单位疫苗的报道[11-12]。本研究拟通过高效表达Cap蛋白,以期为进一步规模化表达PCV-3 Cap蛋白、开发基因工程亚单位疫苗等研究奠定基础。
1 材料和方法
1.1 质粒与菌株
质粒pMD18-T-Cap、pET30a(+)载体、大肠杆菌DH5α菌种和BL21 ( DE3)菌种由河南省动物疫病防控与营养免疫院士工作站实验室保存。
1.2 试剂
限制性内切酶BamH Ⅰ和Hind Ⅲ、T4 DNA连接酶、DL2000 DNA Marker、DL15000 DNA Marker、Premix rTaq均购自大连宝生物工程有限公司;酵母抽提物、胰蛋白胨、异丙基硫代半乳糖苷(IPTG)购自Solarbio生物公司;胶回收试剂盒和质粒提取试剂盒均购自Omega Bio-tek公司;辣根过氧化物酶(HRP)标记的抗His标签鼠单克隆抗体购自康为世纪生物科技有限公司;蛋白质Marker(ml016140)购自上海酶联生物科技有限公司;预染蛋白质Marker(22617)购自Thermo pierce公司。
1.3 PCV-3 Cap136—645基因的克隆
根据测得的PCV-3(MH683051)全基因序列,设计引物并引入2个酶切位点和保护碱基,Cap136—645-F:CGCGGATCCATGAACGTCATATCCGTTG (下划线部分为BamH Ⅰ酶切位点),Cap136—645-R:TCCCAAGCTTGAGAACGGACTTGTAAC(下划线部分为Hind Ⅲ酶切位点),该对引物扩增片段大小约为528 bp,引物由金维智生物科技有限公司合成。 PCR反应体系为50 μL,其中:Premix rTaq 25 μL,上、下游引物(10 pmol/L)各1 μL,质粒pMD18-T-Cap模板2 μL,用灭菌蒸馏水补足50 μL。反应条件为:95 ℃ 4 min; 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s,共40个循环; 72 ℃ 延伸8 min。PCR扩增产物经1%琼脂糖凝胶电泳后切胶纯化。
1.4 重组质粒pET30a(+)-Cap136—645的构建
将纯化的Cap136—645基因片段经BamH Ⅰ和Hind Ⅲ双酶切后回收,定向插入表达载体pET30a(+)中,构建重组质粒,转化至大肠杆菌DH5α感受态细胞,37 ℃温箱培养过夜,挑取单克隆菌落于37 ℃摇菌12~14 h,提取质粒,将PCR和双酶切鉴定为阳性的质粒送至金维智生物科技有限公司测序。
1.5 重组Cap136—645蛋白的表达
将重组质粒pET30a(+)-Cap136—645转化至E.coliBL21 (DE3),涂布含有卡那霉素的LB琼脂平板,37 ℃温箱培养过夜,挑取单克隆菌落于37 ℃摇菌过夜,将菌液分别按1∶100比例接种含有卡那霉素的LB培养液,37 ℃振荡培养3 h后,将每管菌液平均分成2管,一管加入IPTG至终浓度为0.5 mmol/L,另一管不加IPTG作为对照,同时将pET30a(+)转化至E.coliBL21 (DE3)感受态细胞作为阴性对照。将IPTG组和对照组菌液都放入37 ℃继续振荡培养6 h,然后12 000 r/min离心1 min,弃上清,用PBS重悬菌体沉淀,取80 μL加入20 μL 5×Loading Buffer沸水煮10 min制备样品,进行SDS-PAGE分析。
1.6 重组Cap136—645蛋白的Western blot鉴定
将1.5中的诱导菌进行SDS-PAGE电泳后湿转至硝酸纤维素膜上,使用1∶2 000倍稀释的辣根过氧化物酶(HRP)标记的抗His标签鼠单克隆抗体孵育,对重组蛋白进行Western blot分析。
1.7 重组Cap136—645蛋白的可溶性表达分析
将1.5中过夜培养的菌液按1∶100接种于100 mL含卡那霉素的培养液中,37 ℃振荡培养4 h,分别加入IPTG至终浓度为1 mmol/L,置于25 ℃继续振荡培养6 h,然后12 000 r/min离心1 min,弃上清,用PBS重悬菌体沉淀洗2次,加入10 mL PBS重悬沉淀后置于冰上进行超声破碎,工作3 s,间歇3 s,共30 min,将破碎后的菌液12 000 r/min离心10 min,取上清液80 μL,用100 μL PBS重悬沉淀后也取80 μL,分别加入20 μL 5×Loading Buffer沸水煮10 min制备样品,进行SDS-PAGE分析。
1.8 重组Cap136—645蛋白的纯化
按照参考文献[13-14]中的KCl染色切胶纯化的方法,对包涵体表达的重组Cap136—645蛋白进行纯化,然后通过SDS-PAGE对纯化的重组蛋白进行分析。
2 结果与分析
2.1 PCV-3 Cap136—645基因的克隆结果
以质粒pMD18-T-Cap为模板,通过PCR方法成功克隆到豫北PCV-3毒株(GenBank登录号MH683051)的Cap136—645基因,长度为528 bp(图1)。
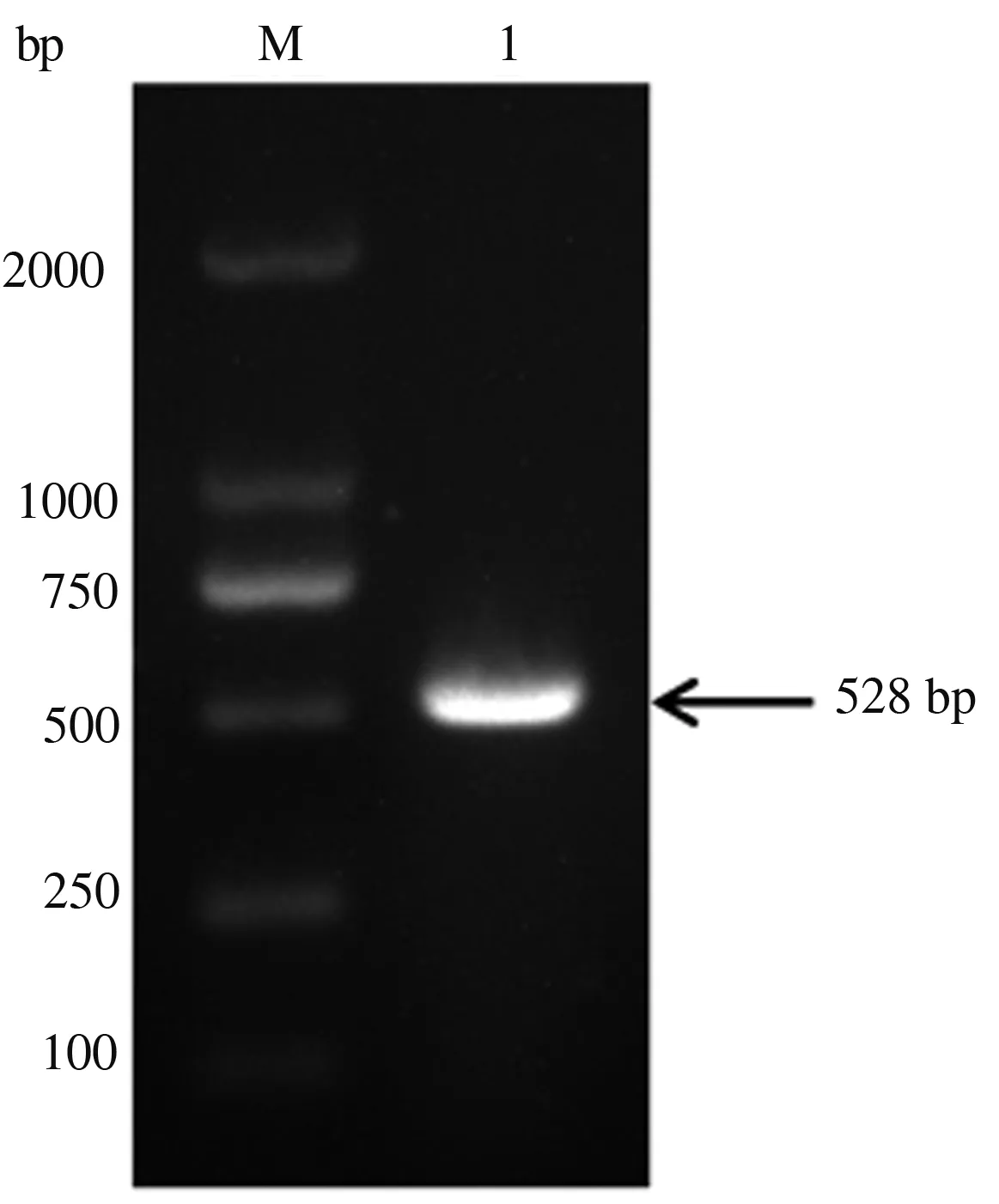
M.DL2000 DNA Marker; 1.PCR扩增产物
2.2 重组质粒pET30a(+)-Cap136—645的鉴定结果
将重组质粒pET30a(+)-Cap136—645分别用PCR扩增和双酶切鉴定,经琼脂糖凝胶电泳后,结果显示,PCR扩增条带单一,大小约528 bp,BamH Ⅰ和Hind Ⅲ双酶切也出现1条大小约528 bp的条带(图2)。测序结果进一步证实,重组质粒pET30a(+)-Cap136—645构建成功。
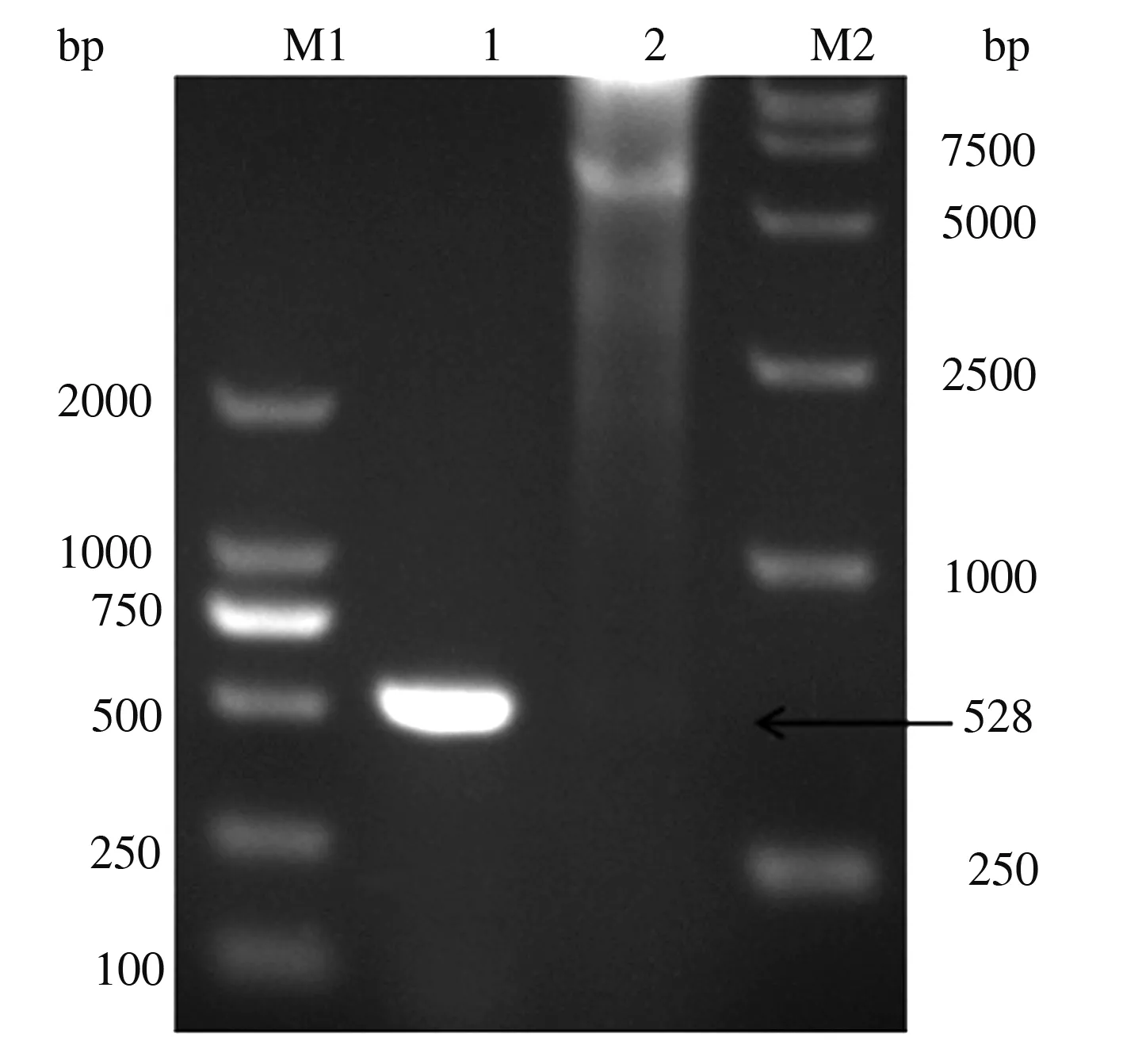
M1.DL2000 DNA Marker; M2.DL15000 DNA Marker;
2.3 Cap136—645蛋白的诱导表达结果
将鉴定正确的重组质粒pET30a(+)-Cap136—645转化至E.coliBL21 (DE3)感受态细胞,在IPTG浓度为0.5 mmol /L的条件下诱导表达Cap136—645蛋白,收集菌液进行SDS-PAGE检测,可见分子质量约27.5 ku的特异性蛋白条带,pET30a(+)空载体表达对照组没有出现目的条带(图3)。
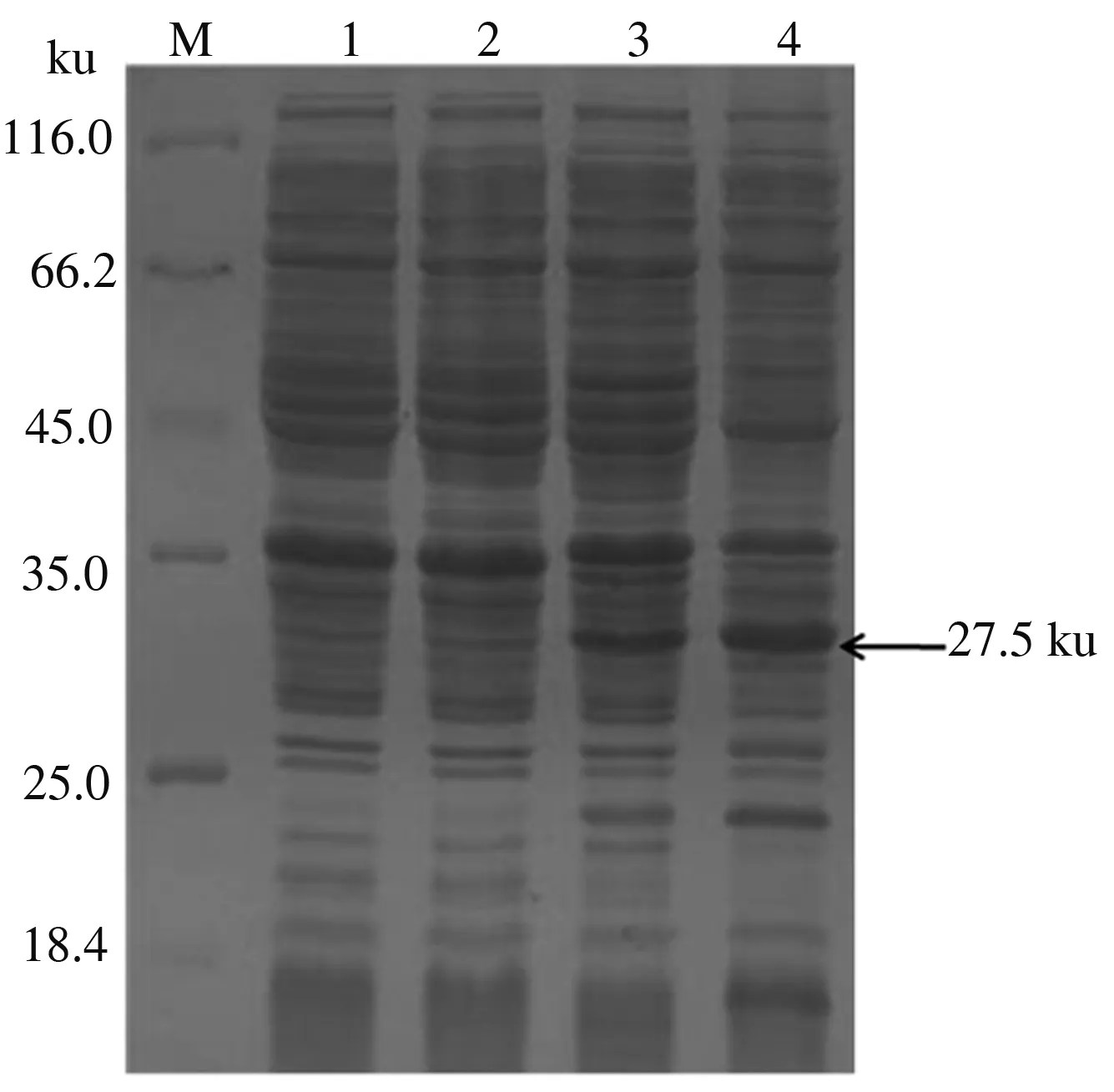
M.蛋白质Marker;1.pET30a(+)未诱导;2.pET30a(+)诱导;
2.4 重组Cap136—645蛋白的Western blot鉴定结果
Western blot结果表明,诱导菌在约27.5 ku的位置出现了明显的条带(图4),与SDS-PAGE电泳中特异性表达的条带位置相符,表明成功表达了重组Cap136—645蛋白。
M.预染蛋白质Marker; 1.pET30a(+)-Cap136—645的诱导菌液;
2.5 重组Cap136—645蛋白可溶性表达分析结果
重组质粒pET30a(+)-Cap136—645转化的E.coliBL21 (DE3) 感受态细胞在IPTG终浓度为1 mmol/L、25 ℃条件下诱导表达6 h时,重组Cap136—645蛋白以包涵体形式大量表达(图5)。
2.6 重组Cap136—645蛋白的纯化结果
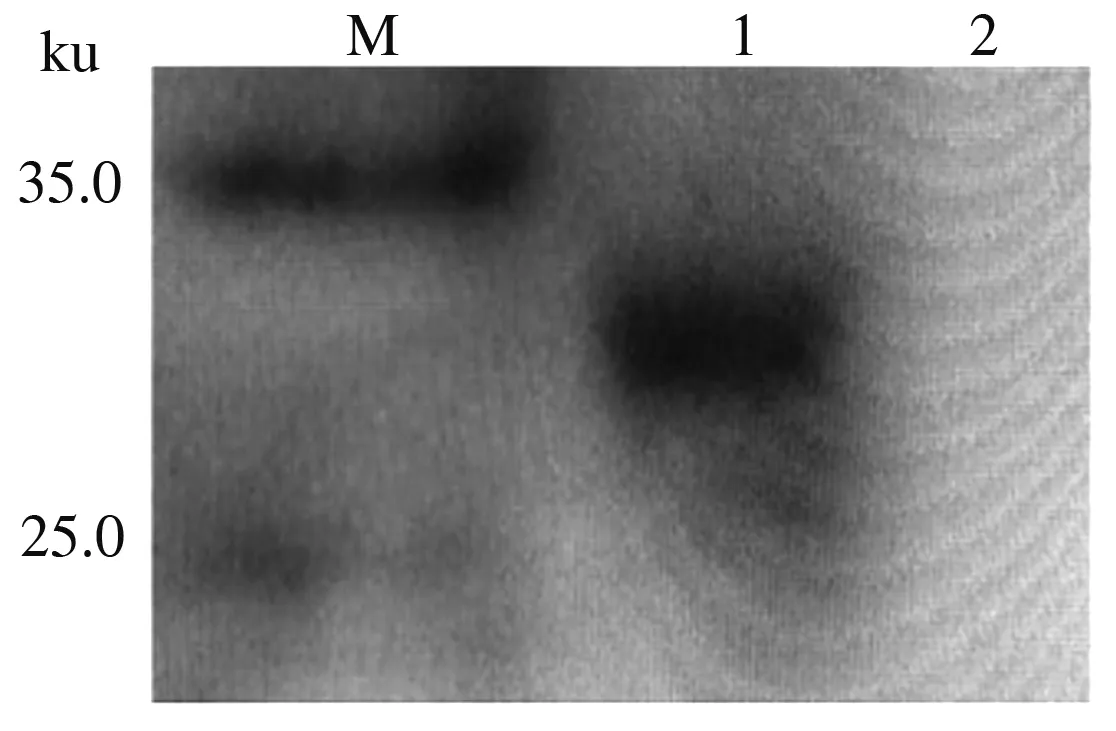
将切胶回收的产物进行SDS-PAGE电泳,结果表明,纯化的蛋白质在约27.5 ku的位置出现了条带(图6)。测定结果显示,纯化的蛋白质质量浓度高达1.28 μg/μL。
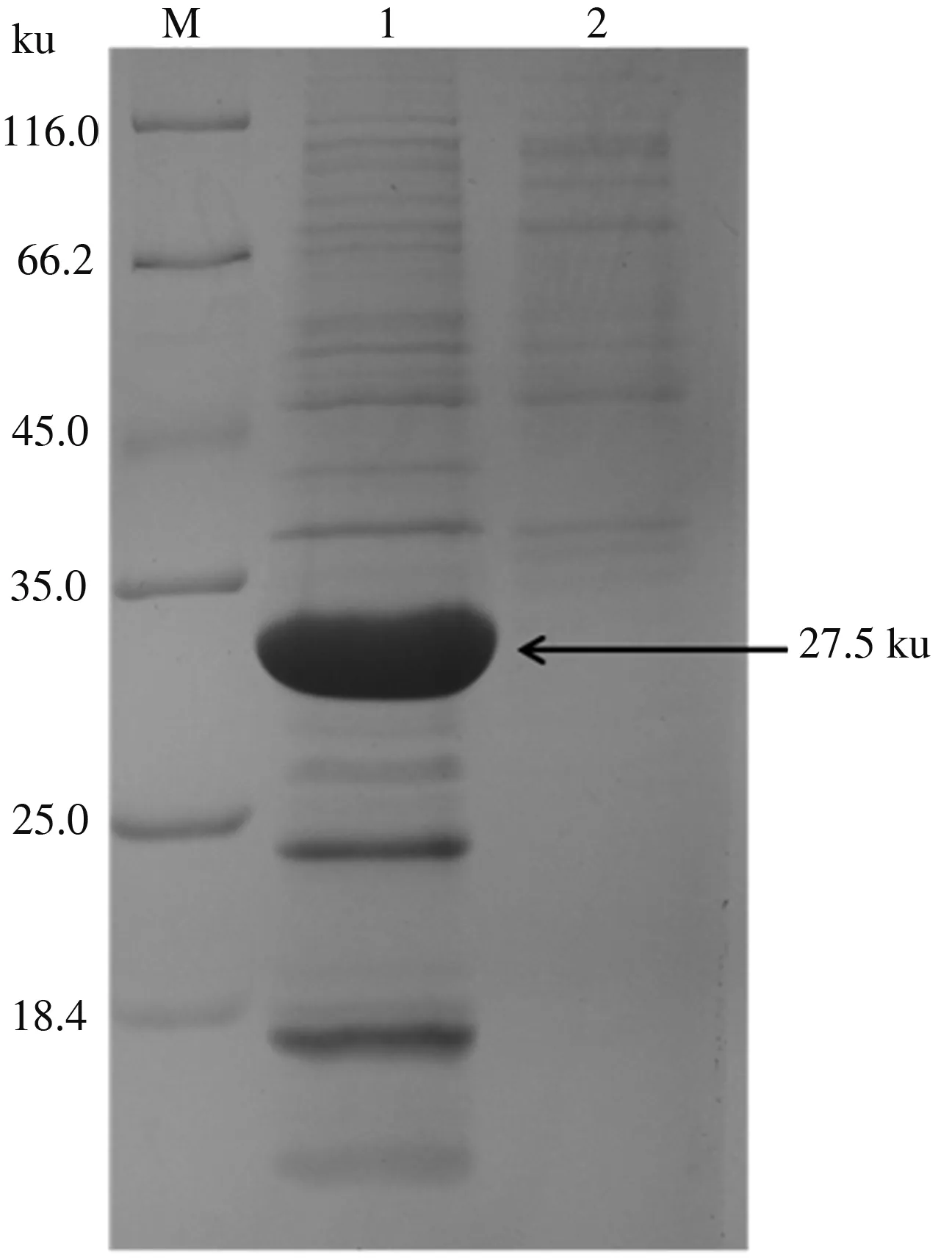
M.蛋白质Marker;1.菌体超声破碎沉淀;2.菌体超声破碎上清
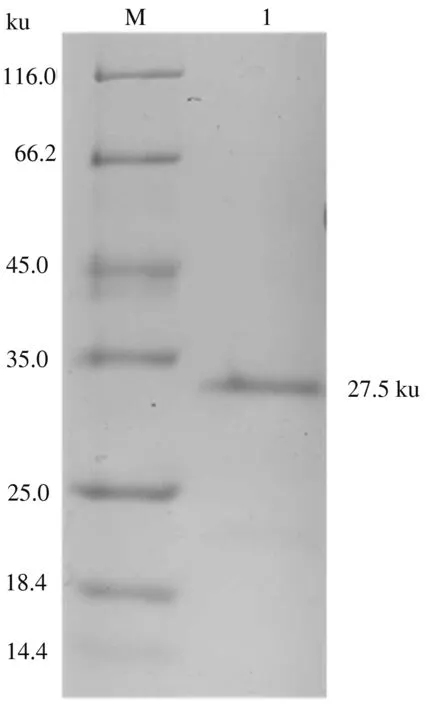
M.蛋白质Marker;1.蛋白质纯化产物
3 结论与讨论
目前,关于新发猪PCV-3的来源尚不清楚、典型的临床症状尚不明确、分离和培养技术还未成熟、致病机制的相关研究更少,PCV-3的研究主要集中于流行病学、诊断方法等方面。PCV-3作为新发猪病毒病,急需安全可靠的疫苗进行免疫防控,以及诊断类生物制品进行病原诊断与抗体评价。鉴于Cap蛋白在PCV-3的疫苗开发和诊断类生物制品研发中所起的重要作用。本研究在大肠杆菌表达系统对部分PCV-3 Cap蛋白片段进行表达优化,实现高效表达,制备纯度较高的Cap蛋白。
PCV-3 Cap蛋白在N端含有核定位信号序列,很难实现整个基因的体外表达。本文首先克隆了PCV-3的部分Cap基因(136—645位),并构建了原核表达质粒pET30a(+)-Cap136—645。重组质粒导入E.coliBL21 (DE3)后进行了表达条件优化,确定在1 mmol/L IPTG、25 ℃条件下诱导表达6 h时,重组Cap136—645蛋白实现了高效体外表达。最后,鉴定该融合蛋白主要以包涵体形式表达,并通过切胶进行了纯化。Deng等[12]曾表达并纯化了部分Cap蛋白片段。与其相比,本研究纯化的目的蛋白纯度较高,在后续的研究中降低了杂蛋白的影响。
本研究对重组PCV-3 Cap136-645蛋白进行了原核表达并纯化,为后续开发PCV-3抗体诊断试剂盒、制备Cap的单抗或多抗、研发PCV-3基因工程亚单位疫苗等提供基础和抗原材料。
——一道江苏高考题的奥秘解读和拓展

