同步荧光法探究硝苯地平与胃蛋白酶荧光基团的作用机制
马丽花, 刘保生, 边 刚, 王春丹, 张红彩, 程 旭
(河北大学化学与环境学院 河北省分析科学技术重点实验室, 河北 保定 071002)
1 引 言
目前探究药物与蛋白反应机理的方法主要考察激发波长280,295 nm处随着药物浓度改变蛋白荧光猝灭的情况,是研究药物与蛋白的整体作用[1]。同步荧光法兼具良好选择性、高灵敏度、窄化谱带和减小散射干扰等优点[2]。在药物与蛋白反应机理的研究中,同步荧光法主要用于通过同步荧光峰的位移情况[3]考察蛋白构象的变化。而通过控制发射波长与激发波长差,利用同步荧光法来研究药物分别与蛋白分子中酪氨酸残基(Tyr)和色氨酸残基(Trp)的相互作用机理、荧光猝灭比率份数、结合率、结合模型等,进而在更深层次上揭示药物分子和蛋白反应机制的研究尚未见报道。考察药物与蛋白中Tyr和Trp的反应机理对于更加深入地研究药物的药理、药效等有着重要的意义,同时Tyr和Trp含量的变化也可以揭示某些重大疾病的发生与发展情况。有研究表明,肿瘤病人血浆里游离Tyr和Trp的含量减少和肿瘤恶化情况有关[4],二者可能在人体组织病变中产生了变化。该研究对于治疗恶性肿瘤靶向药物的开发及其药理、毒理等的研究,也具有一定的指导意义。
硝苯地平(NDP)又称尼非地平、利血平等,是二氢吡啶类钙通道阻滞剂的代表,多用于预防和治疗心绞痛和冠心病,对于各种类型的高血压均有较好的疗效[5]。胃蛋白酶(PEP)为人体内主要的消化酶,主要存在于胃液中。当NDP被口服后,与胃蛋白酶的结合可能会影响药物的浓度[6]及PEP的游离浓度。胃蛋白酶与多种药物的相互作用已有相关报道[7],但尚未见与NDP之间相互作用的研究,本文以同步荧光法研究了NDP与PEP之间的相互作用,以期为蛋白与药物结合的研究和NDP临床用药的把控提供更直观细致的参考。
2 实 验
2.1 仪器与试剂
实验试剂:胃蛋白酶(PEP,纯度≥99%,Sigma公司) 储备液5.0×10-5mol/L;硝苯地平(NDP,纯度>99.8%)用少量无水乙醇溶解,以二次水配成1.15×10-4mol/L储备液;pH=2.0的HAC-NaAc缓冲溶液(含0.10 mol/L NaCl)。实验用水皆为二次石英蒸馏水,以上储备液于4 ℃下避光保存。
实验仪器:岛津RF-5301PC荧光分光光度计(配有1 cm宽度石英比色皿)与UV-3600紫外分光光度计; SYC-15B超级恒温水浴;SZ-93型自动双重纯水蒸馏器。
实验中所测荧光强度均采用“内滤光效应”公式进行校正[8]:Icor=Iobs×e(Aex+Aem)/2。所用的乙醇浓度均于相同实验条件下做空白对比,对蛋白荧光光谱无影响。
2.2 实验方法
1.0 mL HAC-NaAc缓冲溶液、1.0 mL 2.0×10-5mol/L的PEP溶液及不同体积的NDP溶液,于一系列10 mL比色管中依序加入并以水定容,摇匀,分别在303,310,318 K恒温水浴30 min。光度计狭缝宽度5 nm,固定Δλ=λem-λex=15 nm或60 nm,扫描同步荧光光谱。
3 结果与讨论
3.1 猝灭机理与结合情况
图1为Δλ=15 nm、60 nm时NDP与P-Tyr、P-Trp反应的同步荧光光谱。NDP的加入分别使P-Tyr、P-Trp的荧光依次猝灭,说明NDP与P-Tyr、P-Trp均发生了相互作用。Δλ=60 nm的同步荧光光谱发生了微弱的红移,表明NDP使P-Trp周围的微环境极性增强,疏水性减弱[9]。
猝灭剂与荧光体之间的猝灭方式可以简单地分作静态与动态猝灭,也有二者都存在的情况。单一猝灭机制的Stern-Volmer图上应是直线,由其对温度的相关性可以区分其作用机制。而静态与动态联合作用的情况下则是弯向Y轴的曲线。动态猝灭可由Stern-Volmer方程得出猝灭速率常数Kq和Stern-Volmer猝灭常数Ksv[10]:
I0/I=1+Kqτ0[Q]=1+Ksv[Q],
(1)
其中I0和I分别为无有猝灭剂的荧光强度;τ0是分子荧光平均寿命(~10-8s),[Q]是添加的药物浓度。以I0/I对[Q]作图,得出Ksv、Kq列于表1。表1中的数据表明:I0/I对[Q]具有良好的线性,而Ksv与Kq均随温度上升而增大,说明NDP猝灭P-Tyr、P-Trp荧光的方式应为动态猝灭[11],即NDP分子与PEP分子彼此扩散和碰撞,从而使PEP的内源荧光猝灭。
蛋白-药物体系的表观结合常数Ka和结合位点数n可以由下式求得[12]:
(2)
其中[Bt]为蛋白浓度。计算结果Ka与n皆列于表1。由表1可知,Ka随温度上升而明显增大,也表明NDP对P-Tyr、P-Trp的猝灭方式是动态猝灭。3个温度下NDP对P-Tyr、P-Trp反应的n值都约为1,表明药物与蛋白反应只有一个结合位点[13],Δλ=15 nm时的Ka值明显小于Δλ=60 nm的Ka值,表明NDP与P-Trp反应程度更强。

CPEP=2.0×10-6 mol/L; 1~12: CNDP=(0, 0.58, 1.15, 1.73, 2.30, 3.46, 4.04, 4.62, 5.20, 5.77, 6.35, 6.93)×10-5 mol/L.
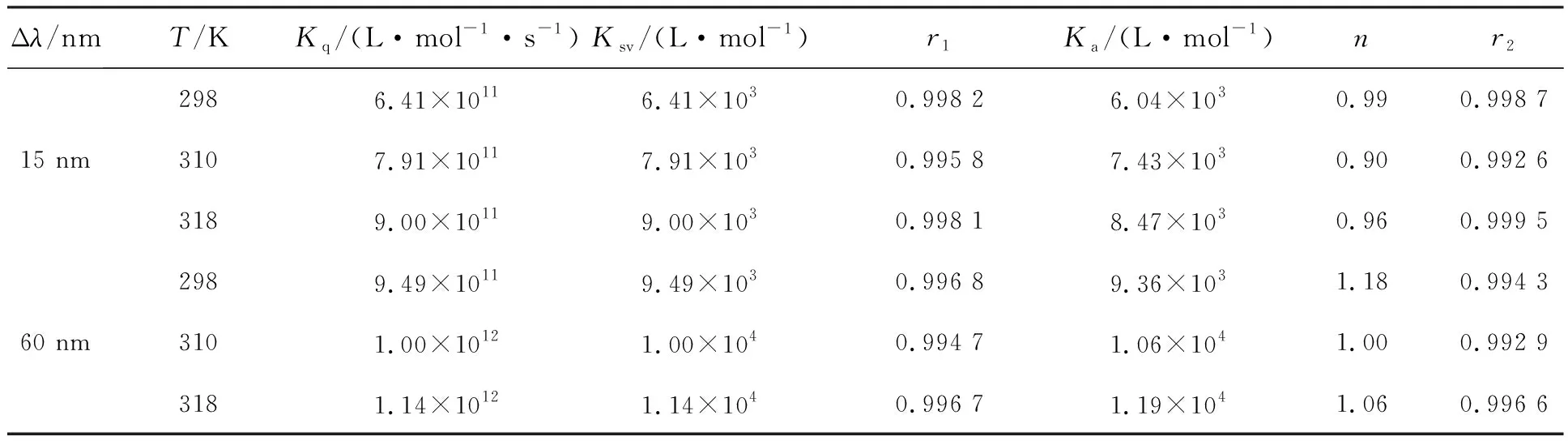
表1 NDP对P-Tyr、P-Trp体系的同步荧光猝灭反应参数
r1为方程I0/I-[Q]的线性相关系数;r2为方程lg[(I0-I)/I]-lg{[Q]-n[Bt]I0-I)/I0}的线性相关系数。
3.2 氨基酸残基荧光猝灭比率份数与蛋白结合率
以猝灭比率RSFQ表示同步荧光强度降低的程度,RSFQ=1-I/I0[14],在相同温度和药物浓度时分别计算RSFQ(P-Tyr)、RSFQ(P-Trp)值,定义NSFQR(P-Tyr)=(RSFQ(P-Tyr)/(RSFQ(P-Tyr)+RSFQ(P-Trp))×100%为该条件下的P-Tyr荧光猝灭比率份数,则P-Trp的荧光猝灭比率份数NSFQR(P-Trp)=100%-NSFQR(P-Tyr)。取310 K下CNDP/CPEP=(5.8,8.7,14.4,20.2,23.1,28.9)时的NSFQR(P-Tyr)分别为42.18%、45.22%、45.90%、46.32%、47.74%、49.31%,平均值为45.66%,NSFQR(P-Trp)分别为57.82%、54.88%、54.10%、53.67%、53.34%、52.26%,平均值为54.34%。说明P-Tyr与P-Trp均参与了反应,且NSFQR(P-Trp)>NSFQR(P-Tyr),说明反应位置应更接近P-Trp,证明了3.1的结论。
药物蛋白结合率是评估其药性与药效不可或缺的指标。以表1所得Ka计算NDP与P-Tyr、P-Trp的蛋白结合率。n=1时,结合率(W)公式如下[15]:
(3)
KaR[B0]W2-(KaR[B0]+Ka[B0]+1)W+Ka[B0]=0,
(4)
其中[B0]为蛋白总浓度(~10-3mol/L),NDP浓度在1.0×10-7~1.0×10-3mol/L之间,R为药物浓度与蛋白总浓度之比。经计算得298,310,318 K时NDP与P-Tyr的蛋白结合率分别为66.76%~84.68%、69.43%~87.15%、71.04%~88.53%,NDP与P-Trp的蛋白结合率分别为72.22%~89.50%、73.64%~90.60%、74.91%~91.53%。显然随着温度的上升,NDP与P-Tyr、P-Trp的蛋白结合率都分别增大。根据式(4)做出蛋白结合率W与浓度比R的曲线图如图2。对310 K时的曲线进行非线性拟合得NDP与P-Tyr结合模型为:W=-0.1109R2+0.07492R+0.8799,相关系数r=0.999 9;NDP与P-Trp的结合模型为:W=-0.1398R2-0.03372R+0.9096,相关系数r=0.999 8。表明当蛋白浓度一定时,药物浓度增加会减少其蛋白结合率。NDP与两种氨基酸残基的蛋白结合率均在90%以上,与NDP实际蛋白结合率92%~98%[16]相近,该结果为NDP的临床用药提供了参考,也表明荧光法能够为计算药物与蛋白结合时蛋白结合率提供一种简便易行的方法。
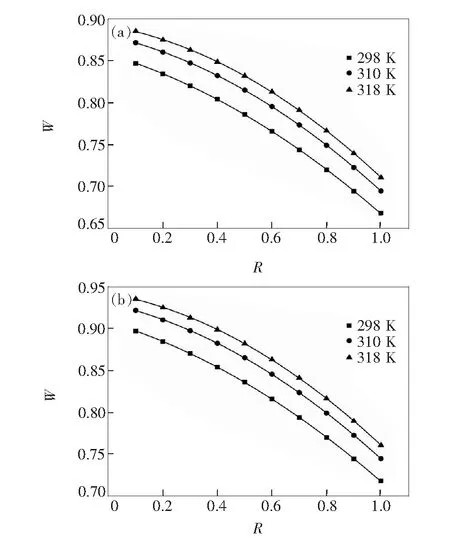
图2 不同温度下的NDP对P-Tyr、P-Trp蛋白结合率。(a)Δλ=15 nm;(b)Δλ=60 nm)。
3.3 作用力与药物协同性考察
热力学参数焓变ΔH、熵变ΔS、吉布斯自由能变化ΔG可由以下方程求得,以分辨药物与蛋白分子相互作用的情况:
RlnKa=ΔS-ΔH/T,
(5)
ΔG=ΔH-TΔS,
(6)
其中R为理想气体常数,T为温度,Ka为表观结合常数,得出蛋白与药物间各项热力学参数见表2。
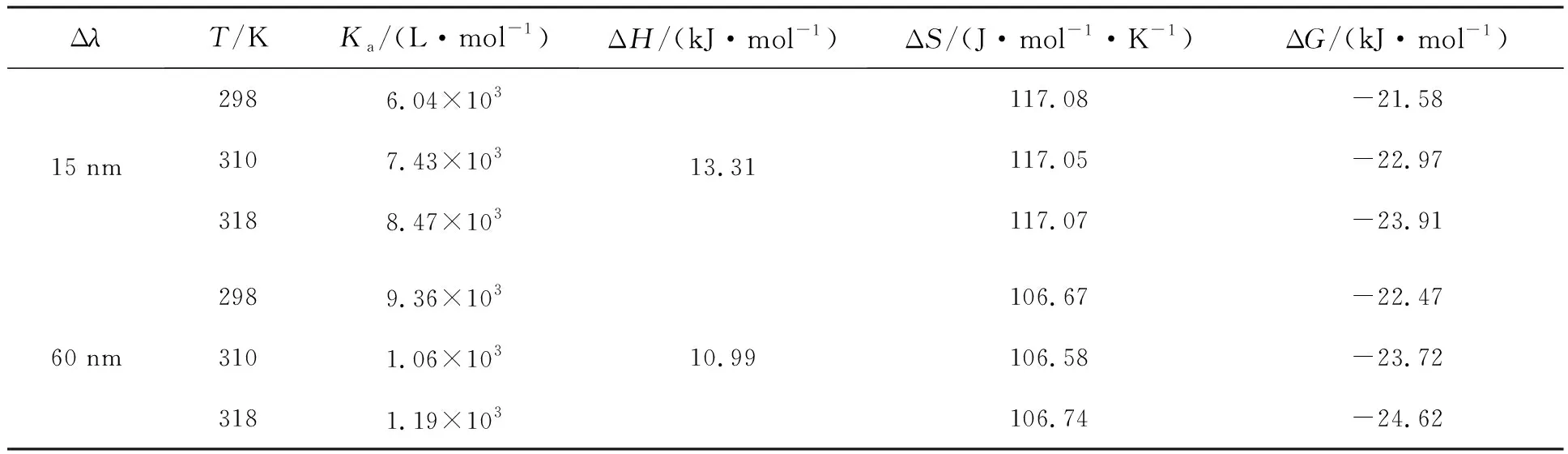
表2 不同温度下NDP -P-Tyr、NDP -P-Trp体系的热力学参数
由表2可知NDP与P-Tyr、P-Trp相互作用的ΔG均小于0,表明该过程为自发过程;ΔH均大于0,表明NDP与P-Tyr、P-Trp相互作用均为吸热反应且Δλ=15 nm的ΔH大于Δλ=60 nm,说明NDP与P-Tyr反应需要更多外来能量,高温时对NDP与P-Tyr的反应更有利,而低温时NDP与P-Trp反应更容易进行。ΔH与ΔS均为正值,表明NDP与P-Tyr、P-Trp作用力以疏水作用为主[17]。
考察药物协同性可使用Hill方程[18]:
lgL/(Lm-L)=lgKa+nHlg[Q],
(7)
式中L=1-I/I0,Lm通过1/L对1/[Q]画图得到,nH为Hill系数。nH>1是正协同作用,nH<1是负协同作用,nH=1则是无协同作用,nH结果见表3。从表中数据可知,nH都约为1,说明NDP与P-Tyr或P-Trp的作用将不影响后继配体与蛋白的结合,表现为零协同作用,且不受温度的影响。
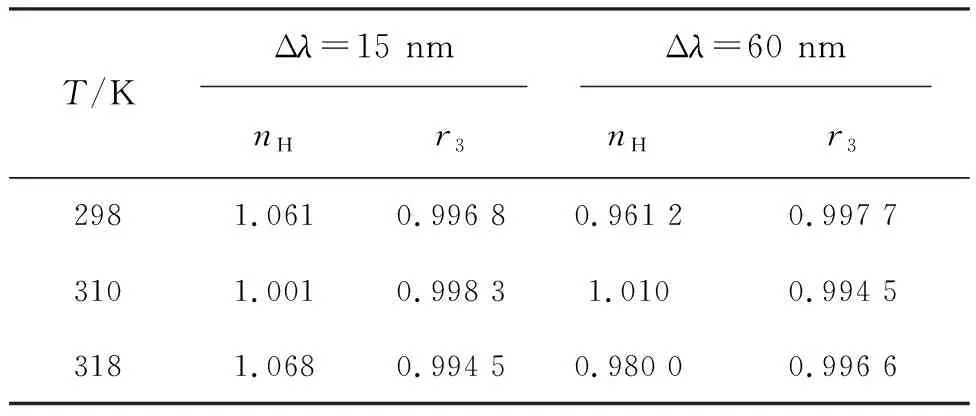
表3 NDP-P-Tyr、NDP-P-Trp体系的nH值
nH为体系的Hill系数;r3为方程lg[L/(Lm-L)]-lg[Q]的线性相关系数。
3.4 NDP-P-Tyr、NDP-P-Trp间的距离
由Förster非辐射能量转移理论,根据以下公式[19]:
(8)
(9)
(10)
其中K2=2/3,N=1.336,Φ=0.15。 P-Tyr或P-Trp的同步荧光光谱与NDP的紫外吸收光谱见图3。通过公式计算依次得到表4中结果。
从表4可以看出:r均小于7 nm,说明NDP与P-Trp、P-Tyr间都存在非辐射能量转移[20]。而Δλ=15 nm时的R0、r均大于Δλ=60 nm时的R0、r,意味着NDP分子到P-Trp的作用距离更短,更容易使P-Trp的荧光发生猝灭。随着温度的升高,E值都逐渐增加且r值逐渐减小,说明温度的上升使NDP分子与PEP分子间碰撞加剧,反应速率加快,也表明NDP与P-Trp、P-Tyr的猝灭方式是动态猝灭,与3.1中的结论相同。
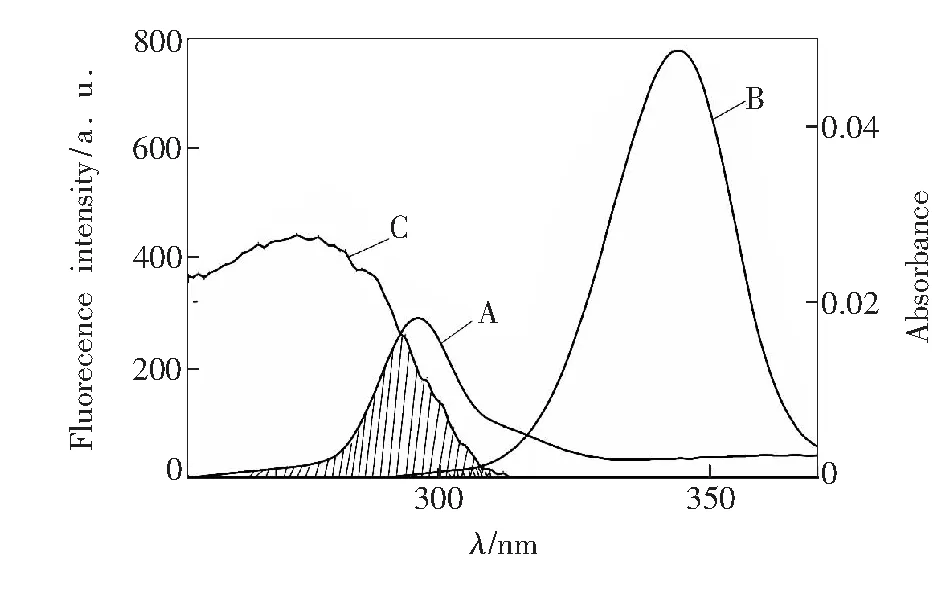
图3 A:PEP的同步荧光光谱(Δλ=15 nm);B:PEP的同步荧光光谱(Δλ=60 nm);C:NDP的紫外吸收光谱(T=298 K,CNDP=CPEP=2.0×10-6 mol/L)。

表4 不同温度下NDP-P-Tyr、NDP-P-Trp体系之间的结合参数
4 结 论
常规的荧光猝灭法只能探究蛋白-药物体系的整体性质如结合常数、作用力、结合距离等。而通过固定Δλ=15 nm、Δλ=60 nm,利用同步荧光法可以直接得到药物与蛋白色氨酸残基、酪氨酸残基之间的结合常数、结合位点数、作用力、结合率、结合模型、结合距离及结合程度等。该研究对更加深入地研究药物与蛋白的作用机制及蛋白在与药物分子结合中的结合行为均有着重要的意义。

