钇-90微球放射性肝段切除
——钇-90微球放射栓塞系列回顾(九)
王草叶, 贾中芝, 王维平
放射性治疗(radiation therapy)已经有近百年的历史,是一种有效治疗恶性肿瘤的方法。但很少应用于肝脏恶性肿瘤,因为肝脏是一个对放射线非常敏感的器官,尤其是在肝硬化时对放射性的耐受进一步降低[1-2]。传统的外照射法,因其照射途径上的正常肝组织不可避免地暴露于射线,肝功能受损比较明显。有研究显示,全肝平均的辐射剂量在40 Gy时发生放射性肝病的概率高达50%,而这个剂量并不能够达到治疗肿瘤的作用[3]。近年来采用三维立体或分次外照射疗法(stereotactic body or fractionated external-beam radiotherapy),在有效缩小照射视野的同时,局部外照射的剂量可以提高到90 Gy[4]。与传统外照射相比,三维立体法更加精确,大大减少了对肝组织的损害,但依然无法将放射剂量达到205 Gy这个预期肝脏肿瘤必定出现反应的剂量[5]。另外,若治疗肝脏尾状叶靠近肝门的肿瘤,这种方法会增加胆道和血管损伤的风险;治疗位于膈顶的肿瘤会使放射性肺炎的概率增加等等。所以,放射性治疗技术在肝脏恶性肿瘤中的应用一直受到了限性。
90Y是种纯β衰变的放射性核素,在其衰变中只有β射线产生,最大射程约为11 mm,组织平均射程为2.5 mm。通过选择性插管技术,可将载有90Y的微球灌注到肿瘤供血动脉,90Y微球随血流栓塞在肿瘤的末梢血管而被固定。90Y所产生的射线仅限于微球周围的11 mm,因而这是一种局部治疗肿瘤的方法。由于这种方法所显示的有效性和安全性,放射性治疗肝脏肿瘤又重新引起了大家的重视。
1 90Y微球放射性肝段切除的概念
理想的局部放射性治疗是高度选择性地针对肝癌供血动脉进行90Y微球灌注。在实际临床操作过程中,完全避免非肿瘤供血动脉往往有一定的困难,甚至无法实现。放射性肝段切除可以理解为对恶性肿瘤所在的局部肝脏进行高强度的90Y微球栓塞治疗,其灌注范围不超过2个解剖肝段。由于90Y微球颗粒本身的物理学特性,即射程短、单位颗粒的放射性强度高,以及放射线作用仅仅出现在动脉灌注的区域。所以,采用这种方法治疗肝脏肿瘤可以提高对肿瘤杀伤力的同时避免了大范围的肝组织破坏,仅仅表现为灌注区域的肝段萎缩。这一局部大剂量灌注90Y微球的方法被称为放射性肝段切除(radiation segmentectomy)。
2 放射性肝段切除的方法学
2.1 肝段的概念与血管解剖
Couinaud肝段分类方法考虑到肝段的独立功能,因而肝段必须包括肝静脉,镰状韧带和门静脉等相应结构,这种分类的方法被广泛应用于外科手术,也广为影像诊断专业医师所熟悉,但对介入放射医师进行选择性动脉造影的帮助有限。Brisbane分类法是按照肝动脉和胆管来对肝脏进行划分,因而动脉结构与肝段的关系有较为直接的联系[6]。与Couinaud肝段分类方法相似,Brisbane分类法也将肝段分为8段。首先,肝脏分为左右2个半肝,随后进一步分为4个区和8个段。左、右叶是以胆囊窝和腔静脉间隙为界,也称之为肝脏的中线平面。因为这个界面在表面没有明显的分界,所以不用左右肝叶这个词。每一半肝按照肝动脉和胆管的分支进一步分为区和段。左半肝分为内侧区第4段,外则区第2、3段。内外区在体表的交界平面为脐裂和镰状韧带的附着点。右半肝分为前区的5、8段,后区的6、7段。右半肝没有体表交界的标志。尾状叶是独立的,也就是1段。
2.2 选择性肝动脉灌注方法
选择性动脉插管的方法与传统TACE技术相同,但放射性肝段切除对肝脏的动脉解剖辨认要求更为精确。肝动脉的解剖变异很高(±40%),因而正确识别肝动脉与肝段之间的关系在实际手术操作过程中常常有一定的困难。另外,术前非创伤性血管造影,如CT血管造影,并不能明确显示肝内动脉分支与肝段和肿瘤之间的关系。因而,熟悉肝动脉的解剖变异非常重要。临床较为常用的Michel分类法[7]将肝动脉变异分为10个类型,最常见的肝动脉解剖为肝总动脉起自于腹腔动脉干,而最常见的变异是肝替代动脉(replaced hepatic artery),起自于肠系膜上动脉。肝中动脉起自于肝右或肝固有动脉,供应4段。在左右动脉之间有很多肝内交通支。由于这种解剖上的不确定性,在90Y灌注之前需要进行选择性动脉造影,以确定治疗病变所涉及的解剖定位和造成非靶器官栓塞的变异动脉或异常交通[8]。随着Cone-beam CT技术的不断成熟,动脉超选结合断层扫描可以进一步提高判断相应动脉与灌注区域关系的准确性[9-10]。另外,由于高血供的肿瘤常会造成肝内动静脉瘘,如果大量放射性颗粒通过瘘而直接栓塞到肺血管床将导致严重的放射性肺炎,因而需要采用99mTc大颗粒白蛋白(99mTc-MAA)来测定肺分流百分数(lung shunt fraction,LSF)[11]。
2.3 微球选择
目前报道90Y微球放射性肝段切除的研究都使用90Y 玻璃微球(TheraSphere,MDS Nordion,加拿大,现被英国British Technology Group,BTG收购)。因为美国FDA批准90Y玻璃微球用于治疗肝细胞性肝癌(HCC);而90Y 树脂微球(SIR-Spheres,Sirtex Medical,澳大利亚)则用于治疗结直肠癌肝转移的患者;而90Y玻璃微球的单位放射性强度约2 500 Bq,而树脂微球每单位颗粒的强度为50 Bq,相差约50倍[12]。若要提高对肿瘤组织灌注的放射性剂量,最简单和有效的方法是增加每单位颗粒上的放射性强度。虽然通过增加微球的数量可以提高放射性剂量,但因靶血管饱和使得剂量进一步提高受到了限制,同时,靶血管床饱和可以导致微球反流而发生严重的并发症。
2.4 TheraSpheres(放射性玻璃微球)的剂量计算[11]
由于不同血管水平进行微球灌注对局部产生的剂量有所差别,所以,在放射性肝段切除时的剂量计算还需要根据微球灌注区域的大小进行调整。表1为不同灌注水平微球的剂量调整计算方法[13]。

表1 不同灌注水平微球剂量调整计算方法
上述计算是假定微球均匀分布在相应灌注区内,即肝脏与肿瘤组织中的微球分布是均匀的。但实际情况则较为复杂,HCC的血供主要来自于肝动脉,而正常肝组织的血供主要来自于门静脉[14]。所以,剂量计算需要考虑肿瘤和相应灌注区域的动脉血流比例,以及这种血流分布的不同而带来的对肿瘤和相应灌注区域的剂量差别。对肿瘤与正常肝组织之间的相对动脉灌注差别可以采用量化分级的方法来进行主观判断,即将增强影像(CT或MRI)或99mTc-MAA扫描所显示的强化程度或浓聚程度分为1~10等级:1是指与周围正常肝组织有相同的血供,10是指100%血供进入肿瘤组织(如整个灌注的肝段被肿瘤占据)。根据量化结果分别计算肿瘤和正常肝组织的剂量:①灌注到肿瘤的最大剂量(DST)=50(A)(1-LSF)(1-R)(PT)/MT;②;灌注到正常肝组织的最大剂量(DSN)=50(A)(1-LSF)(1-R)(1-PT)/(Ms-MT),这里 A=瓶中总微球的放射线剂量,LSF=肺分流百分数,R=瓶中残留微球的放射线剂量,PT为根据肿瘤高血供比例来计算微球输送到肿瘤的百分比。从严格的定义来考虑,90Y的最大射程是11 mm,其射程范围内的边界非灌注区的组织会有损伤[15],但这种损伤非常有限,实际不会出现明显的临床表现,所以可以假设微球对周边肝组织的放射剂量为0 Gy。图1演示进行放射性引起肝段栓塞的基本原理,注意富血供的肿瘤位于不同的肝段位置。
2.5 患者选择
图1 90Y微球对肝脏不同灌注水平的示意图
符合进行90Y微球放射性肝段治疗的患者需要满足以下3个基本条件:①小于5 cm的孤立性肿瘤病灶;②肿瘤仅侵犯肝组织(无转移或血管侵犯);③肿瘤在血管造影上小于2个肝段[16]。
2.6 影像分析
腹部影像常规使用 CT或MRI增强扫描,在90Y放射栓塞术前,术后1个月进行,之后每2~3个月进行随访,直至患者死亡、失联或可以接受根治性治疗,如进行肝移植或手术切除病灶。
2.7 肿瘤反应评估
常用评估肿瘤的治疗反应方法有4种(表2)[17-19],尽管目前评价治疗反应的主要指标依然是肿瘤大小的改变,但这一方法对于90Y治疗后的评估却不是最为准确的方法,因肿瘤是否存活与体积增大或减少没有必然的关系。影像学上肿瘤坏死或注射对比剂后是否出现增强被认为是对90Y治疗后有无反应的标准。所以,欧洲肝脏研究协会(European Association for the Study of Liver,EASL)和改良实体肿瘤反应评估标准(mRECIST)较WHO和RECIST对HCC在90Y后的预测更为准确[20]。
2.8 毒性分析
毒性和不良反应采用美国国立癌症研究中心的毒性标准4.0[21]。评估需要根据术前基线水平至术后3个月的随访,及进行外科手术期间出现毒性和不良反应进行比较。
90Y微球治疗的并发症和不良反应的概念已经在本系列之五做了详细的介绍[22]。
3 文献数据的收集和分析
3.1 数据提取
通过 PubMed和Google主要检索工具,搜索1999年1月至2018年4月所有发表的关于90Y微球放射性肝段切除的全文和会议摘要。内容包括作者、所在国家、研究时间、文章发表年月、病例数、患者性别和年龄、病例诊断、肝脏受累范围、放射剂量(包括肝组织、肝段和肿瘤的剂量)、随访时间、生存率(OS)、疾病控制率(3个月后的治疗反应),并发症及副作用的发生情况。
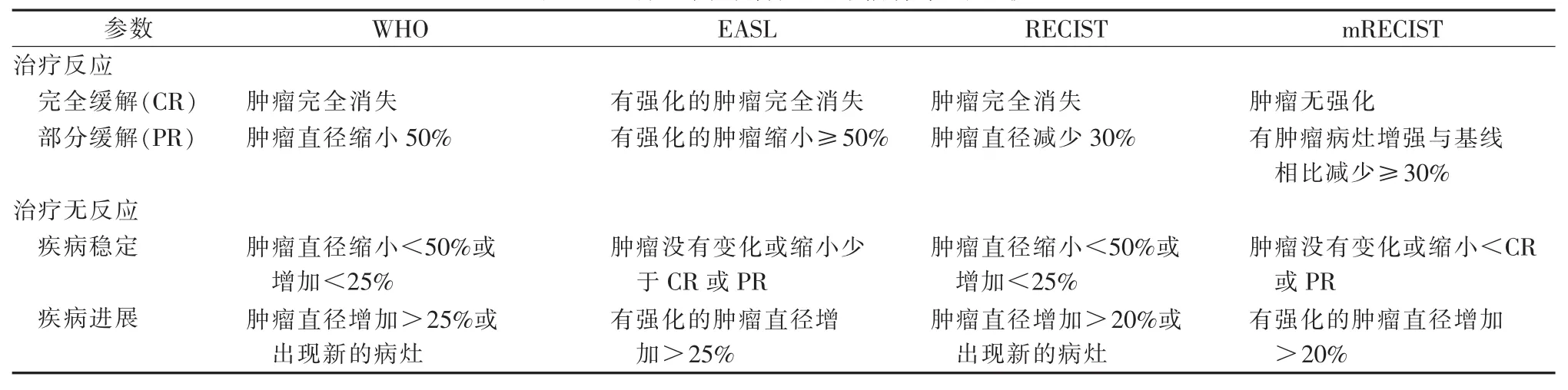
表2 4种不同肿瘤反应评估标准的比较
3.2 数据分析
将文献搜索的结果按统一标准分别建立数据库,以确保数据的准确性和完整性。疾病控制率及OS以患者接受90Y微球治疗之日开始计算。本研究因所纳入的文献缺乏相关的数据而无法进行meta分析。结果统计根据相关同类数据进行合并统计总和,最后分别计算各均数。
3.3 结果
从1999年至2018年4月共有5个临床研究(包括会议摘要1篇)报道了应用90Y微球进行放射性肝段切除。5个研究中,前瞻性研究1篇,4篇为回顾性研究(表3)。纳入研究的患者总人数为270例,其中男168,女93例,未标注性别9例,加权后的平均年龄为64.7岁(年龄范围,43~90岁),平均随访时间从90Y微球栓塞术后开始计算为14.4个月(随访时间范围,1~24个月)。所有包括的270例患者中,HCC患者为261例,9例为胆管癌或转移癌。在纳入的5篇文章中,中位正常肝段放射剂量为242 Gy,中位肿瘤放射剂量为875 Gy(按Padia和Riaz的2个研究共104例患者的数据进行计算)。所有纳入的文献均使用玻璃微球进行放射栓塞治疗。
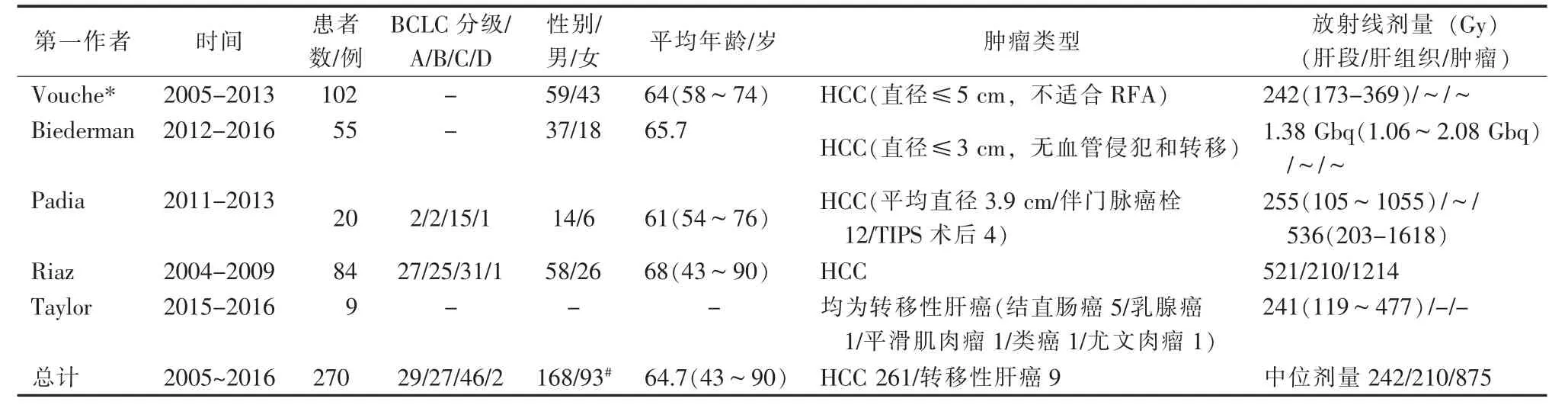
表3 纳入文献的基本信息
在纳入文献中,有4个研究报道了包括241例患者的生存时间,共241例(89.2%,241/270)患者总体加权平均生存时间为17.1个月(8.8~25.6个月)。虽然5篇文献采用的实体肿瘤的放射性影像评估不同,经计算后的3个月疾病加权平均完全缓解率是61.0%,部分缓解率是 23.7%,疾病稳定率是7.7%。疾病进展率为7.6%,包括在90Y放射性肝段切除治疗后出现肿瘤复发,肿瘤体积增大或扩散(表4)。在3个研究中共报道了42例患者(25.3%)在90Y微球放射性肝段切除后进行外科手术切除或肝移植治疗的情况。
本研究常见的90Y治疗后不良反应是疲劳42.5%(96/206),腹部疼痛 13.1%(27/206),恶心呕吐 10.8%(20/186),腹泻 11.1%(1/9),膈神经刺激 11.1%(1/9),栓塞后综合症10%(2/20),血清胆红素升高8.7%(21/241),经保守或相应对症治疗后缓解。
90Y微球栓塞肝段病例见图2。
4 讨论
大量的实验和临床研究表明,射线对肿瘤组织的杀伤能力是随着放射性强度的增加而提高的。当局部剂量达到120 Gy时[13],肿瘤组织可出现预期的杀伤反应;同样,任何正常组织在接受这个剂量以后都会出现不可逆的破坏作用。所以,若要达到最大治疗效果和最低程度的肝功能损坏,应该尽量避免微球进入正常肝组织。在不可避免的情况下,把灌注区域局限在尽可能小的范围之内(<2个肝段),以保护大部分肝脏不受射线的破坏而使得整体肝功能的依然维持正常。
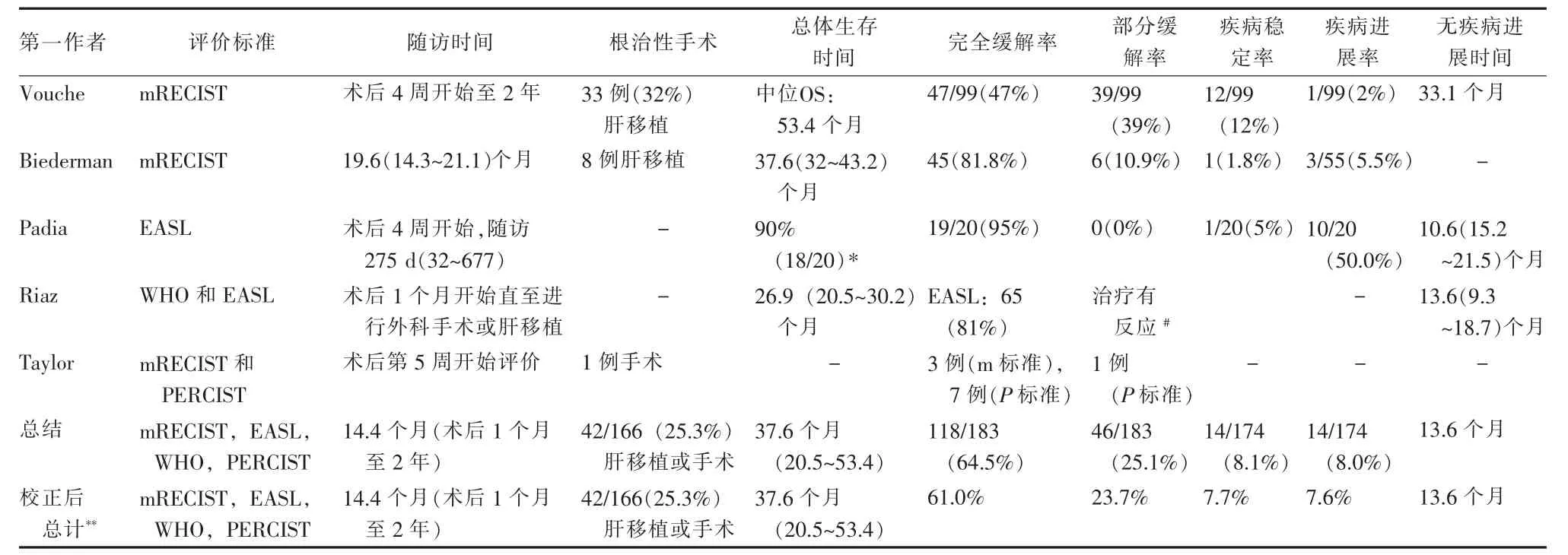
表4 90Y微球放射性肝段切除术后的疗效
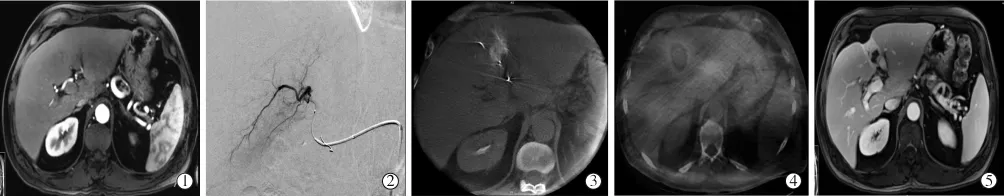
图2 90Y微粒球放射栓塞肝段典型病例
早期的观察研究发现[23],大约有 6.4%(20/315)的患者在接受右肝全叶90Y灌注治疗后出现了肝叶萎缩。进一步分析显示,出现肝叶萎缩的患者,生存期明显延长。对83例右肝肿瘤的患者(67例HCC、胆管癌和结直肠癌各8例)进行了右侧全肝90Y灌注治疗[24]。1个月后观察右肝萎缩、左肝增生以及预测存活肝的比例(future remnant ration,FLR)的变化,结果都显示它们之间差异有显著的统计学意义。在临床上,这种肝叶治疗对手术切除肿瘤以及提高术后的疗效有所帮助。但是,对一侧肝叶进行“切除”的方法只是在少数患者中能够得到成功,且容易发生严重的合并症和不良反应,尤其是放射栓塞性肝病(radioembolization induced liver disease,RILD)的概率明显增加[22,25-26]。
随后,Vouche 等[27]对一组包括 102 例手术不可切除,且不适合进行射频治疗的患者进行了90Y微球肝段切除治疗,平均剂量为242 Gy(173~369)。术后mRECIST肿瘤评价分析显示完全缓解率,部分缓解率和疾病稳定率分别为 47/99(47%),39/99(39%)和12/99(12%)。其中的33例患者在治疗后成功地进行了肝移植手术,病理学检查切除的病变肝脏显示,放射剂量高于190 Gy的患者,其肿瘤全部坏死率为66.7%(14/21),而放射剂量小于190 Gy的患者,肿瘤全部坏死率仅为25%(3/12)。这一结果提示,肿瘤坏死与90Y微球的剂量的增加有直接联系。统计分析显示,放射性肝段切除的平均肝段剂量为242 Gy,而肿瘤组织接受的剂量为875 Gy。在纳入的270例患者中,没有出现与微球治疗相关的死亡,严重的并发症,如放射性肝病。与肝叶灌注相比,肝段灌注从理论上会增加治疗后胆道并发症的发病率[28],但本研究并未发现有报道胆道损伤增加的概率,多数表现为一过性的转氨酶增高(表3)。Padia等[29]报道了超选择性灌注治疗法,他们的灌注区域仅限于一个肝段,明显提高了局部放射性强度,其中1例患者的肝段剂量为1 055 Gy,肿瘤的剂量高达1 618 Gy,但临床无一例发生3~4级的肝脏毒性反应。
Biederman等[30]近期发表了射性肝段切除与选择性化疗栓塞在早期HCC中的对比研究。共纳入了112例患者,均为单病灶的HCC,直径≤3 cm,其中57例接受放射性肝段切除,55例进行化疗栓塞。在经过多因素配对以后进行分析,放射性肝段切除的完全反应率为92.1%,化疗栓塞为52.6%(P=0.005);中位(95%CI)需要接受补救治疗时间(time to secondary therapy,TTST),放射性肝段切除为812 d(363~812d),化疗栓塞为 161d(76~350d)(P=001)。
研究显示放射性肝段切除的中位总体生存时间为37.6个月(20.5~53.4)。需要强调的是,由于纳入患者的分级有不同,各研究所显示的患者的中位总体生存时间也不同。在102例手术不可切除且不适合进行射频治疗的患者中,61例为BCLC A,其余41例为BCLC C,其总体疾病进展的中位时间是33.1个月,能够接受肝移植的平均中位时间是6.3个月,中位生存时间为53.4个月。Padia等[29]报道的一组20例较为晚期的HCC患者(BCLC A、B、C和 D分级分别为2、2、15和1例),全都伴有门脉癌栓,其中有4例术前还接受了门体静脉分流术(TIPS),放射性肝段治疗后 275 d中位存活达90%,中位疾病进展时间为319 d。
研究还显示,放射性肝段切除后疾病的复发率较低。共有3篇文章详细描述了疾病进展率,在包括的174例患者中共有14例出现疾病进展,总体疾病进展率是7.6%。研究发现,另有9例患者出现90Y灌注治疗区域以外的肝脏部位出现新的肿瘤病灶。这个结果表明,高剂量的90Y微球灌注对肿瘤有强大的杀伤作用,但并不能防止治疗区域以外的肿瘤复发。
本文主要的不足之处为纳入的文献极其有限,且大部分为观察性研究,其中只有一个前瞻性研究(1/5,20%)。放射性肝段切除仅适合于肿瘤直径<5 cm的孤立性病灶,且局限于1~2肝段的患者[27],因而对大部分中晚期有局部扩散和多发病灶的患者并不合适。尽管肿瘤对高剂量治疗有很高的反应率,但有研究显示并未延长肿瘤的复发率,因为在未进行治疗的区域出现了新的病灶,尽管治疗区域复发的概率很小[29]。另外,在纳入的研究之间具有明显性差异,包括:①患者的分级不同;②有无合并门脉癌栓;③使用的放射性剂量不同;④各中心使用的客观疗效评估方法不统一。
5 结论
放射肝段切除是90Y治疗肝脏恶性肿瘤的一个新概念,其本质是对肿瘤实施高度选择性灌注治疗,在不可避免的情况下,将灌注区域限制在2个解剖肝段以内。这种治疗方法可以对局部实施200 Gy甚至更高强度的放射性治疗,因而肿瘤的反应率增加,同时对肝功能损伤小。与传统的TACE相比,放射肝段切除的完全反应率高,中位需要接受补救治疗时间明显延长,但不适合肿瘤侵犯多个肝段,对非治疗区域的肿瘤复发没有预防作用。

