藏药诃子提取物对脑缺血再灌注损伤模型大鼠的保护作用及其机制研究Δ
任丹君,丁一,丁笑刚,翟文杰,刘文星,刘天龙,李建光
(1.新疆医科大学药学院,乌鲁木齐 830011;2.空军军医大学第一附属医院药剂科,西安 710032;3.晋中市第一人民医院药剂科,山西 晋中 030600)
近年来,脑血管疾病已成为危害人类健康的重大疾病之一,其中缺血性脑卒中是人类致残、致死的重要原因[1]。治疗性血管新生在缺血性疾病的发生、治疗及预后中均发挥着重要的作用,是目前医学研究的热点[2]。血管新生一方面可为缺血区域提供大量生长因子以增加微血管循环;另一方面亦可促进神经及突触再生,并为突触可塑性的调控提供营养和氧气,因而被认为是缺血性脑卒中后康复的核心治疗策略[3]。相关研究证实,中药及民族药在脑缺血性疾病的治疗中发挥着举足轻重的作用[4-5]。诃子为使君子科植物诃子(Terminalia chebulaRetz.)或绒毛诃子(T.chebulaRetz.var.tomentellaKurt.)的干燥成熟果实。在藏药经典著作《晶珠本草》中,诃子被称为“藏药之王”,有“补隆”之效[6],且藏医“补隆养血”与治疗性血管新生理论相似[7]。现代医学研究发现,诃子提取物具有抗氧化、促进血管新生等作用,已有研究初步证实诃子提取物的脑保护作用[8]。对于诃子有效成分在心脑血管疾病中的研究多集中在其抗氧化、抗炎、调节血脂等[9-11]作用上,然而其是否能通过促进血管新生这一机制来发挥脑保护作用却鲜有报道。本课题组前期研究发现,诃子中多酚类活性成分鞣花酸可改善动脉粥样硬化[12];其另一种多酚类活性成分柯里拉京可调控核因子E2相关因子2(Nrf2)及血管内皮细胞生长因子(VEGF)通路,发挥抗氧化、抗炎、促血管新生的作用,缓解大鼠脑缺血再灌注损伤[9]。基于以上背景,本研究通过建立脑缺血再灌注[即大脑中动脉阻塞(MCAO)再灌注]损伤大鼠模型,观察诃子提取物对模型大鼠脑组织的保护作用,进一步探讨其通过调控VEGF/血管内皮细胞生长因子受体2(VEGFR2)通路和调节一氧化氮(NO)水平进而抗脑缺血再灌注损伤的可能机制,为诃子提取物用于脑缺血再灌注损伤的防治提供理论依据。
1 材料
1.1 仪器
HX-100E型小动物呼吸机(成都泰盟科技有限公司);COOLPIX S1型照相机(日本Nikon公司);Ⅸ71-Dtr/2型荧光倒置显微镜(日本Olympus公司);SCIENTZ-10N型冷冻干燥机(宁波新芝生物科技股份有限公司);403756PK5Re型线栓(美国Doccol公司);037-003型大鼠脑槽(北京华越洋生物科技有限公司);HM340E型石蜡切片机(德国Zeiss公司);Multiskan GO型全波长酶标仪(美国Thermo Fisher Scientific公司);5804R型低温冷冻离心机(德国Eppendorf公司,离心半径:16.8 cm);FACSCalibur型流式细胞仪(美国BD公司)。
1.2 药材与试剂
诃子粉[购于西安金绿生物工程技术有限公司,批号:20150401,规格:10∶1(生药质量∶诃子粉质量)],经空军军医大学第一附属医院文爱东教授鉴定为使君子科植物诃子(T.chebulaRetz.)果实的粉末。
VEGF、VEGFR2检测试剂盒(南京凯基生物科技发展有限公司,批号分别为20151104、EK1525);NO检测试剂盒(南京建成生物工程研究所,批号:20151109);异硫氰酸荧光素标记的CD31抗体(FITC-CD31)、藻红蛋白标记的CD34抗体(PE-CD34)、FITC标记的葡聚糖(FITC-D)(美国Abcam公司,批号分别为2530-1、553729、952964);牛血清白蛋白(BSA,北京鼎国昌盛生物技术有限责任公司,批号:03J10150);2,3,5-氯化三苯基四氮唑(TTC)染色剂、PE标记的大鼠抗小鼠免疫球蛋白G(PE-IgG)二抗、FITC标记的大鼠抗小鼠免疫球蛋白G(FITC-IgG)二抗(美国Sigma公司,批号分别为32016D0、20172537、20171508);多聚甲醛(国药集团化学试剂有限公司);苏木精染料(上海化学试剂总厂试剂三厂);伊红染料(武汉博士德生物工程有限公司);10%水合氯醛(空军军医大学第一附属医院药剂科配制);磷酸盐缓冲液(PBS,空军军医大学第一附属医院药剂科配制,pH 7.4);其余试剂均为分析纯,水为蒸馏水。
1.3 动物
SPF级雄性SD大鼠40只,7~8周龄,体质量250~300 g,由空军军医大学实验动物中心提供[动物生产许可证号:SCXK(军)2012-007]。所有大鼠均分笼饲养,环境温度为24~26℃,湿度为60%~70%;造模前均禁食、不禁水12 h。
2 方法
2.1 诃子提取物的制备
参考文献[13]制备诃子提取物。称取诃子粉适量,用适量60%乙醇加热回流提取3次,合并提取液浓缩至约药材量的一半,再加入等体积的95%乙醇,搅拌均匀,静置12 h后,滤过,滤渣用60%乙醇洗涤,合并滤液与洗液,减压回收乙醇,冷冻干燥后即得诃子提取物(每1 g提取物由2 g诃子粉制得),备用。
2.2 MCAO再灌注模型的建立
参照改良Longa线栓法[14-15]复制MCAO再灌注损伤模型。大鼠术前禁食12 h后,腹腔注射10%水合氯醛(3 mL/kg)麻醉,以仰卧位固定,沿颈正中线作纵行切口,分离皮下组织,结扎颈总动脉近心端和颈外动脉远心端,将线栓沿颈总动脉分叉部约4 mm处插入颈总动脉,直至有轻微阻力为止,造成右侧大脑MCAO;缺血1.5 h后,拔出线栓实现再灌注(当大鼠清醒后,出现对侧上肢重于下肢的瘫痪症状即视为造模成功)[16]。假手术组大鼠除不插入线栓外,其余操作同上。
2.3 分组与给药
将40只大鼠随机分为假手术组、模型组和诃子提取物低、中、高剂量组(20、50、100 mg/kg,以提取物质量计,剂量设置参考文献[17-18]),每组8只。按“2.2”项下方法造模成功2 h后,各给药组大鼠均灌胃相应药物(以生理盐水为溶剂),假手术组和模型组大鼠均灌胃等体积生理盐水,每天1次,连续7 d。
2.4 外周血内皮祖细胞(EPCs)水平的测定
于给药后1、3、7 d采集大鼠内眦静脉丛血1 mL,以2 000 r/min离心20 min,采用Ficoll密度梯度离心法提取外周血中的单核细胞层,重悬于适量0.5%BSA中,混匀;依次加入FITC-CD31、PE-CD34抗体(分别为10、2 μL),同时以PE-IgG、FITC-IgG二抗(各10 μL)为阴性对照,振荡混匀后,于室温下避光孵育10 min,加入0.5%BSA 2 mL,混匀;以1 500 r/min离心10 min,用0.5%BSA清洗,弃去上清液,将沉淀重悬于适量0.5%BSA中,用流式细胞仪测定各组大鼠外周血中EPCs水平(每20万个外周血单核细胞中检出FITC-CD31和PE-CD34双标记的即被认为是EPCs)。
2.5 神经功能学评分
于给药后7 d采用改良Garcia法[19]对大鼠进行神经功能学评分,包括自主运动(0~3分)、鼠笼攀援(1~3分)、前肢对称性(0~3分)、活动对称性(0~3分)、触摸触须反应(1~3分)、触摸双侧躯干反应(1~3分)等6项,总分为18分,分数越低表明神经功能损伤越严重。
2.6 脑梗死体积百分比的测定
采用TTC染色法测定各组大鼠的脑梗死体积。经神经功能学评分后断头处死各组大鼠,并将其大脑置于脑槽中,制备冠状切片(2 mm),置于2%TTC染色剂中,于37℃下避光染色30 min。将染色后的脑组织置于4℃、4%多聚甲醛溶液中固定24 h后,拍照,采用Image Pro Plus 7.0软件处理并计算脑梗死体积[正常脑组织染色后呈红色(非苍白区),梗死脑组织因未着色而呈白色(苍白区);脑梗死面积为对侧正常脑组织半球面积与患侧正常脑组织面积的差值,总脑梗死体积为各脑切片梗死面积之和乘以切片厚度(2 mm),脑梗死体积百分比为总脑梗死体积与全脑体积的比值][20]。
2.7 脑组织病理学观察
取大鼠脑组织置于4%多聚甲醛溶液中固定24 h后,常规脱水、石蜡包埋、切片(5 μm),经苏木精-伊红(HE)染色后,置于荧光倒置显微镜下观察各组大鼠脑组织的病理学变化。
2.8 脑组织梗死区域微血管密度(MVD)的测定
取大鼠脑组织(处死前已注射FITC-D)置于4%多聚甲醛溶液中固定24 h后,常规脱水、石蜡包埋、切片(5 μm),参照Weidner法[21]测定大鼠脑组织梗死区域的MVD。寻找梗死区域内5个血管密集区,于200倍荧光倒置显微镜下计算该区域内被染成绿色的微血管数目。每份切片均选取5个高倍视野计数,取其平均值。
2.9 脑组织梗死区域微血管新生相关因子的测定
于冰浴中切取大鼠脑组织梗死区域适量,去除脑膜和血液,加入4℃PBS适量,匀浆约1 min,制成10%脑组织匀浆。匀浆于4℃下、以3 000 r/min离心20 min,取上清液,采用酶联免疫吸附测定法(ELISA)以全波长酶标仪测定脑组织中VEGF、VEGFR2、NO水平,严格按照检测试剂盒说明书操作。
2.10 统计学方法
采用SPSS 20.0软件对数据进行统计分析。采用Shapiro-Wilk检验和Levene检验进行正态性和方差齐性分析,符合正态分布且方差齐的计量资料以x±s表示,组间比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠外周血EPCs水平比较
与假手术组比较,模型组大鼠各时间点外周血EPCs水平均显著下降,差异均有统计学意义(P<0.05)。与模型组比较,诃子提取物中、高剂量组大鼠各时间点外周血EPCs水平均显著提高,差异均有统计学意义(P<0.05或P<0.01),且该指标于给药后3 d达到峰值,给药后7 d有所下降;而诃子提取物低剂量组大鼠各时间点外周血EPCs水平与模型组比较,差异均无统计学意义(P>0.05),详见表1。

表1 各组大鼠外周血EPCs水平比较(x±s,n=8)Tab 1 Comparison of EPCs levels in peripheral blood of rats among different groups(x±s,n=8)
3.2 各组大鼠神经功能学评分比较
与假手术组比较,模型组大鼠神经功能学评分显著下降,差异有统计学意义(P<0.01)。与模型组比较,诃子提取物中、高剂量组大鼠神经功能学评分均显著提高,差异均有统计学意义(P<0.05或P<0.01);而诃子提取物低剂量组大鼠神经功能学评分与模型组比较,差异无统计学意义(P>0.05),详见表2。
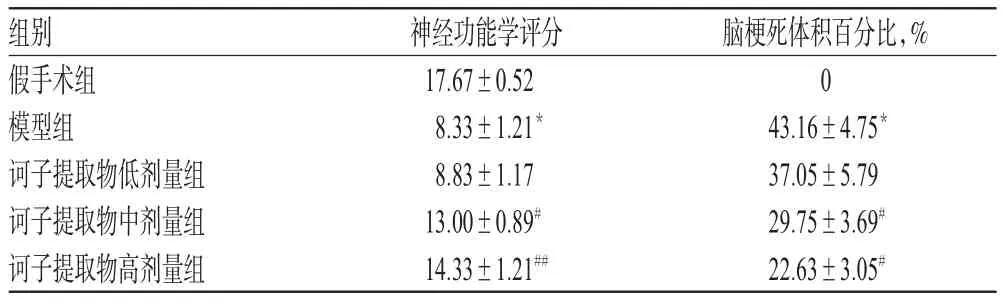
表2 各组大鼠神经功能学评分和脑梗死体积百分比比较(x±s,n=8)Tab 2 Comparison of neurological function scores and the volume percentage of cerebral infarction of rats among different groups(x±s,n=8)
3.3 各组大鼠脑梗死体积百分比比较
假手术组大鼠脑组织中未见梗死区域,而模型组则可见明显的梗死区域,且其脑梗死体积百分比较假手术组显著提高,差异有统计学意义(P<0.01)。与模型组比较,诃子提取物中、高剂量组大鼠脑梗死区域明显缩小,且其脑梗死体积百分比均显著下降,差异均有统计学意义(P<0.05);而诃子提取物低剂量组大鼠脑梗死区域虽有所缩小,但其脑梗死体积百分比与模型组比较,差异无统计学意义(P>0.05),详见图1、表2。鉴于上述结果,本研究以诃子提取物中、高剂量组大鼠为对象进行后续的机制研究。

图1 各组大鼠脑组织TTC染色结果Fig 1 TTC staining results of cerebral tissue in rats of each group
3.4 各组大鼠脑组织病理学变化情况比较
假手术组大鼠脑组织中神经细胞及毛细血管形态正常、结构完整,未出现明显的病理学改变;模型组大鼠脑组织梗死区域周围细胞排列较紊乱,部分细胞核固缩、溶解,胞体缩小;与模型组比较,诃子提取物中、高剂量组大鼠脑组织梗死区域明显缩小,坏死细胞明显减少,详见图2。
3.5 各组大鼠脑组织梗死区域MVD比较
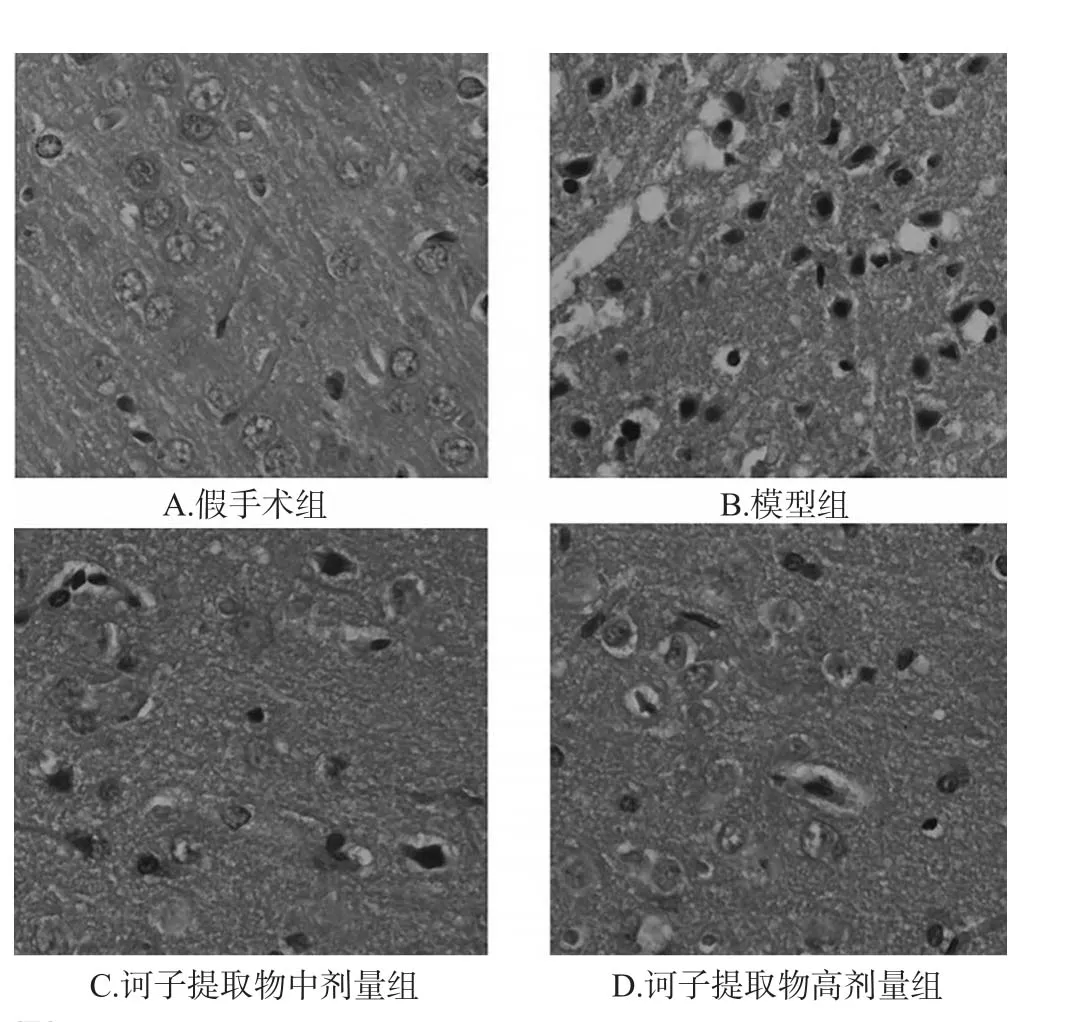
图2 各组大鼠脑组织病理学显微观察结果(HE染色,×400)Fig 2 Pathological microscopic observation results of cerebral tissue in rats of each group(HE staining,×400)
与假手术组比较,模型组大鼠脑组织梗死区域MVD显著下降,差异有统计学意义(P<0.05);与模型组比较,诃子提取物中、高剂量组大鼠脑组织梗死区域MVD均显著提高,差异均有统计学意义(P<0.05),详见表3。

表3 各组大鼠脑组织梗死区域MVD及VEGF、VEGFR2、NO水平比较(x±s,n=8)Tab 3Comparison of MVD,VEGF,VEGFR2 and NO levels in cerebral infarction area of rats among different groups(x±s,n=8)
3.6 各组大鼠脑组织梗死区域VEGF、VEGFR2、NO水平比较
与假手术组比较,模型组大鼠脑组织梗死区域VEGF、VEGFR2、NO水平均显著升高,差异均有统计学意义(P<0.05或P<0.01);与模型组比较,诃子提取物中、高剂量组大鼠上述指标均显著升高,差异均有统计学意义(P<0.05),详见表3。
4 讨论
血管新生对缺血区域脑组织微血管循环的改善、缺血组织的保护和神经功能的恢复均具有重要意义[22]。治疗性血管新生与传统藏医“补隆养血”、中医“益气生脉”理论均密切相关[23]。在藏医理论中,缺血性脑病为“隆血两虚”,属“脉瘫”,其治法强调“血”“隆”“脉”三者结合,通过“补隆养血”的方法达到治疗脑卒中的目的[24]。诃子作为“藏药之王”,有补隆养血、益气生脉之功效,由其组成的藏药方剂三果汤也广泛应用于心脑血管等疾病的治疗[23]。近年来有研究发现,藏药方剂三果汤[25-26]及诃子提取物[27]在脑缺血再灌注模型中可发挥脑血管保护作用,但这种保护作用与脑梗死区域血管新生的相关性及其分子作用机制鲜有报道,因此本研究对诃子提取物上述保护作用的机制进行了初步探讨。由于本课题组前期已初步证实了诃子提取物及其药效成分的脑保护作用[9-11],本研究主要针对其促血管新生作用及可能机制进行探索,故未增设阳性对照药物组。
本研究结果显示,与假手术组比较,模型组大鼠外周血EPCs水平显著下降,神经功能学评分显著下降,且脑组织中可见明显的梗死区域,脑梗死体积百分比显著提高,提示大鼠发生了脑缺血再灌注损伤,MCAO模型复制成功。与模型组比较,诃子提取物中、高剂量组大鼠外周血EPCs水平均显著升高,且于给药后3 d达到峰值,同时其神经功能学评分显著提高,脑梗死体积百分比显著降低,提示诃子提取物对大鼠脑缺血再灌注损伤具有一定的保护作用,并可在用药早期促进EPCs的大量分化、增殖。随后本研究又以中、高剂量的诃子提取物为对象,考察了其对大鼠脑缺血再灌注损伤保护作用的可能机制。
MVD是反映血管新生能力的有效指标,其值与新生毛细血管丰富度成正比[22]。本研究结果显示,中、高剂量的诃子提取物可显著提高大鼠脑组织梗死区域的MVD,提示其可改善该区域血流量,促进神经细胞功能的恢复。VEGF在新生血管的生长过程中发挥着至关重要的作用,研究表明脑缺血再灌注损伤后,VEGF活化可诱导VEGFR表达上调,刺激血管内皮细胞增殖,促进新血管生成,并能在内皮细胞内诱导抗凋亡蛋白表达,从而维持内皮细胞的形态、保持血管功能的完整性[28-29]。VEGFR2主要在血管内皮细胞中表达,是VEGF的特异性膜受体,是一种具有高亲和力的酪氨酸激酶受体[30]。来自内皮的NO是众多血管生长因子的下游介质,具有增加分泌促血管生成介质并促进内皮细胞增殖、迁移的作用,是诱导新血管生成所必需的物质[31]。本研究结果显示,与假手术组比较,模型组大鼠VEGF、VEGFR2、NO水平均显著升高,提示MCAO模型建立后脑组织相关因子的表达会呈应激性升高;与模型组比较,诃子提取物中、高剂量组大鼠上述指标均进一步显著升高,表明诃子提取物可通过上调脑组织梗死区域的VEGF、VEGFR2、NO的表达来促进其微血管新生和神经功能恢复。这提示诃子提取物促血管新生的作用可能与上调VEGF、VEGFR2、NO的表达有关。
综上所述,本研究初步证实了诃子提取物可提高脑缺血再灌注损伤模型大鼠外周血EPCs水平、神经功能学评分和梗死区域MVD,减小其脑梗死体积,对其缺血再灌注损伤具有一定的保护作用;其机制可能与上调血管新生相关因子(VEGF、VEGFR2、NO)的表达有关。本研究为藏药诃子防治脑缺血性疾病提供了实验依据。后续本课题组将进一步探讨其具体药效成分,深入挖掘其作用机制,并开展药动学、药效学研究。

