7种国产沙眼衣原体核酸检测试剂的平行比较
陈 凯, 韩 燕, 尹跃平, 钟铭英, 朱邦勇, 施美琴
[1. 中国医学科学院北京协和医学院皮肤病医院(研究所)中国疾病预防控制中心性病控制中心参比实验室,江苏 南京 210042;2. 广西壮族自治区皮肤病防治研究所,广西 南宁 530003]
沙眼衣原体引起的泌尿生殖道感染是全球范围内最为常见的性传播疾病之一。2008年,世界卫生组织估计每年新发感染的病例达1.3亿例[1],沙眼依原体感染可导致尿道炎、子宫颈炎或盆腔炎等。如果感染者未能得到及时的诊治,会导致沙眼衣原体持续传播并可能引起继发的后遗症,如盆腔炎、异位妊娠,甚至不孕症。近70%的女性和50%的男性泌尿生殖道感染沙眼衣原体后临床症状隐匿[2],且与其他感染引起的症状相似,临床医生对沙眼衣原体感染的明确诊断主要依据实验室的病原学检测结果。目前,临床诊断沙眼衣原体感染的方法主要包括:胶体金免疫层析法、酶联免疫吸附试验、培养法和核酸检测法等,其中核酸检测法在美国、欧洲等发达地区已经被推荐为沙眼衣原体检测的首选方法[2-3]。
目前,美国食品药品监督管理局共批准5家公司的商品化试剂用于泌尿生殖道沙眼衣原体感染的诊断。截至2018年6月,中国食品药品监督管理局已批准28家单位生产沙眼衣原体的核酸诊断试剂,共29种产品。29种产品中采用聚合酶链反应(polymerase chain reaction,PCR)-荧光探针法的27种,采用PCR-膜杂交法的1种,采用RNA恒温扩增法的1种。此外,我国许多实验室也正在积极研制沙眼衣原体核酸检测的方法[4]。我国利用核酸试剂诊断泌尿生殖道沙眼衣原体感染的医疗机构数量正逐年增加,但尚无关于市售核酸检测试剂质量的报道。本研究采用临床样本对我国市售的部分使用频率较高的沙眼衣原体核酸检测试剂进行小样本的平行评估,为临床选择沙眼衣原体核酸诊断试剂提供参考。
1 材料和方法
1.1 研究对象
收集2016年10—12月在广西壮族自治区玉林市皮肤病研究所性病门诊就诊的患者101例,其中男16例,女85例。采集每例患者2份拭子样本,1份用于当地的检测,1份保存在-80℃冰箱,通过冷链方式运送至中国疾病预防控制中心性病控制中心参比实验室。本研究经中国医学科学院皮肤病医院(研究所)医学伦理委员会审批通过。
1.2 参评试剂
我国目前共批准沙眼衣原体核酸诊断试剂29种,结合2013—2017年全国沙眼衣原体检测质间质评反馈信息,最终选择国内使用频率较高、能够应用LightCycler 480荧光定量PCR仪进行扩增检测的7种核酸试剂,分别标为A、B、C、D、E、F、G试剂。
1.3 方法
1.3.1 定量样本处理 (1)定量样本制备。定量样本为实验室自制,由9例样本组成,其中阳性样本8例、阴性样本1例。阴性样本选用McCoy葡萄糖细胞保存液。阳性质控样本的制备按照以下步骤进行:采用细胞培养法对沙眼衣原体参考菌株(E-Bour)进行扩大培养。培养物经裂解混匀后采用G试剂进行定量及均一性检测。根据上述结果,将沙眼衣原体裂解后,纯培养物利用G试剂进行定量,测定的浓度为5.0×108,吸取20 μL纯培养物,用80 μL保存液进行稀释,混匀后进行10倍等比例稀释,共计8个浓度,稀释后的纯培养物再利用达安试剂进行定量检测,以测定每个稀释浓度下的纯培养物浓度:101拷贝/mL~108拷贝/mL;分别将50 μL上述梯度稀释的菌悬液滴加在拭子的纤维部位,置于37℃恒温孵箱中干燥4 h,取出后置于 4℃冰箱备用。(2)定量样本处理。所有定量样本的DNA提取和扩增试验均按照各试剂说明书的要求进行。根据试剂说明书检测结果的解释对检测结果进行阴性、阳性的判定。利用定量试剂对10个同一浓度的弱阳性质控(104拷贝 / mL)进行重复性检测,将检测所得的循环时间带入标准曲线后计算浓度,然后根据计算所得的浓度计算离散系数。
1.3.2 临床样本处理 (1)DNA提取。用生理盐水洗脱所有临床拭子样本。采用Qiagen公司生产的QIAxtractor全自动核酸纯化仪提取DNA,实验操作按照说明书进行,每例样本获得200 μL DNA液,平均分为2份,保存于1.5 mL的冻存管中,放置于-20℃冰箱待用。(2)核酸扩增检测。按照试剂说明书对101例临床拭子样本的DNA提取液进行核酸的扩增检测。根据试剂说明书对检测结果进行阴性、阳性的判定。
1.4 统计学方法
比较各试剂对质控品结果的吻合度,选择吻合度最高的试剂作为此次试剂平行比较的参考试剂,计算各种不同检测方法的特异性、灵敏性、“参考试剂”之间的一致性。采用McNemar χ2检验比较不同试剂对临床样本的检测性能,以P<0.05为差异有统计学意义。
2 结果
2.1 各试剂基本情况比较
试剂扩增检测的时间为2~3 h,但C试剂扩增步骤较其他检测试剂繁琐,需要在PCR反应管中先加入核酸释放剂及待测样本后,再加入PCR混合液,然后离心。适宜样本:7种试剂适用的样本均为宫颈拭子和尿道拭子,未提及无创伤性样本(尿液样本)。扩增方法均以Taq酶水解荧光探针作为检测探针。见表1。
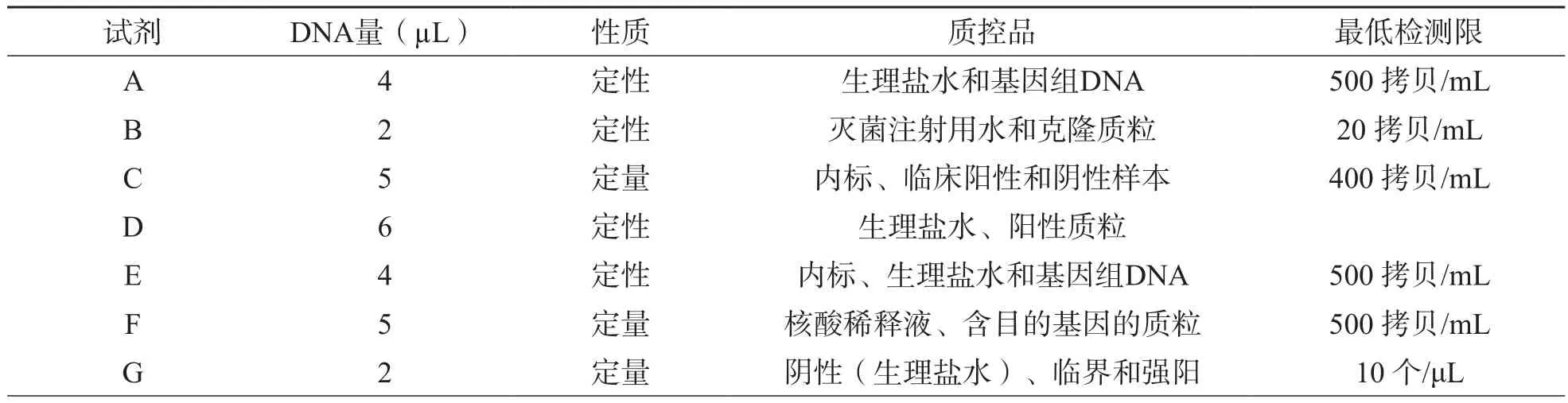
表1 各试剂的基本情况比较[2]
2.2 定量样本检测结果
对照7种试剂的说明书进行阴性、阳性的判断,所有试剂对9例样本的检测结果见表2。其中A试剂和B试剂在检测浓度为101拷贝/mL的样本时未能计算出Ct值;A试剂在检测<102拷贝/mL的样本时、F试剂在检测<103拷贝/mL的样本时、B试剂在检测<104拷贝/mL的样本时Ct值超过了其阳性的评判标准。对照说明书的给出的检测限,F试剂和B试剂检测定量样本并未达到其说明书所给出的检测限。C试剂和F试剂检测阴性样本时能够计算出Ct值,这2种试剂检测阴性样本时荧光定量曲线有翘尾,见图1。对3种定量核酸试剂104拷贝/mL的样本(含样本处理过程)重复检测10次后,C试剂、G试剂和F试剂的均数及变异系数分别是6.26×103拷贝/mL、3.56%,2.91×104拷贝/mL、1.46%和5.04×104拷贝/mL、2.60%。
综合各检测试剂对不同浓度定量样本及定量试剂检测的变异系数,最终拟选择2种定性试剂(E试剂,D试剂)作为参考试剂。
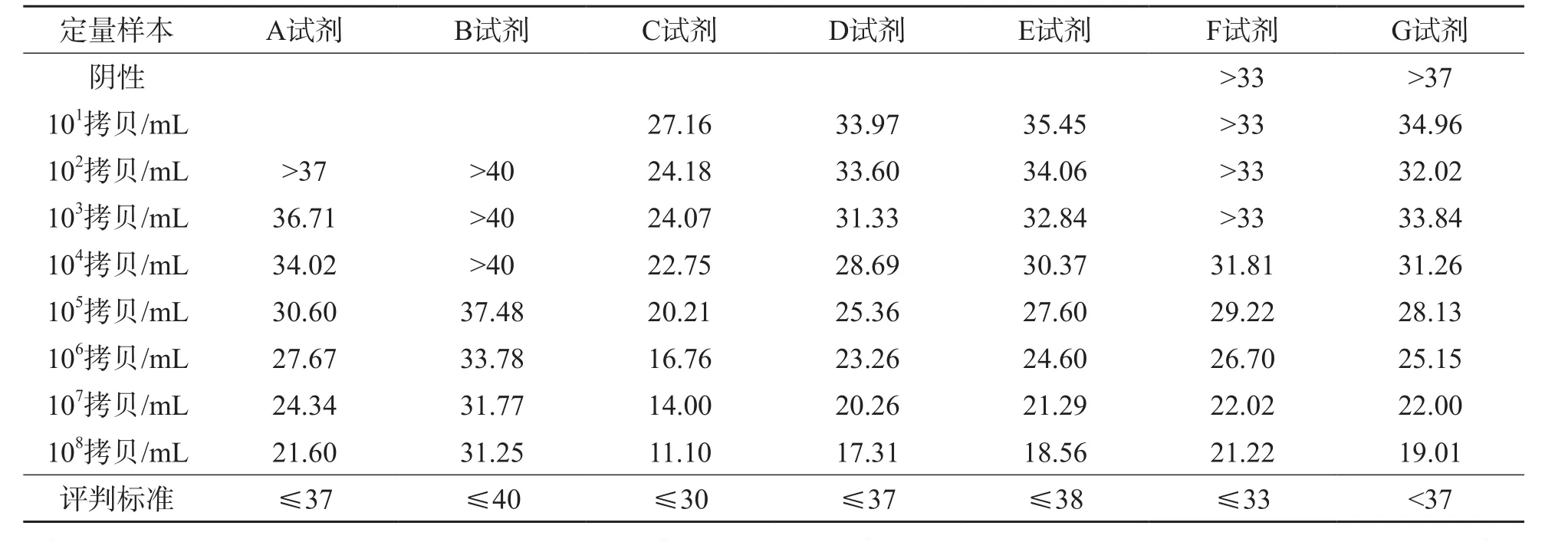
表2 7种国产核酸检测试剂检测定量样本的Ct值比较
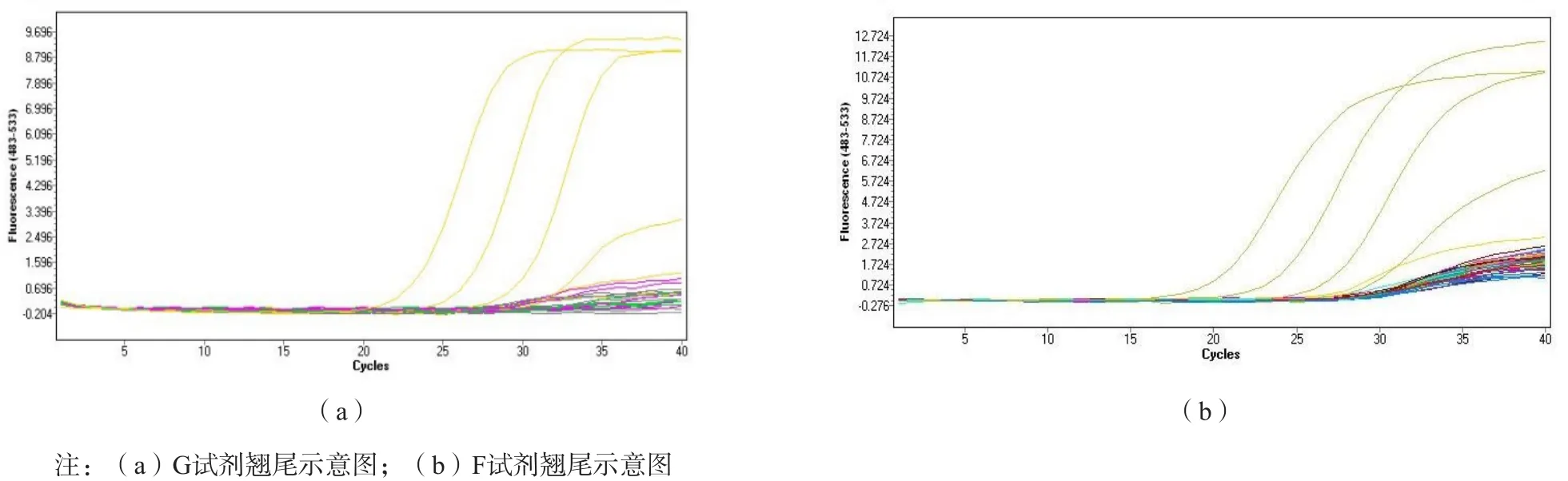
图1 G试剂、F试剂检测阴性样本荧光定量曲线
2.3 临床样本的检测结果
E试剂和D试剂检测101例临床样本的结果一致(18例阳性,83例阴性),其余5种试剂共有7例临床样本检测结果与参考试剂不一致。其中450100-007、450100-055、450100-110及450100-194号样本仅有1种试剂检测出阳性,450100-003和450100-150号样本有2种试剂出现了漏检,见表3。5种核酸试剂与参考试剂检测比较结果见表4。各试剂与参考试剂的性能差异没有统计学意义(A试剂和G试剂与参考试剂比较χ2=0.00,P=1.000;C试剂与参考试剂比较χ2=0.00,P=1.000;F试剂与参考试剂比较χ2=0.25,P=0.617;B试剂与参考试剂比较χ2=0.50,P=0.479。
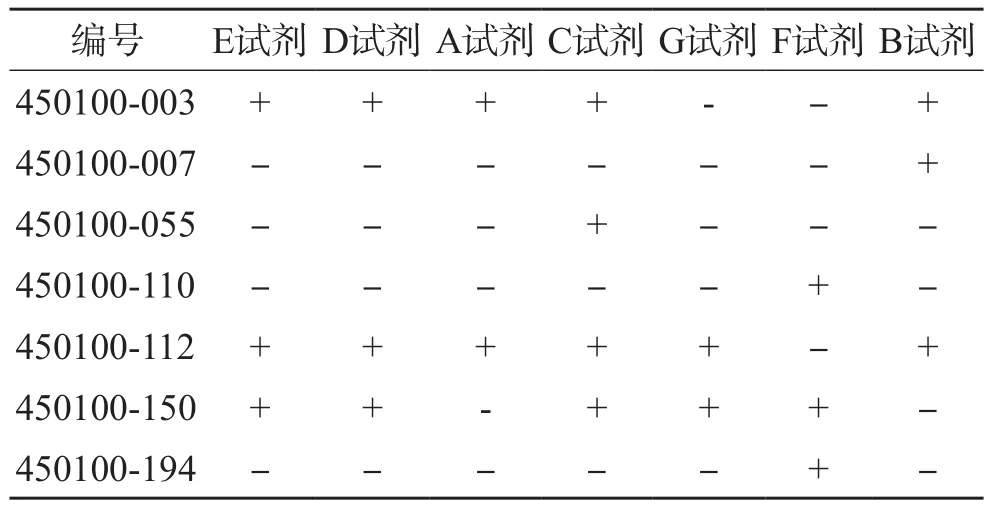
表3 7种核酸试剂与参考试剂检测结果比较

表4 5种核酸试剂与参考试剂检测结果的比较
3 讨论
本研究对我国目前常用的沙眼衣原体核酸检测试剂的检测结果进行了平行比较。结果显示:F试剂和B试剂在对定量样本和临床DNA样本的检测性能均较其他试剂的性能低,A试剂在检测定量样本时对低浓度样本(101拷贝/mL)未能检测出,E试剂和D试剂因对质控品检测的性能较好被选为参考试剂,对临床样检测的结果与其他半数以上的核酸试剂检测结果一致,另外5种核酸试剂与参考试剂检测结果比较后,敏感性为88.89%~100%,特异性为97.59%~100%,各试剂与参考试剂的检测敏感性有一定的差异,但差异无统计学意义(P>0.05)。本研究评估的7种国产核酸试剂的特异性与赵广录等[6]报道的2种核酸试剂的特异性类似,均能达到95%以上,这与美国食品药品监督管理局批准的5种沙眼衣原体核酸检测试剂的特异性相当[7-9]。但是国产核酸试剂中部分试剂的敏感性尚未达到90%,与赵广录等[6]结果相似,因此这些试剂的生产厂商需要进一步提升产品敏感性。
生殖道沙眼衣原体感染可以通过检测泌尿生殖道脱落的上皮细胞加以明确。脱落的上皮细胞不仅可以通过拭子采集,还可以通过尿液样本检测,检测尿液样本可以促进对无症状患者的筛查,同时还可以降低采集的成本[11]。此外也可进行多种试剂的平行评估。但此次参评的7种核酸检测试剂均仅适用于男性尿道拭子和女性宫颈拭子样本。因此检测该类试剂在今后的研发中应关注对无创性样本的检测。
本研究选用了尿道和宫颈拭子的DNA样本,对同一例样本的DNA进行扩增性能比较,是对沙眼衣原体核酸检测试剂扩增的效果进行的一次探索性评估,评估核酸检测试剂扩增的性能及使用的可接受性。为了平行比较多种核酸检测试剂的性能,本研究选用了国际认可的核酸提取试剂QIAxtractor全自动核酸纯化仪对样本的DNA进行了提取[12],节省了对临床样本的需求。但不可否认的是,这种评估方式忽略了对核酸试剂中DNA提取的评估。此外,因无法使用部分试剂的内标物质,没有分析试剂本身对阴性样本的质控结果。
判读实时PCR的检测结果最为关键的是阈值的设定,阈值的设定通常是3~15个循环的荧光信号标准偏差的10倍。7种国产试剂多数的阈值设定能够将阴性质控样本和阳性样本区分开,C试剂和F试剂检测阴性质控样本时荧光定量曲线出现翘尾,与低浓度样本质控样本的曲线较为接近,对于阈值设定较难,这对于后期结果的判断有很大的影响。
本研究中7种核酸试剂质控品均含有阴性质控、阳性质控或临界质控,但多数缺乏可以对核酸提取及扩增进行全程质控的内部参照物,因此无法确保所有的样本均能够进行有效的提取和扩增。此外还需要对其阴性质控品进行更深层的评估,多数试剂选用生理盐水作为质控品,生理盐水能够保证样本在核酸提取和扩增过程中不被污染,但是由于缺乏内部参照物,难以评估基质效应对临床样本的干扰,从而排除假阳性。
由于国外已有关于质粒缺失的新型变种沙眼衣原体的报道[13],建议我国核酸检测试剂中增加对新型变种沙眼衣原体的检测。本次平行比较所涉及的检测试剂均只能够检测沙眼衣原体,而核酸检测大的趋势是在同一个检测中实现对多种病原体的检测。
综上所述,我国目前常用的国产沙眼衣原体核酸试剂的特异性较高,但是部分品牌试剂的敏感性有待进一步提高。部分品牌试剂的质控品应增加能够全程控制的内部参照物。在试剂的应用范围上也应扩展至对无创伤性样本的检测,从而更好地应用于无症状患者的筛查。此外,国外多数核酸试剂已经实现全自动化,减少了污染的概率,更利于在大型医院及流行病学现场进行检测。mRNA能够更好地反映感染的状态,对临床随访,判断预后有重要的意义,国内的试剂生产厂商可以在这方面作出努力。

