急性髓性白血病患者淋巴细胞中CD39+CD4+CD25+T细胞比例与预后的相关性
章梁君, 钟辉秀, 杨新春
(自贡市第一人民医院检验科,四川 自贡 643000)
急性髓性白血病(acute myeloid leukemia,AML)是一种原始细胞在骨髓中快速增殖的高度异质性疾病[1]。在我国,AML的总体发病率为2.76例/10万人[2],且有逐渐增高的趋势。AML的发病机制目前尚不完全明确,骨髓微环境可能在AML的发生、发展中起重要作用。白血病细胞会产生许多免疫抑制因子,导致肿瘤的生长难以控制[3]。有研究结果显示,CD4+CD25+调节性T细胞在保持自身耐受和调节生理、病理状态的免疫应答方面起重要作用[4]。还有研究结果显示,非小细胞肺癌、卵巢癌、胃癌和急性白血病患者外周血CD39+CD4+CD25+T细胞比例显著升高[5-6]。CD4+CD25+T细胞的不同亚群通过不同的机制在免疫抑制中起不同的作用。CD39作为免疫抑制因子中非常重要的分子,可将细胞外的三磷酸腺苷(adenosine triphosphate,ATP)水解成腺苷二磷酸(adenosine diphosphate,ADP)和腺苷一磷酸(adenosine monophosphate,AMP),并通过这些水解产物发挥免疫抑制作用。免疫性疾病和肿瘤患者,尤其是慢性淋巴细胞性白血病患者CD4+CD25+T细胞CD39表达增加[7]。目前,尚未见CD39+CD4+CD25+T细胞比例在AML中的潜在功能及其与AML临床特征和进展关系的报道。为此,本研究拟探讨AML患者CD39+CD4+CD25+T细胞比例与AML临床特征的相关性及其在疾病过程中的变化。
1 材料和方法
1.1 研究对象
选取2014年1月—2015年12月自贡市第一人民医院确诊的、未经治疗的AML患者157例,其中男84例、女73例,年龄(45±16)岁,根据法美英(French-American-British,FAB)形态学分型标准及2008年世界卫生组织(World Health Organization,WHO)造血和淋巴组织肿瘤分类标准中的免疫表型标准,将患者分为AML-M1组(23例)、AML-M2组(40例)、AML-M3组(25例)、AML-M4组(37例)和AML-M5组(32例)5个亚组。排除已治疗患者、伴有其他肿瘤患者、自身免疫性疾病患者、病毒感染患者、混合型白血病患者及慢性白血病急性转化患者。另选取同期自贡市第一人民医院体检健康者41名作为正常对照组,其中男23名、女18名,年龄(48±11)岁。AML患者和正常对照者性别、年龄差异均无统计学意义(P>0.05)。本研究经自贡市第一人民医院医学伦理委员会批准。
1.2 方法
采集所有研究对象静脉血2 mL,乙二胺四乙酸二钾抗凝。收集AML患者的临床特征(年龄、性别)和各项检查[血常规、骨髓报告中原始细胞比例、骨髓免疫表型、胸腹部B超、电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)、脑脊液检查]结果。白血病的髓外浸润定义为骨髓以外的其他组织或脏器发现有白血病细胞浸润的证据。髓外浸润的判定标准基于CT或MRI及脑脊液检查结果。
1.3 流式细胞术分析
取CD45-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)(美国Beckman-Coulter公司)、CD39-藻红蛋白(phycoerythrin,PE)(美国eBioscinece公司)、CD4-藻红蛋白花青苷5(phycoerythrin cyanin 5,PC5)(美国Beckman-Coulter公司)和CD25-藻红蛋白德州红(energy coupled dye,ECD)(美国Beckman-Coulter公司)抗体各10 μL,连同种型对照抗体一并加入到100 μL全血中,在室温、黑暗环境中孵育15 min。加入2 mL 1×红细胞(red blood cell,RBC)裂解缓冲液(美国Beckman-Coulter公司)裂解RBC。用磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤细胞2次。通过EPICS XL流式细胞仪(美国Beckman-Coulter公司)获得至少10 000个细胞并进行分析。使用相应的同种型对照抗体门控阴性细胞。采用EXPO32 ADC XL4和EXPO32 ADC分析软件分析结果。根据形态学参数[CD45/侧向角散射(side scatter,SSC)]筛选淋巴细胞群。计算淋巴细胞中CD3+CD4+CD25+CD39+T细胞的百分比。根据CD39+CD4+CD25+T细胞占淋巴细胞的比例将AML患者分为3组:低水平组(CD39+CD4+CD25+T细胞<5%,35例)、中水平组(CD39+CD4+CD25+T细胞为5%~10%,60例)和高水平组(CD39+CD4+CD25+T细胞 >10%,62例)。为排除CD4+CD25+T细胞比例对CD39+CD4+CD25+T细胞比例的影响,根据CD4+CD25+T细胞比例将AML患者分为低水平组(CD4+CD25+T细胞<8.8%,35例)、中水平组(CD4+CD25+T细胞为8.8%~14.9%,60例)和高水平组(CD4+CD25+T细胞>14.9%,62例),分析3组髓外浸润及CD34、CD7的表达情况。
1.4 统计学方法
采用SPSS 13.0软件进行统计分析。呈正态分布的数据以x ±s表示,2个组之间比较采用t检验,多组间比较采用方差分析。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,采用Cruskal-Wallis秩和检验。计数资料以率表示,组间比较采用χ2检验。绘制Kaplan-Meier曲线表示化疗缓解持续时间。以P<0.05为差异有统计学意义。
2 结果
2.1 AML组与正常对照组CD39+CD4+CD25+T细胞比例的比较
AML组及各亚组CD39+CD4+CD25+T细胞比例均明显高于正常对照组(P<0.05),其中AML-M2组CD39+CD4+CD25+T细胞比例最高(12.85%),AML-M1组最低(5.51%)。AML组与正常对照组之间CD4+CD25+T细胞比例差异无统计学意义(P>0.05),但AML-M1患者明显低于正常对照者(P<0.05)、AML-M2患者明显高于正常对照者(P<0.05)。见表1、图1。
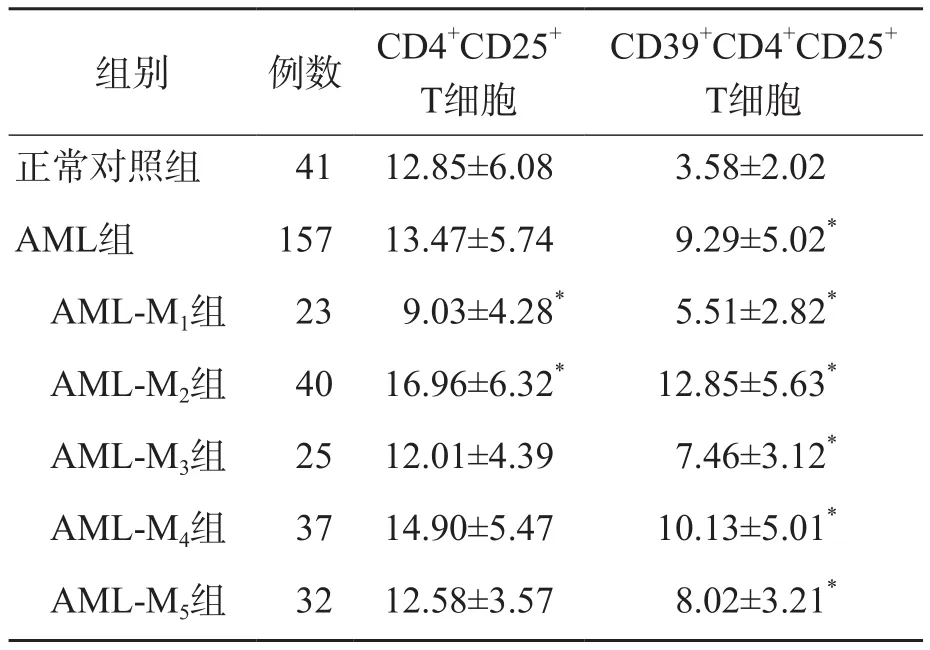
表1 AML组与正常对照组CD4+CD25+T细胞比例和CD39+CD4+CD25+T细胞比例的比较 (%,x±s)
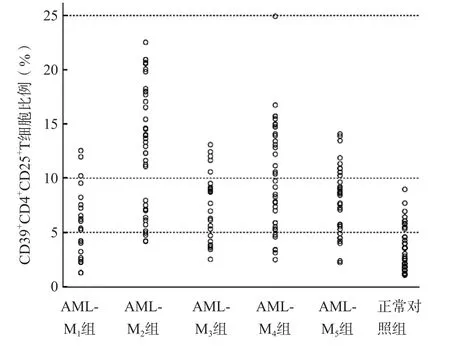
图1 正常对照组及AML各亚组CD39+CD4+CD25+T细胞比例的分布
2.2 不同CD39+CD4+CD25+T细胞和CD4+ CD25+T细胞水平组AML患者各项检查结果的比较
CD39+CD4+CD25+T细胞低水平组、中水平组和高水平组髓外浸润比例及骨髓原始细胞CD34、CD7阳性率依次升高,各组间差异有统计学意义(P<0.05)。RBC计数、白细胞(white blood cell,WBC)计数、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)计数、肝脾肿大患者比例、骨髓原始细胞比例和原始细胞表达人类白细胞抗原-DR(human leukocyte antigen-DR,HLA-DR)、CD56、CD19的比例3组之间差异均无统计学意义(P>0.05)。见表2。
CD4+CD25+T细胞低水平组、中水平组和高水平组之间髓外浸润比例及CD34、CD7阳性率差异均无统计学意义(P>0.05)。见表3。

表2 CD39+CD4+CD25+T细胞低水平组、中水平组、高水平组各项检查结果的比较
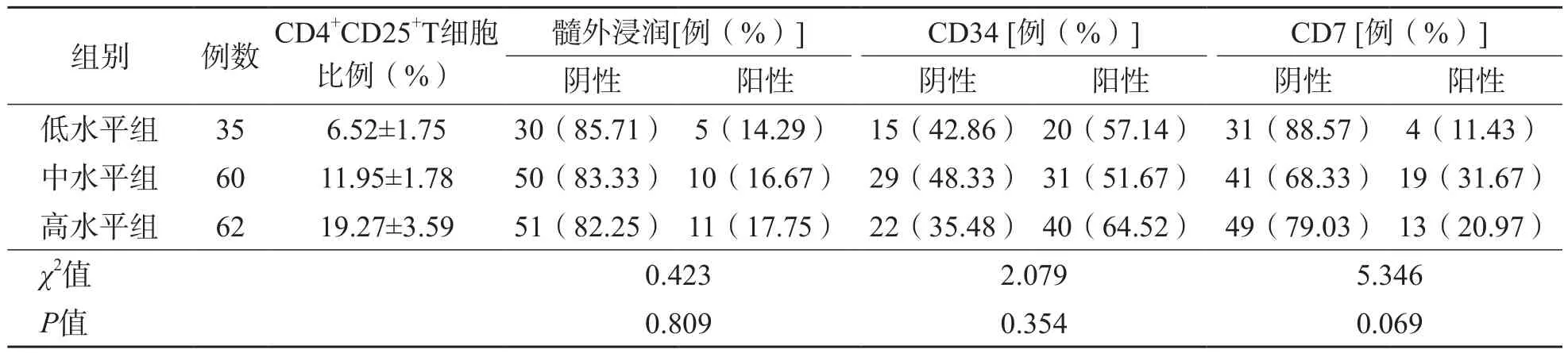
表3 CD4+CD25+T细胞低水平组、中水平组和高水平组各项指标的比较
2.3 CD39+CD4+CD25+T细胞比例和CD4+CD25+T细胞比例与化疗间隔时间的关系
157例AML患者中有33例接受DA(柔红霉素和阿糖胞苷)标准化疗,包括5例AML-M1患者、7例AML-M2患者、12例AML-M4患者和9例AML-M5患者。本研究记录患者1年中的下次治疗时间(time to next treatment,TTT),即从首次活动性发病治疗开始到下一次治疗之间的间隔时间。与CD39+CD4+CD25+T细胞低水平组比较,中水平组和高水平组TTT较短(P<0.05)。CD4+CD25+T细胞低水平组、中水平组和高水平组之间TTT差异无统计学意义(P>0.05)。见图2、图3。

图2 不同CD39+CD4+CD25+T细胞比例AML患者的Kaplan-Meier曲线

图3 不同CD4+CD25+T细胞比例AML患者的Kaplan-Meier曲线
3 讨论
CD39作为多个细胞表面的关键酶,可将细胞外的核苷三磷酸(nucleoside triphosphate,NTP)分解成核苷二磷酸(nucleoside diphosphate,NDP)和核苷一磷酸(nucleoside monophosphate,NMP)。核苷酸的分解代谢产物可能对多种生理、病理过程产生影响,如血液凝固、血管生成、炎症、免疫、增殖和凋亡。有研究结果显示,CD4+CD25+T细胞上表达的CD39可将ATP分解为腺苷,CD39是能抑制免疫反应活性的物质[8]。AML是一种恶性血液病,其白血病细胞产生的免疫抑制因子可导致肿瘤生长失控[3]。CD39+CD4+CD25+T细胞可诱导抗肿瘤免疫反应减弱,使疾病进一步恶化[9],其免疫抑制作用部分归因于胞外水解酶CD39水解ATP的重要作用[10]。
本研究结果显示,AML组CD4+CD25+T细胞比例与正常对照组比较差异无统计学意义(P>0.05),而CD39+CD4+CD25+T细胞比例明显高于正常对照组(P<0.05)。AML-M1患者CD4+CD25+T细胞比例明显低于正常对照者(P<0.05),而CD39+CD4+CD25+T细胞比例则明显高于正常对照者(P<0.05),说明AML-M1患者CD39+比例升高最为明显。AML-M2患者CD4+CD25+T细胞比例和CD39+CD4+CD25+T细胞比例均明显高于正常对照者,因此不排除CD39+的升高是由CD4+CD25+T细胞比例升高所致。DULPHY等[11]的研究结果显示,与正常对照者相比,AML患者CD4+T细胞中CD39+T细胞比例更高,与本研究结果一致。还有研究结果显示,各种实体肿瘤如头颈肿瘤、结肠癌直肠癌、肝癌和胃癌,特别是慢性淋巴细胞白血病,其临床分期与CD39水平相关,患者的CD39表达水平明显升高[12-13]。
调节性T细胞是CD4+T细胞的重要亚群,其在维持免疫系统的体内平衡和对抗外来抗原的过度免疫应答中起至关重要的作用。在肿瘤微环境中,CD39+CD4+CD25+T细胞主要通过多个表面分子、细胞接触依赖和细胞因子分泌来介导免疫抑制反应。近年来,学者们已发现了CD39-CD73腺苷途径的新作用。CD39是胞外核苷酸酶的级联限速酶,其产生的腺苷可抑制CD4+T细胞和CD8+T细胞的功能以及自然杀伤细胞的抗肿瘤活性[14]。本研究结果显示,CD39+CD4+CD25+T细胞高水平组发生髓外浸润比例较高,TTT更短;但CD4+CD25+T细胞低、中、高水平组之间髓外浸润和TTT差异均无统计学意义(P>0.05)。说明CD39+CD4+CD25+T细胞比例较高的AML患者病情更为严重,预后更差[7]。CD4+CD25+T细胞上的CD39表达或可作为AML患者的预后标志,但还需要进一步研究来证实。
此外,本研究结果还显示骨髓中原始细胞表达CD34和CD7的AML患者CD39+CD4+CD25+T细胞比例更高。1989年,HAYNES等[15]从AML患者分离出白血病干细胞,证实只有表达CD34的白血病细胞才能形成集落,CD34可能是肿瘤干细胞的细胞表面标志物。本研究结果显示,原始细胞CD34阳性组CD39+CD4+CD25+T细胞高水平组患者比例(72.58%)明显高于CD34阴性组(27.42%)。有研究结果显示,CD34可通过改变CD4+细胞的分子组成对免疫抑制反应产生影响[16]。因此,原始细胞表达CD34在改变CD4+淋巴细胞CD39表达中起着一定的作用。CD7是一种糖蛋白,是T细胞发育中的特征标志物之一,曾被证实在分化成T细胞、B细胞和髓细胞的多能造血干细胞中表达。有研究结果显示,白血病细胞也可表达CD7和CD34[17],说明CD7分子是一种早期分子标志物。本研究结果显示,CD39+CD4+CD25+T细胞比例升高与细胞发育阶段可能存在联系,但仍需进一步研究证实。同时,CD7和CD34也是AML患者预后差的标志物[18]。因此,CD39+CD4+CD25+T细胞比例可能与AML预后有关。
总之,AML患者CD39+T细胞比例明显增高,可能与AML患者髓外浸润、CD34阳性率、CD7阳性率及预后有关。由此可见,AML患者CD39+T细胞比例增高可能是白血病细胞的重要免疫逃逸机制。CD39或可作为AML疾病发展的新标志物和新治疗靶点。

