固溶体MAX相(Ti0.5V 0.5)3AlC2的制备及其对MgH 2储氢性能的催化影响
张 欣 沈正阳 简 旎 姚建华 高明霞 潘洪革 刘永锋*,
(1浙江工业大学激光先进制造研究院,浙江省高端激光制造装备协同创新中心,杭州 310014)
(2硅材料国家重点实验室,浙江省电池新材料及应用技术重点实验室,浙江大学材料科学与工程学院,杭州 310027)
0 引 言
能源危机和环境恶化促使人们加速开发和利用清洁可再生能源[1]。氢能由于具有清洁无污染、燃料热值高、储量丰富等优点,得到了研究人员的广泛关注。但是,安全、高效和经济的氢储存一直是制约氢能产业化应用的瓶颈。氢通过与材料反应生成氢化物,具有独特的安全性和高的能量密度。因此,开发材料基固态储氢技术至关重要,包括:储氢合金、金属氢化物储氢材料和配位氢化物储氢材料等[2-33]。
MgH2作为一种典型的金属氢化物储氢材料,理论储氢容量高达7.6%,且具有良好的吸-放氢可逆性,是目前最受关注的高容量储氢材料之一[9-12]。但MgH2的热力学稳定性较高,放氢温度在300℃以上,放氢速率缓慢,距实用化要求尚有较大差距。目前,如何降低MgH2的吸-放氢温度,提高其吸-放氢动力学性能,是储氢材料研究领域的一个重点[11]。研究表明[13-32],通过成分调变[13-15]、形成纳米结构[16-18]和添加催化剂[19-32]等,可有效改善MgH2的储氢性能。特别是通过优化催化剂,可以在尽量减小储氢容量损失的基础上,显著改善MgH2的吸-放氢动力学性能。针对MgH2基储氢材料,研究人员已经合成了大量的催化剂,包括:碳材料催化剂[19-20]、稀土金属基催化剂[21-23]和过渡金属基催化剂[24-32]。其中,过渡金属化合物被发现是最有效的催化剂[24-32]。
Hanada等[24]报道了Nb2O5掺杂MgH2样品的放氢产物在室温、1 MPa氢压下,15 s内可吸收约4.5%的氢气。 Liang等[25]对比研究了 Ti、V、Mn、Ni和Fe等过渡金属对MgH2的影响,发现这些金属的催化活性顺序为:Ti>V>Fe>Ni>Mn。Cui[26]等利用多价态Ti基催化剂将MgH2的起始放氢温度降低至175℃;样品在250℃条件下,15 min内可放出5%的氢气。Wang 等[27]研究指出,在金属 Ti、TiF3、TiO2和 TiN中,TiF3改性的MgH2样品具有较为优异的吸-放氢性能,样品的起始放氢温度约为173℃,较原始MgH2降低了近100℃。最近,我们课题组将Ti基层状MAX相Ti3AlC2引入MgH2。结果显示,Ti基MAX相的出现显著降低了MgH2的吸-放氢温度,其中添加7%Ti3AlC2的MgH2材料在300℃下,3min内即可放出5.6%的氢气;放氢后的材料在150℃、60 s内即可重新吸氢5.8%[29]。此外,V基化合物也呈现出较高的催化活性。Malka等[30]通过添加VCl2将MgH2的起始放氢温度从418℃降低至237℃。Oelerich等[31]的研究结果表明,MgH2-V2O5在300℃下保温7 min,可以放出6.7%的氢气。Wang等[32]以MIL-74(V)为模板,制备了无定形碳负载的纳米V2O3复合催化剂,将其与MgH2混合球磨后发现,MgH2-9%V2O3@C的起始放氢温度为215℃,较原始MgH2降低了60℃,在275℃时保温20 min,可放出约6.4%的氢气。更重要的是,Jia等[33]的研究显示,Ni-VOx共催化的 MgH2在 300℃、10 min可以放出6.5%的氢。放氢样品在150℃、2.03 MPa的条件下,吸氢量可达6.2%,预示着多元催化剂具有更为优异的催化活性,特别是含有Ti、V等过渡金属元素的化合物。
固溶体MAX相是一类三元金属碳化物或氮化物材料,能够同时包含多种过渡金属元素,且化学稳定性高,具有独特的纳米层状结构,易于球磨分散[29,34],因此有希望在催化MgH2储氢材料吸-放氢方面提供更高的活性。基于上述思路,我们利用无压烧结法制备了Ti和V二元固溶体MAX相(Ti0.5V0.5)3AlC2, 系统研究了其添加对 MgH2吸-放氢反应性能的影响。结果显示,添加质量分数10%(Ti0.5V0.5)3AlC2的 MgH2样品可逆储氢容量为 6.9%,起始放氢温度为230℃,较原始MgH2降低了60℃;放氢样品在室温即可开始吸氢,在150℃、5 MPa氢压条件下,60 s内可吸收4.7%的氢气,吸氢速率较原始MgH2显著提升。结构表征和热力学、动力学性能分析发现,固溶体MAX相在MgH2放氢过程中保持稳定,其主要通过降低反应动力学能垒降低吸-放氢反应温度。
1 实验部分
1.1 样品制备
Ti粉和V粉(纯度99%)购于阿拉丁,Al粉(纯度99%)和 C粉(纯度 99.8%)购于 Alfa Aesar。 固溶体MAX相催化剂的合成采用无压烧结法,具体过程为:按照物质的量之比 nTi∶nV∶nAl∶nC=1.5∶1.5∶1.7∶2 的配比,称取10 g的Ti粉、V粉、Al粉和C粉,装入球磨罐,以300 r·min-1转速球磨混合 12 h,球料比为 10∶1。原料混合均匀后,称取一定量的混合粉末装入氧化铝坩埚中,将装有样品的坩埚在井式气密石墨炉中(Ar气氛), 以 10℃·min-1的升温速率加热至1 450℃,保温2 h烧结。然后随炉冷却,得到致密块体样品,将其机械研磨成粉末,即得固溶体MAX相催化剂。实验用 MgH2由 Mg粉(Macklin,纯度 99%)在 340℃、2 MPa氢压下经20 h保温氢化制得。将制备得到的 MAX 相(Ti0.5V0.5)3AlC2与 MgH2按照一定配比,在5MPa氢压下,以500 r·min-1转速混合球磨24 h,获得 MgH2-x%(Ti0.5V0.5)3AlC2(x%为质量分数,x=0,5,7,10,15)样品,球料比为 100∶1。实验中,为防止空气中水分和氧气对样品的污染,涉及MgH2样品的保存、取样和装样等操作均在氩气氛手套箱(德国MBRAUN)中进行,其H2O和O2浓度保持在1.0×10-6(V/V)以下。
1.2 成分、结构和形貌表征
材料的物相组成和晶型结构分析在X射线粉末衍射仪(XRD,MiniFlex 600 Rigaku,Rigaka)上进行,采用 Cu Kα(40 kV,40 mA)为辐射源(λ=0.154 nm),数据采集在室温进行,扫描范围为 10°~90°(2θ)。
材料的微观形貌和粒径尺寸观察在扫描电子显微镜(SEM,S4800,Hitachi)上进行,仪器加速电压为 30 kV, 样品室真空度为 7×10-4Pa;Mg、Ti、V 和Al元素分布采用能量色散X射线谱仪(EDS)进行分析。测试前,在充有氩气的手套箱中将粉末样品分散在导电碳胶上,然后在高纯氩气氛保护下快速转移至测试仪器内。
1.3 吸-放氢性能测试
样品的吸-放氢性能测试在实验室自行搭建的Sieverts测试系统上进行,测试样品量约为60 mg。放氢测试时,先将测试系统抽至真空(约1.33 Pa),然后进行测试。其中,随温放氢试验的升温速率为2℃·min-1;等温放氢测试时,以 10℃·min-1的升温速率将样品快速加热至目标温度,然后进行保温。吸氢测试时,先将测试系统抽至真空后,充入5 MPa高纯氢气。随温吸氢测试的升温速率为1℃·min-1;在等温吸氢测试时,为避免MgH2在升至目标温度前就开始吸氢,首先将样品在真空下快速升温至目标温度后,再充入5 MPa高纯氢气进行测试。采用程序升温脱附系统(temperature-programmeddesorption,TPD)对样品的放氢行为进行定性测试,测试样品量约为40 mg。测试温度范围是室温至400℃,升温速率2℃·min-1,测试载气为高纯氩气。样品放氢过程的热效应在Netzsch DSC 200 F3仪器上进行表征,该仪器放置在氩气气氛手套箱内,测试样品量为1~2 mg,装样坩埚为氧化铝坩埚,测试温度范围为室温至400℃,升温速率2℃·min-1。

图1 (Ti0.5V0.5)3AlC2 的 XRD 图 (a)及 SEM 照片 (b)Fig.1 XRD pattern (a)and SEM image (b)of(Ti0.5V0.5)3AlC2
2 结果与讨论
2.1 MAX相(Ti0.5V 0.5)3AlC2的成分、结构和形貌表征
首先对烧结制备得到的(Ti0.5V0.5)3AlC2样品进行XRD分析。图1a所示为1 450℃下烧结样品的XRD图。明显地,烧结样品的XRD衍射峰与文献报道的固溶 MAX 相(Ti0.5V0.5)3AlC2基本一致[34],相较于Ti3AlC2,衍射峰位置明显向高角度偏移,说明通过烧结物质的量之比为 1.5∶1.5∶1.7∶2 的 Ti-V-Al-C 混合物,可以制备得到 MAX 相(Ti0.5V0.5)3AlC2。 样品的XRD衍射峰强度较高,说明其结晶性较好。此外,在2θ=25.4°和52.6°处,也可以分别观察到TiVAlC和Ti3AlC2的衍射峰,但衍射峰的强度非常微弱,说明其含量较少。图1b是1 450℃下制备得到的(Ti0.5V0.5)3AlC2样品研磨后的SEM照片。由图可见,研磨后(Ti0.5V0.5)3AlC2样品的颗粒尺寸约为 20μm,呈现出明显的层状结构。已有的研究表明,(Ti0.5V0.5)3AlC2具有六方层状结构。该结构中金属Ti原子、V原子与C原子之间以强的共价键结合,与Al原子层之间以类似范德华力的弱键结合。这种特殊的结构不仅赋予了MAX相材料较高的弹性模量、耐磨性与自润滑性,也使其在很多催化反应中表现出较高的活性[28-29,34]。
2.2 MgH 2-x%(Ti0.5V0.5)3AlC2体系吸-放氢性能
将所制备 MAX 相(Ti0.5V0.5)3AlC2与 MgH2按一定比例进行混合球磨,制备得到(Ti0.5V0.5)3AlC2催化剂掺杂的MgH2体系,用以表征MAX相(Ti0.5V0.5)3AlC2的催化活性。 这里,为了解MAX相(Ti0.5V0.5)3AlC2是否具有储氢活性,我们也将其在5 MPa氢压下球磨24 h。图2a为自制的MgH2的XRD图和SEM照片。由图可知,实验室制备的MgH2的衍射图与β相MgH2吻合较好,且峰型尖锐,说明制得了结晶性较好的β相MgH2。SEM照片显示,所用MgH2的颗粒尺寸在 0.5~2 μm。 图 2b 为制备的 (Ti0.5V0.5)3AlC2和MgH2-x%(Ti0.5V0.5)3AlC2(x=0、5、7、10 和 15)样品的体积放氢曲线。由图可知,氢压条件下球磨MAX相(Ti0.5V0.5)3AlC2没有氢气放出,但(Ti0.5V0.5)3AlC2的添加可以明显改善MgH2的放氢性能。为了便于比较,表1列出了测试样品的起始放氢温度、结束放氢温度和放氢量。可以看出,原始MgH2球磨后的起始放氢温度为290℃,完全放氢需加热至400℃,总放氢量约为7.5%,接近理论容量(7.6%)。当添加5%的(Ti0.5V0.5)3AlC2时,样品的起始放氢温度降低到255℃,较原始MgH2降低了45℃。随着催化剂添加量的增加,样品的放氢温度也逐渐降低,但由于(Ti0.5V0.5)3AlC2催化剂没有储氢活性,因此导致样品的有效放氢量逐渐减少。当(Ti0.5V0.5)3AlC2的添加量增加至10%时,样品的起始放氢温度约为230℃,较添加5% (Ti0.5V0.5)3AlC2相的样品进一步降低了15℃。随温加热至350℃时,样品可实现完全放氢,总放氢量在6.9%左右。进一步增加(Ti0.5V0.5)3AlC2的添加量至15%时,样品的放氢起始温度仅有5℃降低,放氢结束温度基本保持不变,但放氢量较添加10%(Ti0.5V0.5)3AlC2的样品进一步减少了0.5%, 总放氢量下降至6.4%。综合考虑体系的有效储氢容量和放氢温度,添加10%(Ti0.5V0.5)3AlC2样品具有较好的综合性能。
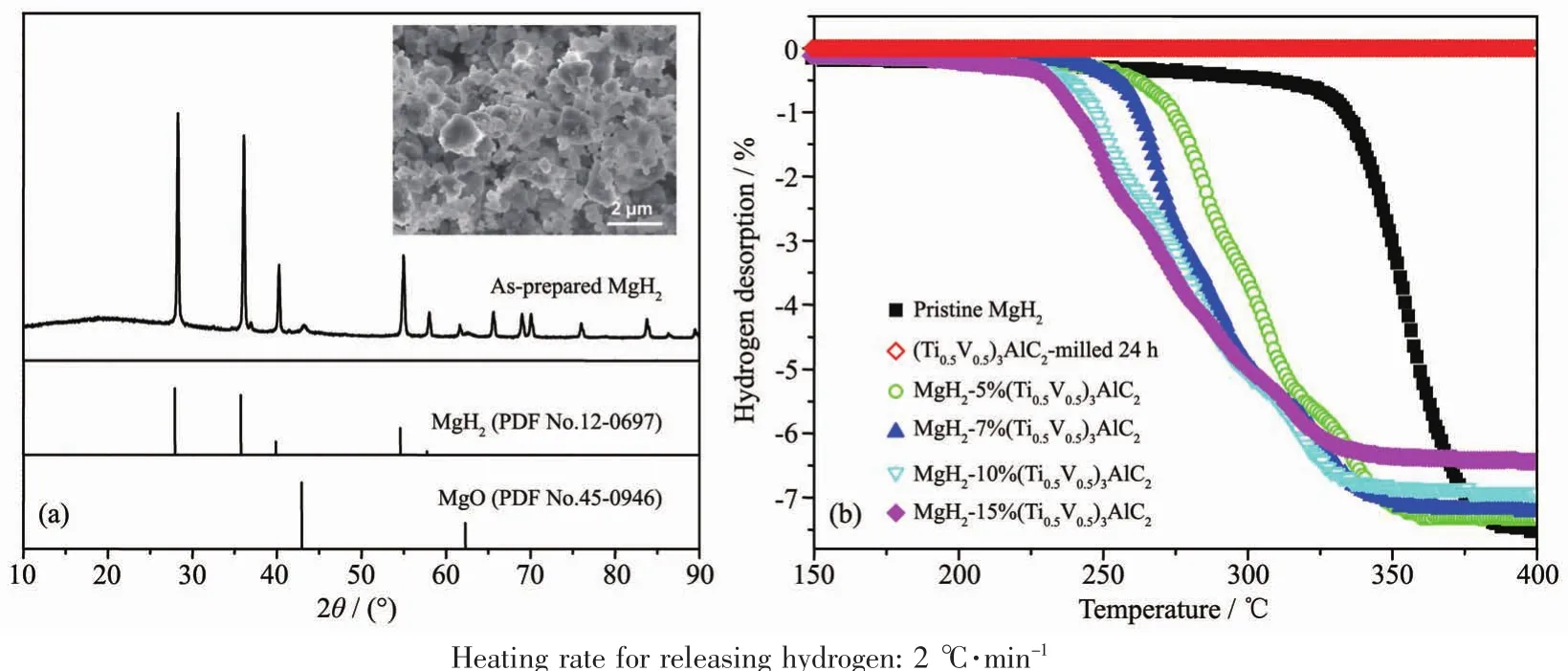
图2 (a)原始 MgH2的 XRD 图和 SEM 照片(插图);(b)MgH2-x%(Ti0.5V0.5)3AlC2样品的体积放氢曲线Fig.2 (a)XRD pattern and SEM image (Inset)of pristine MgH 2;(b)Volumetric release curves of MgH2-x%(Ti0.5V0.5)3AlC

表1 MgH 2-x%(Ti0.5V 0.5)3AlC2样品的体积放氢性能数据Table 1 Volumetric release properties of MgH 2-x%(Ti0.5V0.5)3AlC2
图3 比较了原始 MgH2和 MgH2-10%(Ti0.5V0.5)3AlC2样品的等温放氢曲线。从图中可以看出,添加(Ti0.5V0.5)3AlC2后,MgH2的放氢速率显著加快。 在275 ℃时,添加(Ti0.5V0.5)3AlC2样品在 10 min 内的放氢量即可达到3.1%,而在相同条件下,原始MgH2样品的放氢量不足1%。通过分析等温放氢曲线的斜率可知,添加(Ti0.5V0.5)3AlC2的样品在 275 ℃下的放氢速率约为0.35%·min-1,接近原始MgH2的4倍(0.09%·min-1)。 即使温度下降至 225℃, 添加(Ti0.5V0.5)3AlC2样品在 60 min内也可放出 1.7%的氢,而原始MgH2样品在相同的条件下基本不放氢。
为了研究添加 (Ti0.5V0.5)3AlC2对 MgH2样品吸氢性能的影响,将原始MgH2和MgH2-10%(Ti0.5V0.5)3C2样品的放氢产物在5 MPa氢压下进行了随温吸氢性能测试,测试结果如图4a所示。由图可知,原始MgH2样品的起始吸氢温度为110℃,加热至250℃时,吸氢量可达 6%。 而添加(Ti0.5V0.5)3AlC2后,体系的吸氢温度大幅度降低,在室温下即可开始吸氢。加热至 100 ℃时,添加(Ti0.5V0.5)3AlC2的样品的吸氢量可以达到3.4%。进一步升高温度至250℃时,样品的吸氢量增至6.5%。图4b比较了MgH2-10%(Ti0.5V0.5)3C2样品的首次放氢和二次放氢曲线。可以发现,经过一个循环后,样品的放氢温度略微降低,放氢行为基本不变,说明(Ti0.5V0.5)3AlC2具有较为稳定的催化活性。

图3 原始 MgH2 (a)和 MgH2-10%(Ti0.5V0.5)3AlC2样品 (b)的等温放氢曲线Fig.3 Isothermal dehydrogenation curves of pristine MgH2 (a)and MgH2-10%(Ti0.5V0.5)3AlC2 (b)

图4 原始 MgH2和 MgH2-10%(Ti0.5V0.5)3AlC2样品的随温吸氢曲线 (a)和 MgH2-10%(Ti0.5V0.5)3AlC2样品的前两个循环的放氢曲线 (b)Fig.4 Non-isothermal hydrogenation curves of dehydrogenated pristine MgH2 and MgH2-10%(Ti0.5V0.5)3AlC2 (a)and dehydrogenation curves of the MgH2-10%(Ti0.5V0.5)3AlC2 sample at first two cycles (b)
图5 所示为原始MgH2和添加 10% (Ti0.5V0.5)3C2样品的等温吸氢曲线 (50、100、150 和 200 ℃)。 结果显示,添加(Ti0.5V0.5)3C2的样品在 150 ℃和 5 MPa 氢压的条件下即可快速吸氢,其在60 s内的吸氢量约为4.7%;而在相同的温度和氢压下,原始MgH2放氢产物经过1 000 s的吸氢量仅为2.4%。即使在较低温度时,MgH2-10%(Ti0.5V0.5)3C2样品也呈现出良好的吸氢反应动力学性能。例如:在100℃条件下,添加(Ti0.5V0.5)3AlC2的样品在 300 s内可以吸收 2.4%的氢气;特别是在50℃时,也能观察到吸氢,而原始MgH2在100℃以下基本不吸氢。由此可见,添加(Ti0.5V0.5)3C2催化剂也可以降低 MgH2吸氢反应的温度,显著改善其吸氢性能。
2.3 (Ti0.5V 0.5)3AlC2催化剂在吸-放氢过程的变化
为了表征固溶MAX相在MgH2基体上的分布情况,对添加(Ti0.5V0.5)3AlC2的样品进行了 EDS 面扫描分析,结果如图6a所示。可以发现,样品经过球磨后,Ti、V、Al元素均匀地分布在 MgH2基体中,没有出现明显地偏聚现象,表明(Ti0.5V0.5)3AlC2在与 MgH2球磨过程中可以充分混合,均匀分散在MgH2基体中。
随后,对比分析了 MgH2-10%(Ti0.5V0.5)3C2样品球磨和放氢产物的XRD结果。如图6b所示,球磨样品的XRD中能够明显观察到β-MgH2的特征峰,峰型较宽,这可能与球磨造成MgH2晶体缺陷较多密切相关。此外,球磨样品的XRD图中可以明显观察到(Ti0.5V0.5)3AlC2的特征峰。当样品加热至400℃完全放氢后,样品中的MgH2完全分解为Mg。有趣的是,(Ti0.5V0.5)3AlC2的特征峰位置及强度保持不变,说明放氢前后其没有发生明显变化。由此可知,(Ti0.5V0.5)3AlC2在 MgH2放氢过程中能够稳定存在,主要发挥催化剂的作用。
为了阐明添加固溶MAX相对MgH2放氢动力学性能的影响,采用Kissinger法[35]计算了MgH2-10%(Ti0.5V0.5)3AlC2样品的放氢反应表观活化能(Ea),结果如图7a所示。结果表明,球磨后原始MgH2的放氢活化能约为153.8 kJ·mol-1,与文献中报道的结果相近[36-37]。 添加固溶体(Ti0.5V0.5)3AlC2后,MgH2的放氢活化能Ea降低至79.6 kJ·mol-1,较原始MgH2样品降低了约48%。表明添加Ti、V基固溶MAX相能够显著降低MgH2的放氢反应能垒,这是其放氢温度显著降低的关键原因。
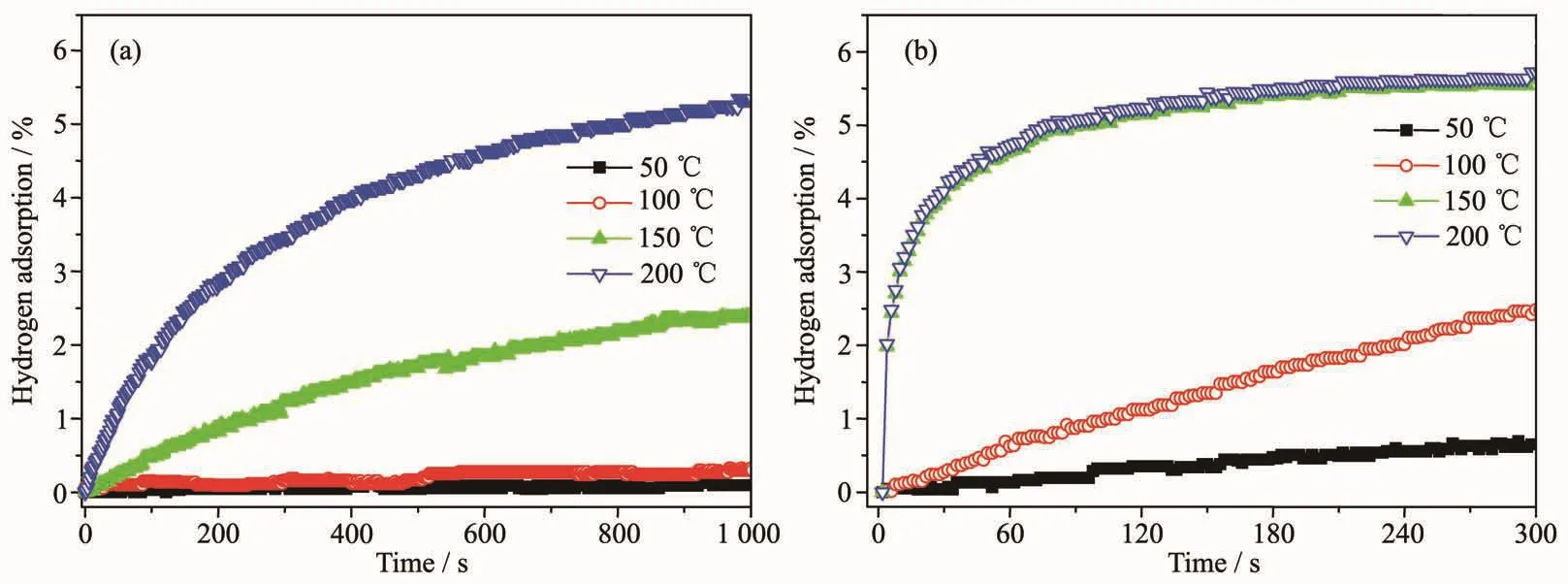
图5 原始 MgH2 (a)和 MgH2-10%(Ti0.5V0.5)3AlC2 (b)材料的等温吸氢曲线Fig.5 Isothermal hydrogenation curves of the dehydrogenated pristine MgH2 (a)and MgH2-10%(Ti0.5V0.5)3AlC2 sample (b)

图6 (a)MgH2-10%(Ti0.5V0.5)3AlC2样品的 SEM 照片和相应的 Mg、Ti、V、Al元素分布图;(b)(Ti0.5V0.5)3AlC2催化剂及MgH2-10%(Ti0.5V0.5)3AlC2样品放氢前后的 XRD 图Fig.6 (a)SEM images and EDSmappings of Mg,Ti,V and Al elements of the MgH2-10%(Ti0.5V0.5)3AlC2;(b)XRD patterns of (Ti0.5V0.5)3AlC2,as-milled and dehydrogenated MgH2-10%(Ti0.5V0.5)3AlC2 samples
图7b 是原始 MgH2和 MgH2-10%(Ti0.5V0.5)3AlC2样品的放氢DSC曲线。由图可知,样品的放氢过程伴随着吸热现象,暗示着样品的放氢过程是热力学可逆。此外,通过积分样品吸热峰的面积,可以计算得到样品的放氢反应焓变(H)。计算得到的MgH2-10%(Ti0.5V0.5)3AlC2样品的放氢反应焓变为 72.2 kJ·mol-1,与原始MgH2球磨后样品的放氢反应焓变非常接近(71.5 kJ·mol-1),表明添加(Ti0.5V0.5)3AlC2不会影响MgH2的吸-放氢反应热力学性能,只起到催化剂的作用。
众所周知,过渡金属Ti和V的电负性介于Mg与H之间,其同时存在可以降低Mg-H键强度,有利于MgH2的吸-放氢反应[36]。为了进一步理解(Ti0.5V0.5)3AlC2的催化活性, 我们设计和制备了Ti3AlC2和V2AlC及其单独添加的MgH2-10%Ti3AlC2和MgH2-10%V2AlC样品,将它们与MgH2-10%(Ti0.5V0.5)3AlC2样品的放氢性能进行对比。XRD表征显示,所制备Ti3AlC2和V2AlC(图1)与文献中报道的数据基本一致[29,34]。由图8对比发现,(Ti0.5V0.5)3AlC2、Ti3AlC2和 V2AlC 添加均可降低 MgH2的放氢温度。其中,添加V2AlC后MgH2的起始放氢温度降低至260℃,峰值温度降低至290℃,而添加Ti3AlC2的样品起始放氢温度为230℃,峰值温度为265℃。这一结果表明Ti元素对MgH2的催化活性要优于V元素,这主要是因为Ti的电负性(1.54)较V的(1.63)更低,对H的吸附作用更强,有利于MgH2中 Mg-H 键的解离[26]。而 MgH2-10%(Ti0.5V0.5)3AlC2样品的放氢峰值温度为252℃,均低于Ti3AlC2和V2AlC添加的体系。因此,我们认为二元固溶体MAX 相(Ti0.5V0.5)3AlC2对 MgH2放氢反应的催化活性要高于单一过渡金属 MAX 相(Ti3AlC2、V2AlC),这主要是因为固溶体MAX相(Ti0.5V0.5)3AlC2中Ti和V元素的共存可能发挥协同催化效应,有利于MgH2的吸-放氢反应的进行。

图7 原始 MgH2和 MgH2-10%(Ti0.5V0.5)3AlC2样品的 Kissinger拟合直线 (a)和 DSC 曲线 (b)Fig.7 Kissinger′s plots (a)and DSCcurves (b)of the pristine MgH2 and MgH2-10%(Ti0.5V0.5)3AlC2 samples

图8 MAX相掺杂MgH2的体积放氢曲线 (a)和TPD(b)Fig.8 Volumetric release curves (a)and TPD (b)of the MAX-phase-doped MgH2 samples
3 结 论
利用无压烧结法成功制备了二元固溶体MAX相(Ti0.5V0.5)3AlC2,发现其可显著改善 MgH2的储氢性能。 MgH2-10%(Ti0.5V0.5)3AlC2样品的可逆储氢容量为6.9%,起始放氢温度为230℃,较原始MgH2降低了60 ℃。 完全放氢后的 MgH2-10%(Ti0.5V0.5)3AlC2样品在室温下即可开始吸氢,在150℃、5 MPa氢压条件下,60 s内吸氢量可达4.7%,吸氢速率较原始MgH2显著提升。采用Kissinger法计算得到MgH2-10%(Ti0.5V0.5)3AlC2样品的表观活化能为 79.6 kJ·mol-1,较原始MgH2降低了48%。由EDS和XRD分析可知,球磨后(Ti0.5V0.5)3AlC2均匀分布在 MgH2基体上,其在MgH2放氢过程中保持基本稳定,只起到催化剂的作用。相比单一过渡金属 MAX相 (Ti3AlC2或V2AlC),固溶体 MAX 相(Ti0.5V0.5)3AlC2中 Ti和 V 元素的同时存在可能具有协同催化效应,使其表现出更好的催化效果。

