普通白菜1,5-二磷酸核酮糖羧化/加氧酶小亚基基因BcrbcS的克隆及表达分析
刘东让 侯喜林 肖 栋,3*
(1南京农业大学,作物遗传与种质创新国家重点实验室,江苏南京 210095;2中国农业科学院蔬菜花卉研究所,农业农村部园艺作物生物学与种质创制重点实验室,北京 100081;3江苏现代园艺工程技术中心,江苏南京 210095)
1,5 -二磷酸核酮糖羧化/加氧酶(RuBisCO)作为一种光合作用的关键酶存在于所有高等植物中,在植物光合作用固定CO2过程中起着重要作用(Andersson & Backlund,2008;Cai et al.,2014);同时也参与植物的光呼吸代谢途径,消耗植物光合作用合成的有机物,由此造成的净光合效率损失高达 50%(Ashida et al.,2005;梅杨 等,2007)。髙等植物的RuBisCO全酶是由8个大亚基(rbcL)和8个小亚基(rbcS)构成的L8S8异源十六聚体结构(Spreitzer,2003)。大亚基由叶绿体基因编码,主要起催化作用,多用于植物的系统发育研究,来确定生物种属间差异;小亚基由细胞核基因编码,具有调控RuBPCase活性的功能,全酶的组装调节最终依赖于rbcS的表达调控(Spreitzer,2003;杨立恩 等,2009;崔喜艳 等,2014;魏军亚 等,2015)。因此,rbcS基因在提高植物固定CO2能力和光合效率方面具有重要作用。目前已在多种植物中克隆了rbcS基因,并在结构、功能等方面进行了研究(Ichikawa et al.,2008;Wang,2013;崔喜艳 等,2014)。以上研究结果为利用转基因等生物技术手段提高作物光能利用率提供了可能。贺超英等(2001)在大豆上发现水杨酸、氯化钠、低温和干旱都会对rbcS基因的转录有不同的诱导。
普通白菜〔Brassica campestrisL. ssp.chinensis(L.)Makino var.communisTsen et Lee〕是我国重要的绿叶类蔬菜,由于世界范围内的广泛引种,普通白菜逐渐成为世界性蔬菜(黄菲艺 等,2015),提高光合作用效率对提高其产量和品质具有重要意义。通过转基因技术配合传统育种方法是解决问题的有效途径。本试验以通过cDNA-AFLP方法从普通白菜中获得的受霜霉病菌诱导的差异表达片段为基础(Xiao et al.,2016),利用RACE技术从普通白菜抗霜霉病品种苏州青叶片中克隆了BcrbcS基因,并进行了氨基酸序列分析。同时采用qRTPCR技术分析BcrbcS基因在普通白菜不同组织中的表达模式,并通过原核表达对该基因的蛋白特征进行鉴定。旨在为研究1,5-二磷酸核酮糖羧化/加氧酶小亚基在普通白菜光合吸收中的作用,进一步利用现代生物技术进行转基因研究,从而获得高产、优质的普通白菜新品种提供理论依据。
1 材料与方法
1.1 试验材料
试验于2017年8月在南京农业大学卫岗校区进行,供试材料为南京农业大学园艺学院白菜课题组提供的普通白菜品种苏州青。播种前,所有种子先用1.0 g·L-1HgCl2消毒20 min,蒸馏水冲洗10次;然后播于50孔穴盘(填装灭菌基质),置于人工气候箱中培养,22 ℃光照培养16 h、16 ℃暗培养8 h、相对湿度85%±5%。培养28 d(5~6片真叶)后,选出45株长势良好的植株用于诱导处理。
1.2 试验方法
1.2.1 外源胁迫处理及取样 培养28 d后,分别用0.4% NaCl、2.0 mmol·L-1水杨酸(SA)及纯水进行叶片喷洒处理,平均每株均匀喷洒10 mL,处理后在人工气候箱中20 ℃黑暗保湿24 h,然后揭掉遮光物,22 ℃光照培养16 h、16 ℃暗培养8 h、相对湿度85%±5%条件下培养,直至采样结束。组织特异性表达分析使用的材料取自普通白菜苗期(培养后28 d)的根、茎、叶。胁迫处理表达分析分别在处理后12、24、48、72、96 h对植株叶片进行取样。每个样品3次重复,取样后立即将叶片在液氮中冷冻,保存在-70 ℃冰箱中。
1.2.2 RNA提取和cDNA合成 使用RNA Simple Total RNA Kit试剂盒(TaKaRa)提取样品总RNA,具体方法参照说明书。用核酸仪对提取的总RNA浓度和纯度进行检测。cDNA使用PrimeScript™Ⅱ1 st Strand cDNA Synthesis Kit试剂盒(TaKaRa)反转录合成,作为基因克隆所需的模板。
1.2.3 普通白菜BcrbcS基因全长cDNA克隆 以普通白菜苏州青叶片为试材,使用3′/5′RACE System试剂盒(Invitrogen)克隆基因全长cDNA序列。具体操作参考陈晓峰(2008)的方法。克隆BcrbcS基因的引物见表1,采用在线软件Primer 3(http://bioinfo.ut.ee/primer3-0.4.0/)进行引物设计,引物由南京擎科生物科技有限公司合成。

表1 试验所用引物信息
1.2.4 序列分析 利用Bioxm 2.7软件分析BcrbcS基因序列的开放阅读框(open reading frame,ORF)。不同物种BcrbcS基因的氨基酸序列从NCBI(https://www.ncbi.nlm.nih.gov/)数据库中搜索获得;同源性计算利用NCBI网站BLAST程序;氨基酸编码的蛋白质分子质量、理论等电点、不稳定指数等通过在线软件Protparam(https://web.expasy.org/Protparam/)完成;疏水性预测采用ProtScale(https://web.expasy.org/protscale/), 信 号 肽 预 测采 用 SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/),跨膜区域预测采用 TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/),蛋白质结构域分析采用 InterPro(http://www.ebi.ac.uk/interpro/),蛋白质二级结构预测采用Prabi(https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_phd/),蛋白质三级结构预测采用swiss-model(https://swissmodel.expasy.org/),亚细胞定位预测采用 Psort(https://wolfpsort.hgc.jp/),磷酸化位点预测 采 用 NetPhos 2.0(http://www.cbs.dtu.dk/services/NetPhos-2.0/)等在线工具;多重序列比对及进化树构建通过 DNAMAN 5.2 进行(Tamura et al.,2011)。
1.2.5 实时定量分析BcrbcS转录表达水平cDNA的合成参照PrimeScript™ RT试剂盒(TaKaRa)说明书完成。PCR程序采用两步法:95 ℃ 30 s;94℃ 5 s,60 ℃ 15 s,72 ℃ 10 s,40个循环;设置60~95 ℃的熔解曲线。3次重复,用纯水作为对照。试验数据采用ΔCT方法(Xiao et al.,2012)和Excel 2010软件进行分析。
1.2.6 原核表达 将克隆的BcrbcS基因连接至pMD19-T载体,再转化DH5α感受态细胞,获得重组质粒pMD19-T-BcrbcS。用SacⅠ和BamHⅠ双酶切及菌液PCR鉴定后,含阳性重组质粒的菌液送交南京擎科生物科技有限公司测序。把上述测序正确的重组质粒作为模板,以上游引物BcrbcS_Up和下游引物BcrbcS_Down扩增BcrbcS基因编码区。扩增产物经琼脂糖凝胶电泳,割胶回收后用限制性内切酶SacⅠ和BamHⅠ双酶切,构建重组表达质粒pET29a-BcrbcS,转化大肠杆菌BL21(DE3)。挑取阳性菌落接种至5 mL LB液体培养基中(含200 μg·mL-1氨苄青霉素),37 ℃振荡培养过夜,以此作为种子液。取种子液,用终浓度为0.6 mmol·L-1和 1.0 mmol·L-1的异丙基 -β-D- 硫代半乳糖苷(IPTG)诱导Escherichia coliBL21(DE3)表达融合蛋白,设置取样时间分别为2、4、6、8 h。取菌液3 mL,12 000 r·min-1离心30 s,弃上清液,用100 μL的1×SDS-PAGE加样缓冲液重悬菌体,将上清液参照Tashakkori等(2016)的方法进行SDS-PAGE分析。
2 结果与分析
2.1 BcrbcS基因cDNA全长克隆及序列分析
以通过cDNA-AFLP方法从普通白菜中获得的差异表达片段(397 bp)为基础,采用RACE技术获得其全长,命名为BcrbcS(登录号为AB439290)。该基因cDNA序列全长733 bp,含有543 bp的完整开放阅读框,编码181个氨基酸(图1)。预测其编码蛋白质化学式为C921H1408N234O264S10, 分 子 质 量 为 20.3×103Da,理论等电点为8.23,属于碱性蛋白,不稳定指数为31.74,属于稳定蛋白,脂肪指数为73.76;ProtScale亲/疏水性预测显示:该蛋白属于亲水性蛋白(图2),总平均亲水指数(GRAVY)为-0.164;该蛋白无信号肽,并且不存在跨膜区域;InterPro结构域预测显示,该蛋白在第2~42个氨基酸处有1个N端1,5-二磷酸核酮糖羧化酶小亚基(N-terminal ribulose-1,5-bisphosphate carboxylase small subunitr)结构域,在第2~42个氨基酸处有1个二磷酸核酮糖羧化酶小链(ribulose bisphosphate carboxylase small chain)结构域(图1);蛋白二级结构预测结果显示:该蛋白二级结构为α螺旋、延伸链和无规则卷曲,分别占15.47%、23.20%和61.33%;以拟南芥叶绿体二磷酸核酮糖羧化酶小链的三维结构为模型,利用SWISS-MODEL进行同源建模,预测其三维空间结构,由图3可以看出:BcrbcS蛋白在普通白菜与拟南芥中具有相似的三维空间结构(相似度92.82%);蛋白质亚细胞定位预测表明:BcrbcS蛋白定位于叶绿体中;磷酸化位点预测表明:BcrbcS蛋白有15个Ser磷酸化位点、12个Thr磷酸化位点、9个Tyr磷酸化位点。该基因在起始密码子ATG之前有A,符合Koza规律;在3′端有poly(A)尾,这些都符合有效翻译的基因全长cDNA的特征。
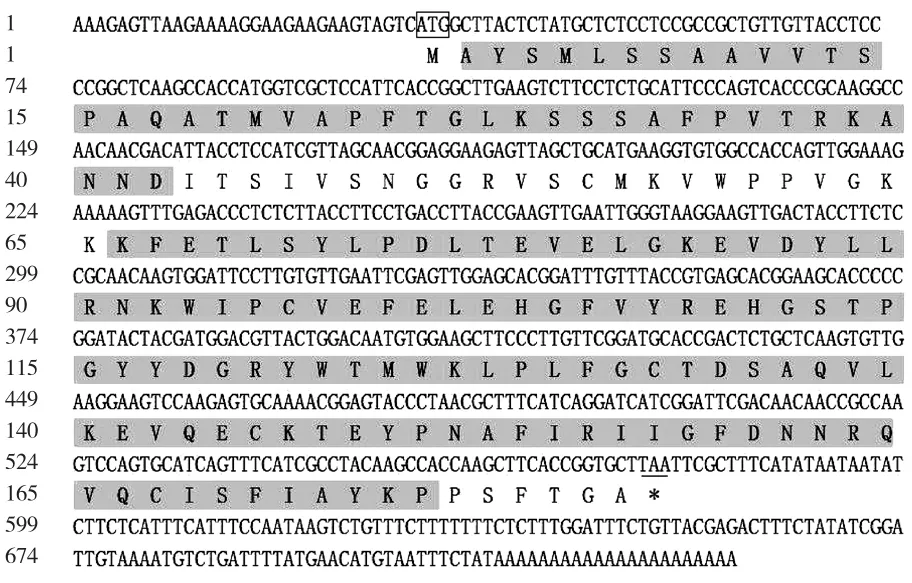
图1 BcrbcS核苷酸序列(上)及其翻译的氨基酸序列(下)
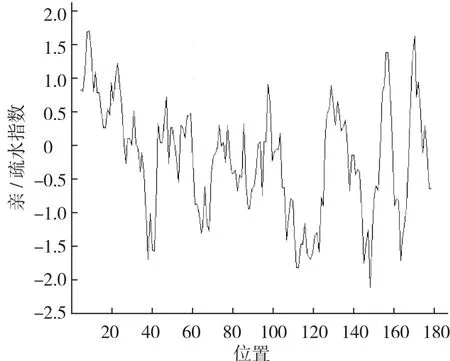
图2 BcrbcS蛋白亲/疏水性预测
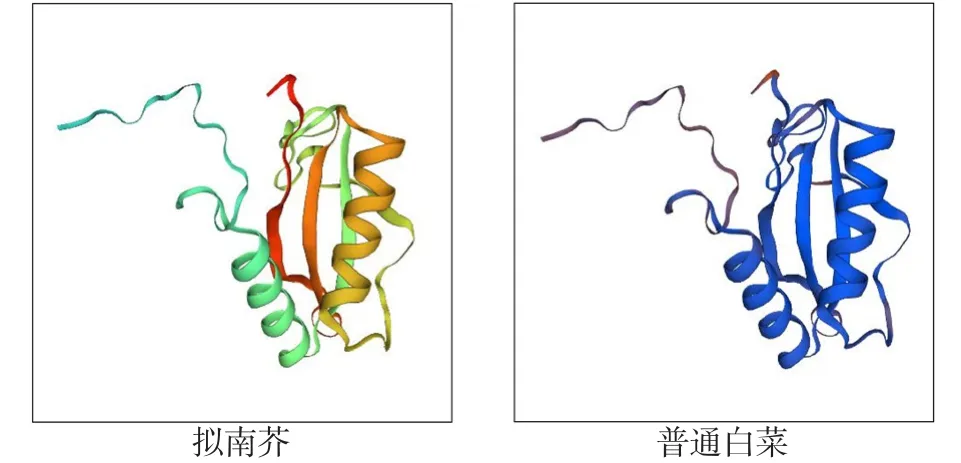
图3 普通白菜与拟南芥rbcS蛋白的三维结构模型比较
2.2 BcrbcS蛋白氨基酸序列同源性和系统进化分析
将BcrbcS编码的氨基酸序列及从NCBI中BLAST获取的其他植物rbcS氨基酸序列(编码区)进行系统树分析。结果显示(图4),普通白菜BcrbcS氨基酸序列与大白菜、甘蓝型油菜、萝卜、亚麻芥、拟南芥的同源性均在90%以上,表明十字花科植物的rbcS蛋白与同属植物的进化关系最近,呈现种属特性;锦葵科达尔文棉及草棉聚为一组,茄科辣椒、番茄聚为一组,表明同科植物的氨基酸序列相似度较高。
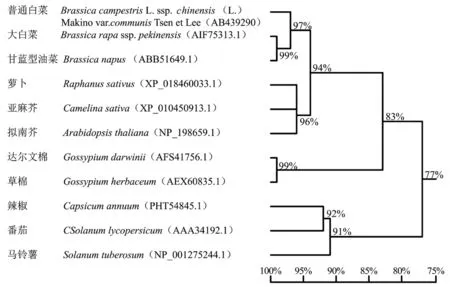
图4 不同植物BcrbcS蛋白的系统进化树
2.3 BcrbcS基因的组织特异性表达分析
由图5可以看出,BcrbcS基因在普通白菜叶中表达最强,且极显著高于茎;同时发现BcrbcS基因在根中不表达。
2.4 外源胁迫下BcrbcS基因的表达分析
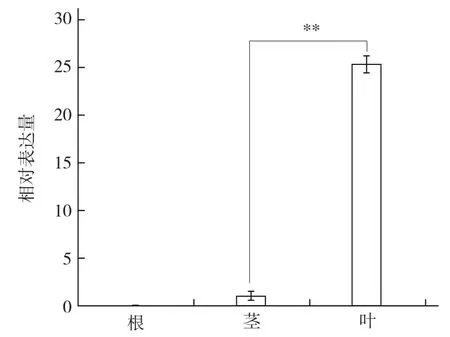
图5 普通白菜BcrbcS基因的组织特异性表达分析
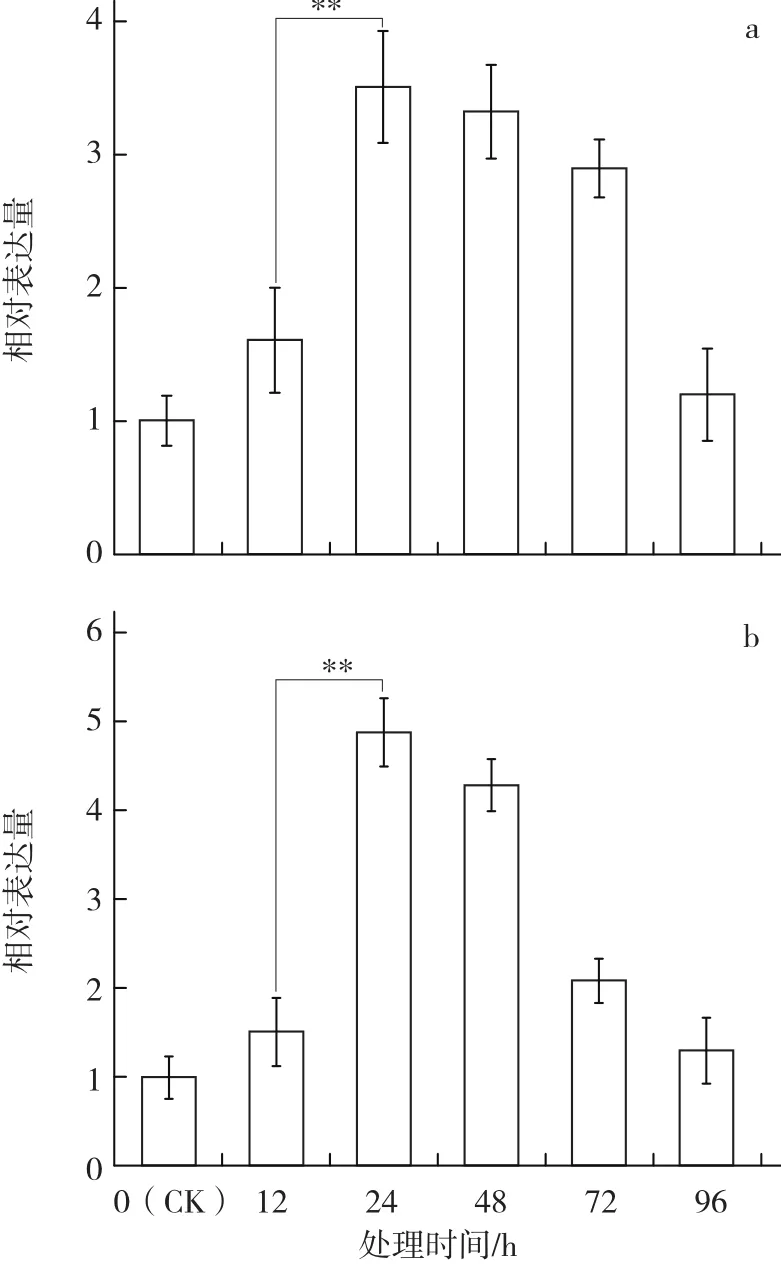
图6 水杨酸(SA)和盐(NaCl)诱导对苏州青中BcrbcS基因不同时间表达量的影响
由图6可见:SA和NaCl均能诱导BcrbcS基因在普通白菜叶中的表达,且均在处理24 h后达到峰值,之后逐渐下降。SA处理的BcrbcS基因表达量的峰值为对照的3.5倍,NaCl处理为对照的4.9倍。
2.5 BcrbcS基因的原核表达分析
对BcrbcS基因进行原核表达分析,发现在37℃条件下,0.6 mmol·L-1IPTG 诱导 0(CK)、2、4、6、8 h后均没有融合蛋白表达。而1.0 mmol·L-1IPTG诱导0(CK)、2、4、6、8 h后,在底部出现明显的表达特异条带(图7)。BcrbcS在E.coliBL21(DE3)中获得了表达,表达蛋白质的分子质量约为 20×103Da。
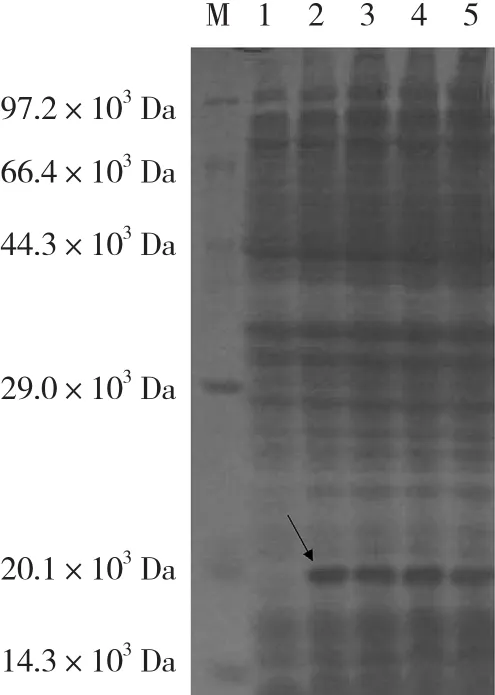
图7 BcrbcS基因原核表达SDS-PAGE电泳结果
3 结论与讨论
已有研究表明,在高等植物中rbcS基因由多基因家族编码,结构较为复杂,但又十分保守,且同一物种的每个rbcS基因成员是共同进化的(Meagher et al.,1989)。本试验通过 cDNA-AFLP技术得到1个由霜霉病诱导差异表达片段,在此基础上利用RACE技术克隆了BcrbcS基因的全长序列。通过氨基酸序列同源性和系统进化分析发现,普通白菜BcrbcS基因编码的氨基酸序列与其他十字花科植物的同源性均在90%以上,且锦葵科达尔文棉及草棉聚为一组,茄科辣椒、番茄聚为一组,表明rbcS蛋白与同属植物的进化关系最近,呈现种属特性。这在一定程度上说明了rbcS在基因结构和功能上的保守性,与前人在其他作物上的研究结果相同(Meagher et al.,1989;崔喜艳 等,2014;魏军亚 等,2015)。
目前已在豌豆、番茄和大豆等植物中发现rbcS表达呈现器官特异性,且主要在叶片中表达(Nagy et al.,1985;Sugita & Gruissem,1987;贺超英 等,2001)。本试验在普通白菜上也发现BcrbcS基因只在地上绿色器官中表达而在根中不表达,且在叶中的表达量极显著高于茎,说明rbcS基因的这种组织特异性表达模式与其作用于植物光呼吸的功能一致。rbcS基因的表达除具有光诱导性和组织特异性外,还对许多其他外界因子具有明显的应答效应。例如:水杨酸、氯化钠、低温和干旱等外界因子都会对rbcS基因的转录有不同的诱导(贺超英 等,2001;崔喜艳 等,2014)。本试验发现0.4% NaCl和2.0 mmol·L-1SA处理的BcrbcS基因表达量均明显上升,且在处理24 h后达到峰值,这与贺超英等(2001)的研究结果一致。同时,BcrbcS原核表达分析发现,37 ℃、1.0 mmol·L-1IPTG 诱导 2、4、6、8 h后,均检测到1条蛋白分子质量约为20×103Da的表达特异条带,其与预期融合蛋白的分子质量的理论值20.3×103Da相符。
综上所述,普通白菜BcrbcS基因在结构和功能上相对保守,主要在叶中表达,且受SA和NaCl的诱导。同时BcrbcS在大肠杆菌中成功实现融合表达,这为下一步利用现代生物技术进行转基因研究提供了基础,从而为获得高产、优质的普通白菜新品种提供重要的理论依据。

