花生油酸脱氢酶基因AhFAD2A和AhFAD2B的时空表达特征
刘 华,薛金嫚,徐倩玉,易 昕,王维艳,刘宏波
(1.浙江农林大学 林业与生物技术学院,浙江 杭州 311300; 2.浙江农林大学 农业与食品科学学院,浙江 杭州 311300)
花生Arachis hypogaea是世界上最主要的油料作物之一,种子含油量为46%~60%,较其他油料作物含油量高[1]。 在花生油的脂肪酸组成中, 油酸(oleic acid, C18∶1)和亚油酸(linoleic acid, C18∶2)约占总脂肪酸的80%;且油酸的自氧化稳定性是亚油酸的10倍,所以高油酸的花生具有较长的储存期。 因此,油酸和亚油酸的比值(O/L)是评定花生油品质的重要指标之一[2-3]。油酸可调整人体血浆中高、低密度脂蛋白胆固醇的比例,对软化血管,保护人体健康有一定效用[4];另外,在粮油业中,以高O/L花生为原料可避免在加工过程中过度氢化,产生反式脂肪酸危害人体健康[5]。所以,研究调控O/L的分子机制,适当提高O/L具有重要意义。近年来,利用基因工程手段提高花生中油酸的研究日益增多,对控制O/L的重要基因的研究也逐渐深入[6]。花生中催化油酸转变为亚油酸的酶是一种存在于内质网膜上的ω-6去饱和酶FAD2[7],且酶的活性与其基因表达水平呈正相关[8];转录水平的表达分析显示,FAD2在高油酸花生品种中的表达量明显低于普通油酸花生中的表达量[9],且FAD2在O/L范围为1.07~6.80的花生中,均在花中表达量最高,荚果次之,根、茎、叶中表达量较低[10-11]。FAD2活性受2个序列相似性为 99%的基因 AhFAD2A(Ol1Ol1)与 AhFAD2B(Ol2Ol2)调控[12]。 在 AhFAD2A 编码区的核苷酸序列中, 若在距起始密码子448 bp处发生单碱基替换(G∶C/A∶T),则会造成氨基酸序列出现错义突变,使天冬氨酸改变为天冬酰胺;而在AhFAD2B中,在442 bp处插入A(A∶T)则会发生移码突变,使终止密码子提前[13]。这2类突变可降低或消除油酸脱氢酶FAD2的活性[14]。在酵母异源表达体系中研究发现,AhFAD2B脱氢酶活性要比AhFAD2A高,前者催化生成亚油酸的量约是后者催化生成亚油酸量的10倍[15],但Ah-FAD2A与AhFAD2B在不同O/L值花生中单独的表达情况,以及AhFAD2B是否为调控花生O/L的主要基因,目前还不明确。为了进一步了解花生调控O/L的分子机制及遗传基础,一些研究者针对FAD2突变体花生品种的选育开发了位点特异性基因标记AS-PCR(allele-specific polymerase chain reaction)[16]和酶切扩增多态序列标记CAPS[17]等标记方法,但这些方法仅可筛选特定类型的突变体,并不能简单便捷地区分未发生突变的原始的AhFAD2A和AhFAD2B,且仅用一种方法不能有效区分四倍体花生突变基因型Ol1ol1/Ol2Ol2和 ol1ol1/Ol2Ol2或者Ol1Ol1/Ol2ol2和 Ol1Ol1/ol2ol2。目前,新采用的利用TaqMan探针荧光定量聚合酶链式反应(qRT-PCR)标记鉴定基因型的方法[18]因价格高昂也无法普及。本研究根据Ah-FAD2A和AhFAD2B在3′-UTR核苷酸序列的差异设计了新型简便的特异性区分两者的引物,以高产、耐肥和抗倒伏花生新品种 ‘山花15’(O/L为1)和高油酸花生突变体(O/L大于20)为试验材料,利用qRT-PCR技术,对2个花生品种不同组织中AhFAD2A和AhFAD2B各自的表达进行相对定量分析,以探究AhFAD2A和AhFAD2B基因各自的时空表达特点,为花生油酸脱氢酶基因AhFAD2A和AhFAD2B对O/L调控机制的深入研究以及日后高油酸含量花生品种的研制提供理论指导。
1 材料与方法
1.1 试验材料
以目前国内主推的农艺性状优良花生品种 ‘山花15’‘Shanhua 15’(O/L为1,OL1OL1OL2OL2)以及高油酸花生突变体(O/L大于20,ol1ol1ol2ol2)为试验材料,其中高油酸花生突变体的AhFAD2A编码区核苷酸序列448 bp处发生单碱基替换(G∶C/A∶T,D/N), 且 AhFAD2B编码区 442 bp处插入 A(A∶T)发生移码突变,使终止密码子提前。RNA提取试剂盒 (杭州新景,货号5111050)分离各组织部位 (根、茎、叶、花、开花后20 d种子、开花后40 d种子、开花后60 d种子)的总核糖核酸(RNA),第1链cDNA合成采用PrimeScript RT reagent Kit with cDNA Eraser试剂盒(TaKaRa,Cat.RR047A),定量PCR荧光染料为SYBR Premix Ex Taq Ⅱ(TaKaRa,Cat.RR470A)。
1.2 四倍体花生AhFAD2A和AhFAD2B基因的序列分析
以GenBank中异源四倍体花生FAD2基因(NCBI登录号:DQ666829)与Peanut Base中二倍体花生(A.duranensis,A.ipaensis)基因组进行 BLAST检索, 基于 5′-UTR和 3′-UTR设计通用引物 FAD2-F,FAD2-R,分别以 ‘山花15’ 和高油酸花生突变体基因组模板进行PCR扩增,反应体系为:10.0 μL 5×PrimerSTAR 缓冲液, 4.0 μL dNTP 混合物, 1.0 μL FAD2-F(10 μmol·L-1), 1.0 μL FAD2-R(10 μmol·L-1),0.5 μL PrimerSTAR HS DNA 聚合酶(0.5×16.67 mkat·L-1), 20 ng 模板,用双蒸水(ddH2O)补齐至 50 μL;反应条件为:1.98℃ 5 min,2.98℃ 15 s,3.58℃ 15 s,4.72℃ 2.5 min,第2~4步骤循环35次,5.72℃10 min。利用Vector-NTI软件分析比对TA克隆序列。
1.3 四倍体花生AhFAD2A和AhFAD2B基因特异性引物的设计
依据3′-UTR核苷酸序列不同,设计区分AhFAD2A与AhFAD2B的特异性引物FAD2A-F,FAD2AR,FAD2B-F,FAD2B-R,并同内参基因(β-Actin)[19]一起用于荧光定量PCR分析。以上引物均利用Vector-NTI设计并由上海英潍捷基贸易有限公司合成。引物序列信息见表1。
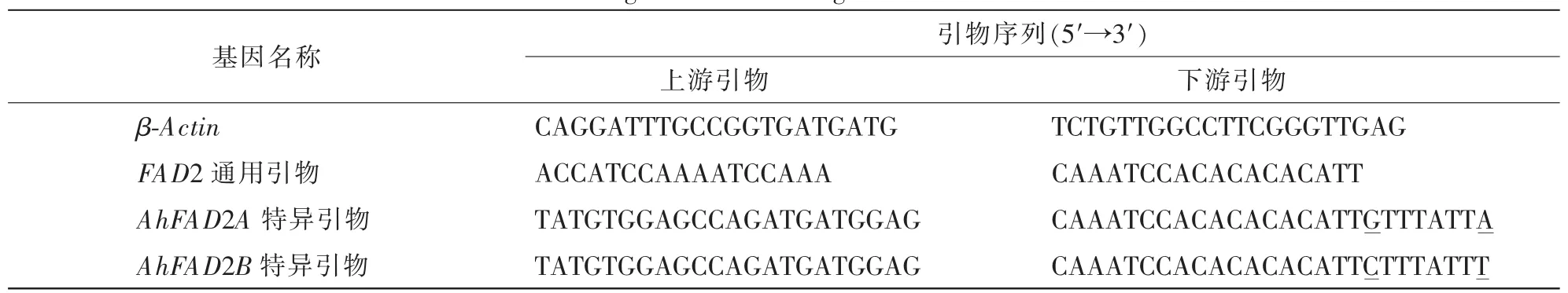
表1 引物序列Table 1 Primers designed for reference genes AhFAD2A and AhFAD2B
1.4 四倍体花生AhFAD2A和AhFAD2B基因组织特异性荧光定量PCR
荧光定量PCR反应体系:配置25.0 μL反应混合液,包括12.5 μL SYBR Premix Ex TaqⅡ(TliRNaseH Plus)(2×), 1.0 μL 上游引物(10 μmol·L-1), 1.0 μL 下游引物(10 μmol·L-1), 2.0 μL RT 反应液(cDNA溶液),8.5 μL灭菌水;使用Bio-Rad CFX Connect定量分析仪进行定量分析,每个反应重复3次。反应条件为:1.95℃ 2 min,2.95℃5 s,3.60℃30 s,第2~3步骤循环39次,4.95℃ 5 s,5.65℃ 5 s,6.95℃ 5 s。AhFAD2A与AhFAD2B基因表达量以内参基因(β-Actin)作为标准,以AhFAD2A在‘山花15’茎中的表达量为1,运用2-△Ct△Ct法进行相对定量分析。
1.5 花生不同组织油酸和亚油酸相对含量的测定
花生种子脂肪酸含量的分析方法参考QUEHENBERGER等[20]和VONGSVIVUT等[21]并稍作修改。花生根、 茎和叶脂质提取方法: ①液氮研磨样本, 并加入提取液[V(氯仿)∶V(甲醇)∶V(甲酸)=10∶10∶1]过夜萃取; ②离心并吸取上层提取液; ③用[V(氯仿)∶V(甲醇)∶V(水)=5∶5∶1]洗涤沉淀, 再次萃取, 并与之前提取液合并;④加入混合液(0.2 mol·L-1磷酸,1.0 mol·L-1氯化钾),混匀离心,并吸取下层氯仿相;⑤用氮吹仪浓缩氯仿相即得到脂质提取物。
运用Agilent 7890B GC气相色谱仪进行样品脂肪酸的分离,色谱条件参考文献[22]。程序升温:160℃保持1.5 min,然后以20℃·min-1升至240℃,保持5 min,总运行时间为10.5 min;进样口温度为260℃;空气流量为300.0 mL·min-1,氢气燃气流量30.0 mL·min-1,尾吹气(氮气)流量25.0 mL·min-1,载气(氦气)流量1.533 4 m·min-1,分流比30,进样量为1.0 μL。
2 结果与分析
2.1 AhFAD2A和AhFAD2B区分及特异性引物专一性检测
将在GenBank中已登录的异源四倍体花生FAD2编码区基因片段(NCBI登录号:DQ666829)与Peanut Base中2种二倍体花生(A.duranensis,A.ipaensis)基因组进行BLAST检索,共发现3个Ah-FAD2基因,并可分为2种情况:一类是含1 140 bp的开放阅读框(ORF),编码379个氨基酸组成的完整蛋白(AhFAD2A和AhFAD2B),序列同源性为99%;另一类为1 147 bp的ORF,由于核苷酸序列中第451位碱基由G突变为T(G451T),形成TAA终止子且在674~680 bp有7 bp的插入导致移码,使翻译提前终止,不能编码完整的蛋白而成为假基因(表2)。

表2 二倍体花生中AhFAD2基因序列差异性分析Table 2 Differences of AhFAD2 sequences in diploid peanuts
由于以上同源基因序列是在原始的二倍体花生中获得,而本研究材料 ‘山花15’ 和高油酸花生突变体为人工选育的四倍体花生品种,所以需先用通用引物扩增 ‘山花15’ 和高油酸花生突变体基因组得到包含5′-UTR和3′-UTR的四倍体花生FAD2基因序列,然后再设计特异性引物区分同源基因Ah-FAD2A和AhFAD2B。所以在以上3个比对位点5′-UTR和3′-UTR设计通用引物FAD2-F,FAD2-R,以‘山花15’和高油酸花生突变体基因组为模板,用此引物扩增包含5′-UTR和3′-UTR的AhFAD2基因片段1 700 bp左右,将扩增得到的目的片段进行TA克隆,利用Vector-NTI软件分析比对TA克隆的序列进行分析,也分为3类:AhFAD2A,AhFAD2B和假基因,与二倍体花生相同。依据AhFAD2A和Ah-FAD2B基因3′-UTR序列不同,设计了特异性荧光定量PCR引物FAD2A-F,FAD2A-R,FAD2B-F,FAD2B-R,并检测了所设计引物的专一性。结果表明:AhFAD2A与AhFAD2B特异引物在扩增其对应模板时,扩增循环阈值(Ct)最小,且在最佳范围内(15≤Ct≤20),表明引物专一性良好,适用于AhFAD2A和AhFAD2B序列的鉴别(图1)。
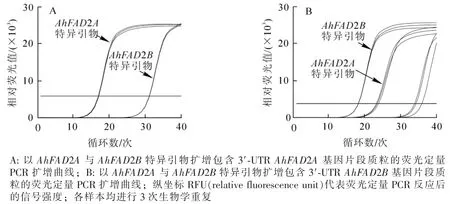
图1 AhFAD2A与AhFAD2B特异引物专一性检测结果Figure 1 Primers specificity of AhFAD2A and AhFAD2B tested by qRT-PCR
2.2 AhFAD2A和AhFAD2B基因的表达模式
花生各组织总RNA的提取如图2所示,28S和18S条带清晰,其D(260)/D(280)均约1.85,表明所提取的RNA的完整性和纯度均很好,可反转录合成第1链cDNA进行荧光定量PCR反应。根据 ‘山花15’和高油酸花生突变体的7个不同组织中荧光定量PCR中的Ct值,计算AhFAD2A和AhFAD2B与内参基因的表达量,以AhFAD2A在 ‘山花15’茎中的表达量为1,运用2-△Ct△Ct法进行相对定量分析(表3)。结果表明:AhFAD2A和AhFAD2B在 ‘山花15’和高油酸花生突变体中均有表达,两者在花和开花后40 d的种子中表达量显著高于在其他组织中的表达量;其中,在高油酸花生突变体3个不同发育时期种子中AhFAD2A和AhFAD2B表达量均显著低于在 ‘山花15’种子中2个基因的表达量,表明AhFAD2A和AhFAD2B协同调控花生O/L;同时,‘山花15’种子中AhFAD2B的表达量显著高于Ah-FAD2A,而在高油酸花生突变体种子中则相反,表明AhFAD2B在催化油酸去饱和生成亚油酸的过程中比AhFAD2A可能起更重要的调控作用。
‘山花15’和高油酸花生突变体AhFAD2A和AhFAD2B在花后20,40,60 d的种子中表达量呈“低—高—低”模式,推测在开花至花后40 d这一阶段的种子中FAD2的表达量可能对花生最终O/L起主要的调控作用。
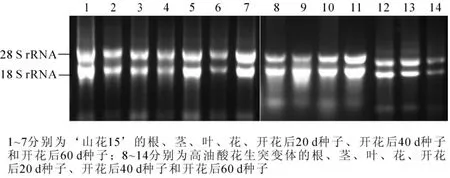
图2 ‘山花15’和高油酸花生突变体不同组织样本的总RNA电泳条带分析Figure 2 Total RNA of different tissues in ‘Shanhua 15’ and high-oleate peanut mutants
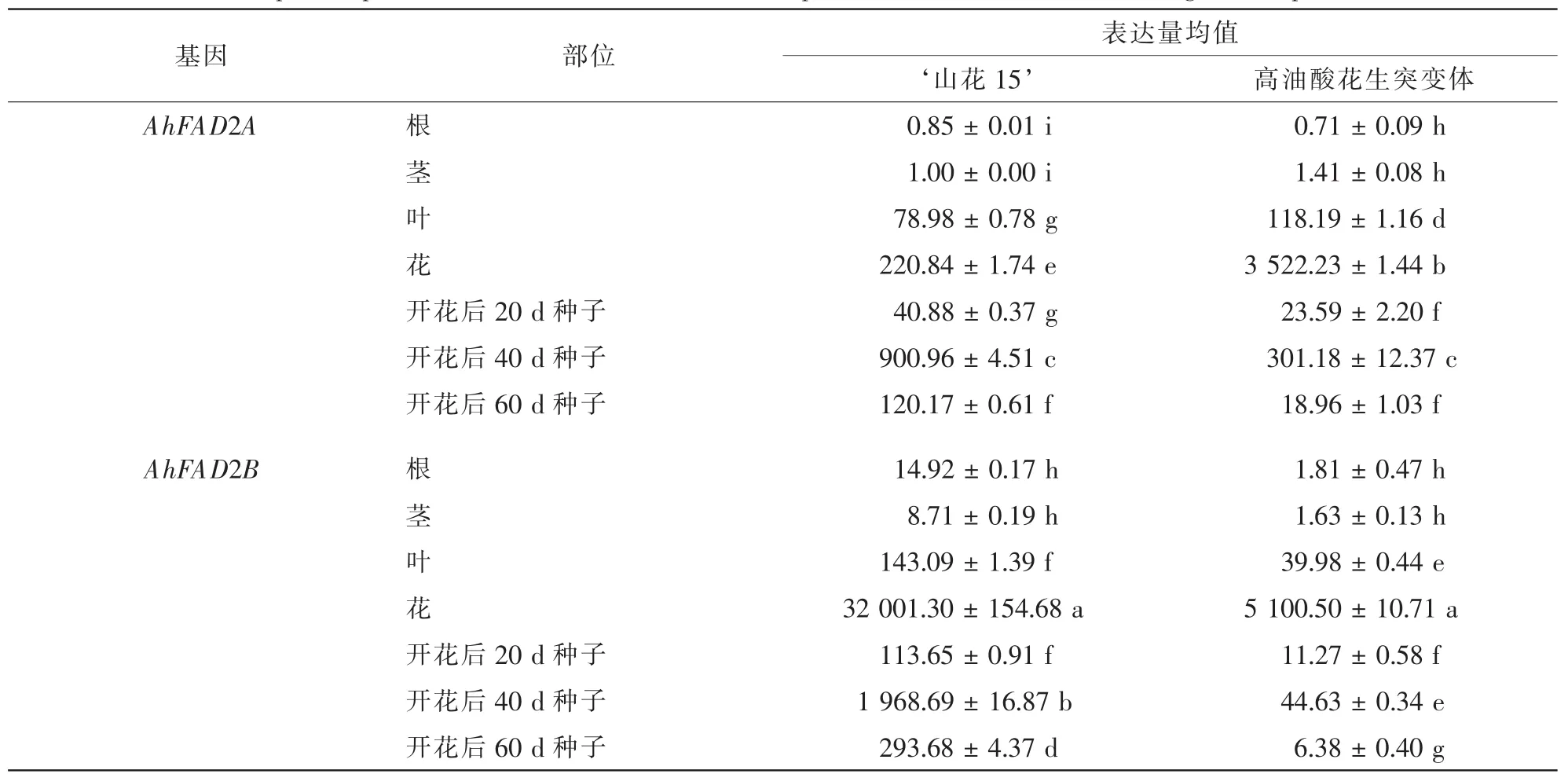
表3 AhFAD2A与AhFAD2B在 ‘山花15’和高油酸突变体不同组织中表达量差异分析Table 3 Multiple comparison of AhFAD2A and AhFAD2B expression in ‘Shanhua15’ and high-oleate peanut mutants
2.3 ‘山花15’和高油酸花生突变体各组织的油酸和亚油酸相对含量
测定 ‘山花15’和高油酸花生突变体根、茎、叶及成熟种子中油酸和亚油酸相对含量,可知根、茎和叶中油酸和亚油酸相对含量在品种间无显著差异,而在成熟种子中2个花生品种的油酸和亚油酸相对含量均差异显著(图3),表明FAD2对花生种子中的O/L有重要影响。
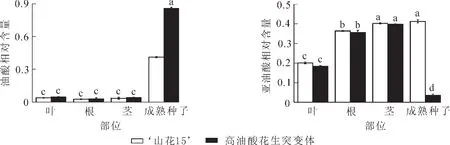
图3 ‘山花15’和高油酸花生突变体根、茎、叶和成熟种子中油酸与亚油酸相对含量Figure 3 Oleic acid and linoleic acid content in roots,stems,leaves and pods of ‘Shanhua 15’ and high-oleate peanut mutants
3 讨论与结论
依据AhFAD2A和AhFAD2B基因3′-UTR序列不同而设计的特异性荧光定量PCR引物(FAD2A-F,FAD2A-R,FAD2B-F及FAD2B-R),经检测专一性良好,可成为一种新型简便的鉴定方法。同时,由于特异性引物区分位点在3′-UTR,因此,该引物在筛选特定类型的AhFAD2突变体方面也有着宽广的应用前景。例如,可与特定的AhFAD2开放阅读框突变位点组合,设计与突变位点有关的特异上游引物,用于突变体基因型的鉴定。
AhFAD2A和AhFAD2B在 ‘山花15’和高油酸花生突变体7个组织中均有表达,但在根、茎和叶中表达量较低,在花和种子中表达量很高。2个不同O/L花生品种在根、茎和叶中油酸和亚油酸的相对含量并没有差异,而在种子中差异显著。这可能是由于在根、茎和叶中,质体酰基载体蛋白去饱和酶发挥主要作用,而在种子中主要是内质网上的酰基-脂质去饱和酶起主导作用[23],所以FAD2对种子中的脂肪酸含量有重要影响。AhFAD2B在 ‘山花15’各组织中表达量均显著高于AhFAD2A;在高油酸花生突变体3个不同发育时期的种子中,AhFAD2B的表达量显著低于AhFAD2A,但两者的表达量均下降,且AhFAD2B表达量的下降幅度大。以往研究表明,AhFAD2B基因较AhFAD2A相对保守,且其活性对花生O/L影响更大[9],在酵母异源表达体系中,AhFAD2B脱氢酶的活性要高于AhFAD2A[15];本研究结果与这些研究结论相符,推测 ‘山花15’和高油酸花生突变体中AhFAD2B脱氢酶在催化油酸去饱和生成亚油酸的过程中比AhFAD2A可能起更重要的调控作用。花后20,40和60 d种子中FAD2相对表达量有显著差异,在2个花生品种间基因表达量也差异显著,AhFAD2A和AhFAD2B在开花后40 d的种子中表达量最高。陈四龙等[24]指出:花生油脂积累过程分为初始、快速和稳定积累3个阶段,主要在前2个阶段有较集中的积累。迟晓元等[25]研究显示:花生果针下地40 d前油脂累积速率显著大于40 d之后,呈现先快后慢的累积模式。本研究中FAD2表达量的变化趋势与种子发育过程中油脂的积累情况相符,推测在开花后至40 d这一阶段FAD2在种子中的表达量可能对花生最终O/L起主要调控作用,若对这一发育时期进行基因手段干预,如改变这一时期FAD2的启动子,可能使花生籽粒的油酸提高。
本研究所选用的 ‘山花15’为目前国内主推的具有高产、耐肥和抗倒伏等农艺性状优良的花生新品种,高油酸花生突变体也为具有目前世界范围内主流的高油酸性状突变类型的突变体品种,且它们的O/L具有显著差异,所以结果具有一定的代表性与应用价值。花生脂肪酸组成和油脂累积是一个协同作用且复杂的调控网络,目前还未有对具有AhFAD2A和AhFAD2B单独纯合突变基因型的花生品种进行基因表达的研究,所以FAD2基因对花生O/L的影响还需要更深入的探索。

