猪流行性腹泻病毒的鉴定及其S基因的序列分析
王 婧,刁小龙,杨海峰,孙志雯,陈晓兰
(1.江苏农牧科技职业学院,江苏泰州 225300 2. 中崇信诺生物科技泰州有限公司,江苏泰州 225300)
猪流行性腹泻(Porcine epidemic diarrhea)病在临床以急性肠炎为特征,常由于致死性水样腹泻导致仔猪脱水死亡,是一种高致死率疾病[1]。病原为猪流行性腹泻病毒(PEDV),该病毒可感染各年龄段猪,使患病猪出现水样腹泻、呕吐等临床症状,并伴随厌食和精神沉郁等。仔猪的感染率可达100%,母猪则不一定[2]。从患病猪48 h的排泄物中可检测到PEDV,有时甚至可延长至4周。PEDV感染1周龄以内仔猪可引起严重水泄和3~4 d呕吐,随后出现严重的脱水和电解质失衡并可能导致死亡,平均死亡率达50%,1~3 日龄仔猪死亡率甚至可达100%。虽然大一点的猪比1周龄以内仔猪初发病时症状轻微,但PEDV影响育肥猪的生长情况。母猪可能不会腹泻,但是通常会有抑郁和厌食的表现[3]。
PEDV是一个大的有囊膜RNA病毒,属于尼多病毒目冠状病毒属甲型冠状病毒科,基因组大约28 kb,拥有5′端非翻译区和3′端非翻译区,共编码至少7 个开放阅读框(ORF1a,ORF1b,ORF2~ORF6),其中ORF 1a和ORF 1b共占整个基因组5′端的2/3,用于编码非结构蛋白。剩余 3′端的基因共编码4 个结构蛋白,分别是纤突蛋白(S)、膜蛋白(M)、小膜蛋白(E)和核衣壳蛋白(N)。其中S蛋白是病毒子包膜主要的Ⅰ型糖蛋白,与病毒入侵及刺激并诱导宿主产生中和性抗体密切相关。S蛋白可划分为S1(1~735 aa)和S2(736~1 383 aa)两个结构域,S1结构域对识别猪氨基肽酶(pAPN)受体至关重要。PEDV进入细胞与pAPN结合,随后通过直接膜融合的方式与靶细胞完成内化过程,随后脱壳并释放病毒基因组进入细胞内开始复制[4-6]。
另有研究表明,冠状病毒S蛋白的变异会导致其宿主范围、组织细胞培养及毒力发生改变。遗传进化分析表明,S基因存在较高的变异性,不同分离株S基因之间存在不同程度的核苷酸插入、突变和删减等现象,进而改变病毒原始抗原特性,因此常被用来研究不同时间和地区流行毒株之间的亲缘关系[7]。
2017年3月,河南周口某猪场发生哺乳仔猪腹泻,通过剖检疑似为PEDV感染,为进一步进行实验室诊断及对该猪场PEDV的流行情况进行分析,本研究采集发病仔猪新鲜肠道样品进行PEDV检测,并进一步克隆S基因片段,运用DNAMAN、MEGA等基因分析软件进行序列分析,为进一步掌握该地PEDV的流行毒株及毒力变异情况提供理论依据。
1 材料与方法
1.1 样品采集
采集河南周口某猪场的腹泻仔猪新鲜肠道样品3份,置于-80 ℃冰箱冷冻保存。
1.2 试 剂
PrimeScriptTMOne Step RT-PCR Kit Ver.2(Dye Plus) 一步法RT-PCR试剂盒、EXTaq酶、DNA marker DL2000、DNA marker DL5000、pMD18-T载体等均购自TAKARA宝日医生物技术有限公司;Trizol试剂购自Invitrogen公司;普通质粒提取购自天根生化科技有限公司;琼脂糖为西班牙Biowest公司产品;其他试剂均为国产分析纯。
1.3 样品处理及RNA提取
小肠病料组织加入适量液氮进行研磨稀释后,于4 ℃ 10 000 r/min离心10 min。吸取上清液按照Trizol说明提取RNA,最后将RNA溶解于DEPC水中,-20 ℃保存。
1.4 引物设计
根据腹泻仔猪的临床症状怀疑是由PEDV感染引起,按照PEDV基因序列设计并合成引物。其中M1/M2引物用于PEDV检测,参照文献[8]合成,由于S基因片段较长,因此将基因分为Sa、Sb、Sc 3段进行克隆,根据CV777毒株S基因序列,采用Primer 5.0软件进行引物设计,由上海生物工程有限公司进行引物合成。引物信息见表1。

表1 PCR引物信息Table 1 Information of PCR primer
1.5 反转录及基因的PCR扩增
根据试剂盒操作说明,配制RT-PCR反应液,将一步法酶混合物、Buffer、引物、提取的PEDV总RNA及RNase Free dH2O配制成25 μL反应体系,按照以下程序放入PCR仪进行反应,M基因扩增PCR程序参照文献[8]进行,S基因片段的扩增条件为:50 ℃ 30 min,94 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,30 个循环;72 ℃ 7 min。反应结束后吸取5 μL 反应产物在15 g/L的琼脂糖凝胶上进行电泳检测。
1.6 S基因克隆
电泳检测条带和目的条带一致后,取PCR反应混合液3 μL,pMD-18T载体1 μL,Buffer 5 μL,灭菌水1 μL,混合均匀后置于16 ℃连接2 h,并转化至JM109感受态细胞,进行蓝白斑筛选,采用PCR 法进行鉴定,鉴定成功后将阳性菌株送上海生物工程有限公司进行测序。
1.7 序列分析
将测序得到的3 个片段采用Congtig1软件进行拼接,然后采用 DNAMAN 软件对所获得的序列进行翻译。对翻译推导所得的蛋白质序列进行 BLASTp 分析,并与经典毒株 CV777 的序列进行多序列比对,分析其突变位点。最后与近年来国内外流行的 PEDV 毒株进行多序列比对,采用Mega 5.0 软件构建进化树,毒株信息见表2。
2 结果与分析
2.1 临床病料的PEDV检测
采用 Trizol 法提取腹泻仔猪肠道样品的 RNA,参照文献[8]采用扩增M基因的引物对提取的样品RNA进行一步法反转录PCR检测,以对照株 CV777 作为阳性对照,电泳结果显示3个样品均有特异性条带,约为290 bp,与预期结果相符(图1),对扩增片段进行克隆测序与序列分析的结果表明3个样品均为PEDV阳性。
2.2 PEDV S基因的扩增及克隆
由图 2 可知,分别进行一步法RT-PCR扩增Sa、Sb和Sc片段,并进行克隆和测序,片段大小为2 188、1 532 和 1 404 bp。
2.3 PEDV S基因的序列分析
利用Contig1软件将测序得到的片段分别进行拼接,得到3条S基因序列,分别命名为A、B和C,长度均为4 161 bp,共编码1 386个氨基酸,3株PEDVS基因的核苷酸序列和推导氨基酸序列相似性为99%。3条S基因核酸序列BLAST搜索结果均与AHCZ-2株的相似性最高,达98.6%。推导氨基酸序列与经典毒株CV777相比,在第57位插入4个氨基酸NQGV,在第134位插入1个氨基酸D,而在第157、158位缺失 2个氨基酸,与王飞等[9]报道的中国部分地区 PEDVS基因的蛋白序列相似。

表2 PEDV的S基因序列比对参考毒株信息Table 2 Viral reference strain for S Gene sequence alignment of PED
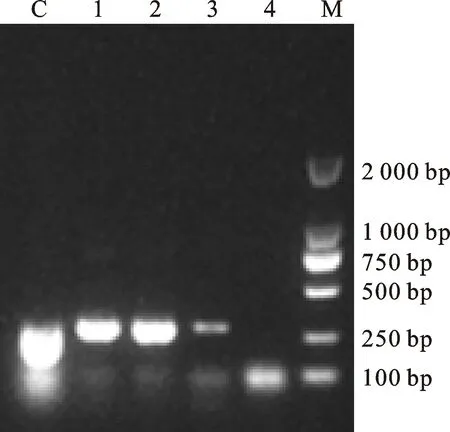
C.CV777株阳性对照 Positive control of CV777 strain; 1~3.检测样品 Sample;4.阴性对照 Negative control; M.DNA marker DL2000
图1M基因检测电泳结果
Fig.1AgarosegelelectrophoresisofPCRamplificationsforPEDVMgene
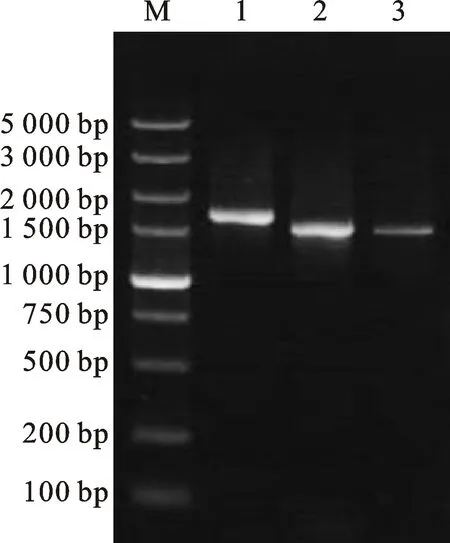
M.DNA marker DL5000;1.Sa;2.Sb;3.Sc
采用Clustal Omega在线软件对所得3个S基因推导蛋白质序列和经典毒株CV777的S蛋白序列进行多序列比对发现,在中和表位区域(499~638 aa)共有11处突变,分别是517位A→S,521位L→R,523位S→G,527位V→I,542位D→G,549位T→S,594位G→S,605位A→E,619位F→S,621位K→T,635位I→V。3个线性表位只有1 373~1 379有 1 个氨基酸突变。而在预测的 2 处受体结合域中,25~88 aa结构域有11处氨基酸突变或插入,249~529 aa结构域有14处氨基酸突变或缺失。
2.4 PEDV S蛋白遗传进化分析
主要选择PEDV经典毒株CV777,中国周边各国的疫苗株、经典流行株,以及近年来在中国境内分离到的部分毒株与本试验克隆得到的3株PEDV毒株S基因推导氨基酸序列进行多序列比对,并利用MEGA 5 软件,采用N-J法进行遗传进化树的构建(图3)。
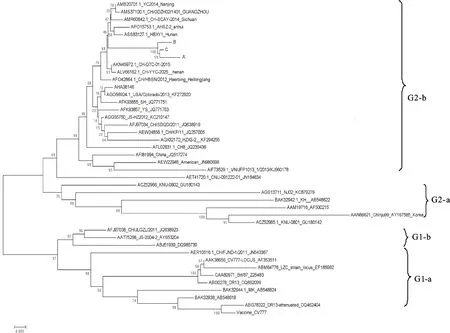
图3 PEDV的S蛋白氨基酸遗传进化分析Fig.3 Genetic evolution analysis of S protein amino acid of PEDV
利用筛选得到的39 株代表毒株的S蛋白氨基酸序列构建遗传进化树,可见进化树分为两个大分支,每个分支又可划分为a和b 2 个小分支,本次试验所得的 3 株S蛋白均位于G2-b分支,位于同一分支的还有中国境内流行毒株YC2014、CH/GDZH02/1、CH-SCAY-2014、HBXY-1和CH-QTC-01-2015,美国的流行株USA/Colorado和CHGD-01等,表明本次鉴定的毒株与这些毒株遗传关系较近。韩国经典毒株Chinju99、NJ02和 KNU-0801,以及日本的KH野猪毒株均位于G2-a分支。美国流行的经典株CV777以及LZC、DR13和Brl/87等毒株均位于G1-a分支,其他中国流行毒株如CH/JLGZL/2011和JS-2004-2等位于G1-b分支,本研究结果与乔涵等[10]报道的河南分离株均位于G2分支相似。
3 讨 论
在亚洲,PEDV于1982年在日本首次被报道,至此PEDV在亚洲各国迅速流行。2000年以后,PEDV在菲律宾、泰国、中国台湾和越南等地的报道日益增加[11-12]。自从PED第一次在中国确诊,该病就一直给中国的养猪业造成严重损失,20世纪90年代早期,经典毒株CV777的灭活苗在中国被广泛应用,PED得到较好的控制[13]。但从2010年开始,PED在中国养猪大省死灰复燃,中国科学家对近几年的PEDV分子流行病进行大量调查。从2011年2月—2014年3月,进行除中国西藏和海南的29省大规模调查,结果显示4 a间全国总样品阳性率为61.1%~78.49%不等,而各猪场阳性率为71.43%~83.47%不等[14]。
2017年3月在河南周口某猪场出现大量哺乳仔猪腹泻,通过剖检疑似PEDV感染,为了确诊,本研究进行实验室PCR检测以及S基因的遗传进化分析。研究结果显示3份样品的S基因与疫苗株CV777的相似性均为98%以上,虽然表现出极高的相似性,但是这3株新毒株相对经典疫苗株在中和表位区域(499~638 aa)[15]共有11处氨基酸突变,另外两个中和表位,SS2表位(748YSNIGVCK755)较为保守,SS6表位中(764LQDGQVKI771)766D突变为S,而国内近年来分离的毒株在此结构域多数表现为2~3个氨基酸突变(L突变为S)[16],在该结构域氨基酸突变易影响S蛋白的疏水性[17]。尤其值得注意的是,被检毒株S蛋白中和表位区域的549位T→S,594位G→S突变现象,549位和594位为S蛋白的中和表位结构域,这些位置的突变可能和免疫动物发病具有重要联系,中国自2011年以后分离的PEDV毒株这两处均突变为丝氨酸,而2002-2009年分离到的PEDV毒株这两处氨基酸的突变情况不同,这期间少数毒株第549位未发现突变,而大部分毒株此处突变为精氨酸[18]。
目前,中国PED爆发主要是由于G1b变异株以及与CV777不同基因型的G2流行野毒株的流行导致[19]。2010年之后,属于G1b基因群的新的变异毒株在中国被陆续报道,如在陕西渭南流行的PEDV均属于G1分支,且与CV777亲缘关系较远[20]。另外,免疫动物的PED爆发使人们对CV777毒株疫苗的保护性产生质疑。对此次检测到的3株PEDV进行遗传进化分析显示均属于G2-b分支,从亲缘关系看与在河南省附近其他省份分离到的PEDV毒株亲缘关系较近。这与周兵强等[21]分析的近年来河南省PEDV的M基因和ORF3基因均属于基因2型结果一致,并且与经典毒株以及疫苗株比较均发生变异,而与2010年后国内流行的大多数毒株的同源性较高。本研究结果为进一步跟踪监测河南省PEDV分子流行特征,制定综合防控措施及新疫苗研发具有重要意义。

