Six1基因在肺癌组织表达水平及RNA干扰抑制其表达后对肺癌细胞生物学特性的影响
刘志广 韩江红 李宁
(1新乡市中心医院胸瘤一科,河南 新乡 453000;2新乡医学院三全学院;3河南中医学院第一附属医院呼吸内科)
肺癌是常见的高发病率和死亡率的恶性肿瘤,虽然通过大量研究,肺癌的诊断、治疗有了一定的进展,但其疗效仍不尽人意〔1〕。肿瘤的形成和恶性转化与癌基因的激活、抑癌基因的失活等密切相关。Six1(Sine oculis homeobox homolog1)定位于人14q23染色体,是新近发现的一个同源盒基因,在多种物种间表现出高度保守性,参与耳、眼、肌肉和神经系统等组织器官的发育,可通过调节下游多种基因的表达影响肿瘤的发生发展〔2〕。目前在结直肠癌、乳腺癌、宫颈癌等多种肿瘤中发现Six1高表达,Six1的高表达可促进肿瘤增殖、上皮间质转化、迁移等〔3~5〕。这些研究提示Six1可能是一种癌基因。然而,Six1对肺癌生物学特性的影响还未明确。本研究检测了肺癌组织中Six1的表达情况,并通过小干扰RNA抑制Six1的表达,观察细胞的增殖凋亡情况,进一步研究诱导细胞增殖凋亡的机制。
1 材料与方法
1.1组织样本 收集新乡市中心医院2014年6月至2016年3月胸外科手术切除的肺癌及相应的癌旁组织(距离肿瘤边缘1~3 cm)标本各62例。肺癌均经过病理学检查证实,且术前均未行放化疗。病理类型均为腺癌。其中男42例,女20例,中位年龄59岁。组织标本手术切除后置于液氮罐中保存备用。所有标本的采集均经过患者及家属的知情同意。
1.2细胞及试剂和仪器 人肺癌A549细胞,中科院上海细胞库;胎牛血清、脂质体LipofectamineTM2000试剂盒、RPMI1640细胞培养基,购自美国Sigma;二喹啉甲酸(BCA)蛋白定量试剂盒、CCK8试剂盒均购自中国碧云天试剂公司;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙锭(PI)细胞凋亡试剂盒、流式细胞仪,购自美国BD公司;Six1、细胞增殖核抗原(PCNA)、B细胞淋巴瘤/白血病(Bcl)-2相关X蛋白(Bax)、Notch1和Hes1抗体,购自美国abcam公司;酶标仪购自美国Bio Tek公司;凝胶成像系统购自美国PE公司。
1.3Six1基因在肺癌组织表达 组织蛋白提取试剂盒提取肺癌及癌旁组织中的总RNA,按照BCA试剂盒操作说明测定总蛋白浓度,30 μg的上样蛋白,加入所需的5倍蛋白上样缓冲液,混合均匀后100℃变性8 min,立即置于4℃冷却,12%的十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳跑胶(浓缩胶恒压80 V,分离胶恒压100 V),电泳结束后转膜至聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭1 h,加入Six1(1∶500稀释)和内参GAPDH(1∶1 000稀释)抗体,4℃摇床缓慢摇动过夜,洗膜,加入1∶5 000稀释的辣根过氧化物酶(HRP)标记的羊抗鼠IgG,洗膜。增强化学发光法(ECL)发光试剂盒检测,实验重复3次。
1.4细胞培养及siRNA转染 A549细胞用含有10%胎牛血清及青链霉素双抗的RPMI1640细胞培养基,置于37℃、5% CO2条件下传代培养。转染参照脂质体LipofectamineTM2000转染说明进行操作。细胞分为空白组、阴性对照(NC)组和 Six1-siRNA组。空白组细胞中加入脂质体,NC组和 Six1-siRNA组分别加入合成的无义siRNA序列和 Six1的靶向siRNA序列。转染前1 d,以3×104/ml细胞密度接种于24孔细胞培养板中,细胞生长融合度约80%时进行转染。收集转染48 h的细胞,Western印迹检测各组细胞Six1蛋白表达。
1.5CCK8法检测Six1-siRNA转染对肺癌细胞增殖的影响 取生长至对数期的各组细胞,制备细胞悬液,每孔100 μl(含5×104个细胞)接种至96孔板中,常规培养,分别于24 h、48 h和72 h在每孔细胞中加入CCK8溶液,视细胞生长状况和颜色变化继续孵育2 h,酶标仪检测波长为570 nm时的光密度(OD),记录结果,实验重复3次。
1.6流式细胞术检测Six1-siRNA转染对肺癌细胞凋亡的影响 以每孔1×105个细胞将各组A549细胞接种至6孔板,每孔添加2 ml,常规培养48 h,胰蛋白酶消化细胞,预冷的磷酸盐缓冲液洗涤细胞,收集细胞沉淀,结合缓冲液重悬细胞,加入5 μl的Annexin V-FITC,混合均匀后室温避光反应10 min,再加入5 μl的PI,室温避光孵育5 min,1 h内上流式细胞仪检测各组细胞的凋亡情况。
1.7PCNA、Bax、Notch1和Hes1蛋白表达检测 收集转染48 h的细胞,加入适量的细胞裂解液提取细胞中的蛋白,按照1.3方法检测各组细胞中PCNA、Bax、Notch1和Hes1的蛋白相对表达量。
1.8统计学方法 采用SPSS21.0软件,计量资料多组差异比较采用单因素方差分析,两两比较采用LSD-t检验。
2 结 果
2.1Six1在肺癌组织的表达 Six1在癌旁组织及肺癌组织中的蛋白表达分别为(0.102±0.010)、(0.511±0.047),肺癌组织中Six1的表达显著高于癌旁组织(P<0.05)。见图1。

图1 Six1在肺癌组织及癌旁组织的表达
2.2转染Six1-siRNA的A549细胞Six1的表达 空白组、NC组和Six1-siRNA组Six1的蛋白表达分别为(0.383±0.036)、(0.381±0.035)、(0.177±0.015),NC组Six1的蛋白表达与空白组比较差异无统计学意义(P>0.05),而Six1-siRNA组Six1的蛋白表达显著低于空白组(P<0.05)。见图2。
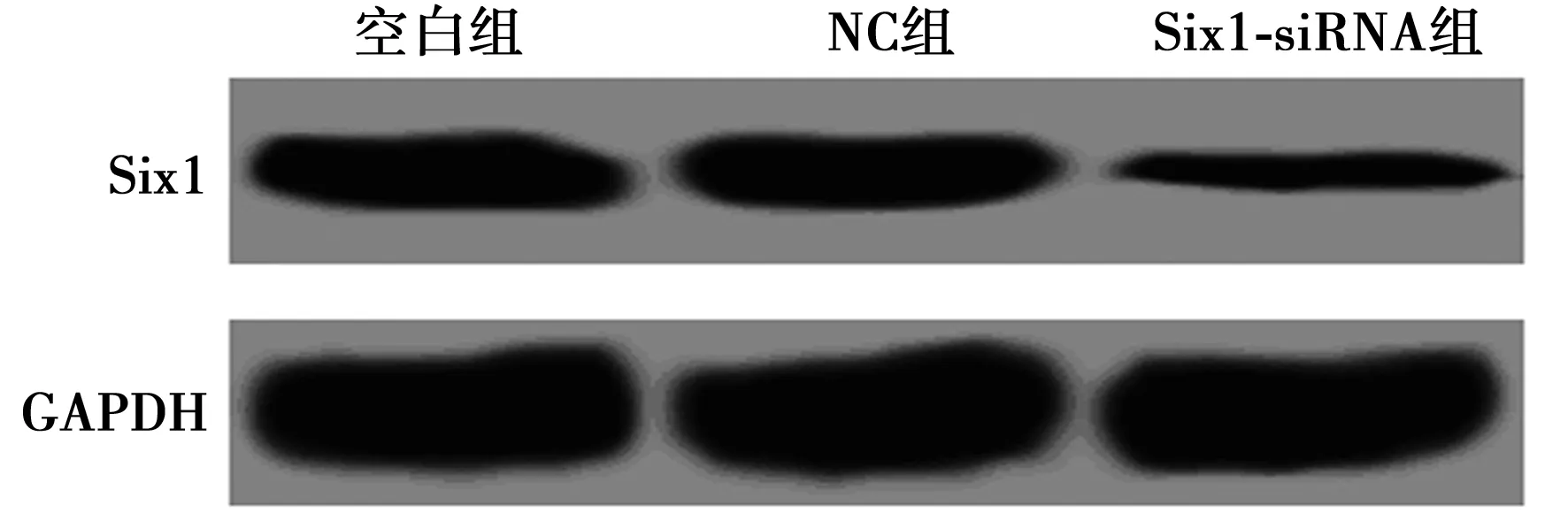
图2 转染Six1-siRNA的肺癌细胞Six1的表达
2.3转染Six1-siRNA对A549细胞增殖凋亡的影响 与空白组比较,Six1-siRNA组细胞24~72 h的细胞增殖均显著降低(P<0.05),在48 h的细胞凋亡率显著升高(P<0.05)。见表1。
2.4转染Six1-siRNA对A549细胞PCNA、Bax、Notch1和Hes1蛋白表达的影响 与空白组比较,Six1-siRNA组PCNA、Notch1和Hes1的蛋白表达均显著降低(P<0.05),Bax蛋白表达显著升高(P<0.05)。见表1,图3。
表1 转染Six1-siRNA后A549细胞增殖、凋亡率及PCNA、Bax、Notch1、Hes1蛋白表达量比较
与空白组比较:1)P<0.05
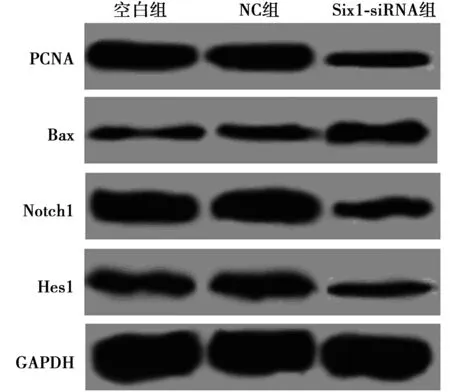
图3 转染Six1-siRNA对A549细胞PCNA、ax、Notch1和Hes1蛋白表达的影响
3 讨 论
Six1是Six蛋白家族成员,在成人组织中含量较低,过量表达可导致肿瘤的发生〔6〕。目前已发现在多种肿瘤中出现Six1的过表达。Six1的表达上调可促进癌细胞增殖及细胞向上皮间质的转化〔7,8〕,这提示在多种肿瘤中Six1可能以肿瘤蛋白的作用存在。为了检测肺癌中Six1的作用,本文首先检测了肺癌组织中Six1的表达,发现肺癌组织中也存在Six1的高表达,这说明Six1可能影响肺癌的发生发展。有研究发现,结直肠癌中Six1的高表达可增强癌细胞的增殖能力〔9〕;上调宫颈癌中Six1的表达可增强肿瘤细胞的增殖和侵袭能力,且使G2/M期缩短,而下调其表达后癌细胞的增殖及侵袭能力均明显降低〔10〕;下调骨肉瘤细胞Six1的表达可明显抑制肿瘤细胞的增殖和迁移能力〔11〕。以上研究提示抑制Six1的表达可降低肿瘤的发生发展。RNA干扰能特异、高效地抑制目的基因表达,是目前研究基因功能的新方法,已得到广泛的应用〔12〕。本研究中将Six1的siRNA转染肺癌细胞,通过CCK8法和流式细胞术分别检测细胞增殖及凋亡情况,发现Six1的表达受到抑制后,肺癌细胞的增殖明显降低、凋亡率增加。这提示Six1在肺癌中也是癌基因。
肺癌的发生涉及多种癌基因和抑癌基因。PCNA是DNA合成不可缺少的因子,在细胞增殖过程中起重要作用,可作为评价恶性肿瘤增殖的良好指标〔13〕,目前也应用于肺癌增殖的检测〔14〕。Bax为Bcl-2家族成员之一,发挥促凋亡作用,与肿瘤的发生发展及预后密切相关〔15〕。肺癌中Bax表达上调可引起癌细胞凋亡〔16〕。本研究抑制Six1的表达后检测PCNA、Bax的表达,发现PCNA表达受到抑制、Bax表达上调,这说明Six1对肺癌细胞增殖凋亡的影响可通过调节PCNA、Bax的表达而实现。在多种肿瘤中Notch1信号通路过度表达,如肺癌、结直肠癌等,影响肿瘤的发生发展〔17,18〕。有研究发现,下调肺癌中Notch1信号可降低肺癌的增殖及诱导细胞凋亡〔19〕。本研究为了证实Six1对肺癌增殖凋亡的影响是否通过影响Notch1信号通路,通过Western印迹检测Notch1信号通路Notch1及下游靶基因Hes1的蛋白表达,发现Notch1和Hes1的表达均明显降低。
综上所述,抑制肺癌细胞Six1的表达后可降低癌细胞增殖,诱导细胞凋亡;下调Notch1信号通路、抑制细胞增殖及诱导凋亡的方式是下调PCNA表达和上调Bax表达。

