线粒体ATP敏感性钾离子通道开放剂改善冠心病大鼠模型心肌氧化应激损伤的分子机制
孙朝阳,周坤*,马翔
(1陕西省安康市中心医院心血管内科,安康 725000;2新疆医科大学第一附属医院心脏中心,乌鲁木齐 830054)
冠心病(coronary heart disease,CHD)是由冠状动脉粥样硬化造成的冠状动脉供血相对不足,进而造成心肌缺氧、缺血,导致的心脏疾病[1]。有报道指出,药物可通过降低心肌耗氧抑制钙超载、清除氧自由基、抑制细胞凋亡、促血管生成等不同途径起到抗心肌缺血的作用。氧化应激在心力衰竭与心肌缺血/再灌注损伤等心脏病变中发挥重要作用[2]。脑和心脏等器官易受缺氧缺血损伤,最终通过影响线粒体功能造成心肌细胞死亡或凋亡[3],线粒体膜通透性转换孔(mitochondrial permeablity transition pore,MPTP)开放是缺血/再灌注损伤导致线粒体损伤并最终致细胞死亡的关键。线粒体ATP敏感性钾离子通道(mitochondrial ATP-sensitive potassium channels,mitoKATP)与MPTP 间存在关联。目前,抑制MPTP开放被认为是治疗缺血/再灌注损伤的关键点[4]。有报道指出,二氮嗪作为mitoKATP的开放剂,可通过激活内源性心肌保护机制,起到抗心肌缺血缺氧损伤的作用[5-7]。
1 材料与方法
1.1 实验材料
清洁级健康SD大鼠共40只,雌雄各20只,体质量(220±20)g。由军事医学科学院动物中心提供。将40只SD大鼠随机分为4组:正常对照组(不造模且不给予二氮嗪药物干预)、假手术组(仅切皮不进行造模手术)、模型组(制作冠心病大鼠模型,但不给予二氮嗪药物干预)和药物组(制作冠心病大鼠模型,给予二氮嗪3 mg/kg干预),每组10只。
1.2 方法
1.2.1 模型建立及干预方法 大鼠麻醉后固定,气管插管,连接人工动物呼吸机支持呼吸, 从胸骨左侧第3、4肋间正中线旁开5 mm行纵向切口, 于心脏左心耳根部下方2~3 mm处穿线,结扎冠状动脉左前降支,建立心肌缺血模型。结扎后迅速将心脏还纳,关闭胸腔,恢复自主呼吸。以术后Ⅱ导联心电图ST段弓背向上抬高为造模成功的标志。造模1周后开始灌胃给药,药物组给予二氮嗪3 mg/kg,正常对照组、假手术组和模型组灌胃同体积的生理盐水,1次/d,共4周。给药结束后禁食12 h,不禁水。利用多导生理检测仪对心功能和冠状动脉血流量进行测定,以颈椎脱臼的方式处死大鼠,取心脏,去掉心房和右心室,将左心室保存于-80℃下。
1.2.2 心功能测定 (1)由房室瓣插入球囊,接压力换能器,连接Power-Lab血流动力学信号采集与分析系统,记录左心室收缩压(left ventricular systolic pressure,LVSP)、左室内压最大变化速率(最大上升速率:+dp/dtmax;最大下降速率:-dp/dtmax)。(2)分离冠状动脉左旋支根部,放置微型电磁流量计探头,检测冠状动脉血流量(coronary flow,CF)。
1.2.3 成纤维细胞生长因子2和血管内皮生长因子mRNA的检测 采用总RNA提取试剂盒(Takara公司)对各组中的总RNA进行提取,具体操作如下。取新鲜血液,加红细胞裂解液(1∶3,v/v),充分混匀,静置10 min,10 000转/min离心1 min。弃上清,收集白细胞沉淀。加入1 ml TRIzol,充分混匀后,室温放置5 min,使样品充分裂解,4℃ 12 000转/min离心10~15 min。收集上清,加入冰冷的异丙醇(1∶1,v/v),混匀,静置10~20 min,4℃ 12 000转/min离心10 min,收集水相层(约550 μl),转移到新的无酶离心管中,离心弃上清,向沉淀中加入50~100 μl RNase-free水,轻弹管壁,以充分溶解RNA。分别对各mRNA引物进行设计,详见表1。实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)分析反应体系为20 μl。反复混匀点甩后,置于荧光实时定量PCR仪中进行扩增,反应参数为95℃预变性10~15 min,95℃变性5~20 s,55℃~60℃退火,30~40 s,40个循环。将得到的Ct值,带入2-△△Ct,计算成纤维细胞生长因子2(fibroblast growth factor 2,FGF-2)和血管内皮生长因子(vascular endothelial growth factor,VEGF)mRNA转录水平。
1.2.4 细胞总蛋白的提取 按照凯基全蛋白提取试剂盒操作说明进行。每1 ml裂解液中加入5 μl磷酸酶抑制剂、1 μl蛋白酶抑制剂和5 μl苯甲基磺酰氟(100 mmol/L),混匀冰上保存。弃去细胞培养液, 预冷磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤细胞2次,加入裂解液,冰上孵育15 min,将细胞刮下,转移至1.5 ml EP管中,4℃ 10 000转/min离心5 min,取上清液转移至新的EP管中,置于-80℃保存。
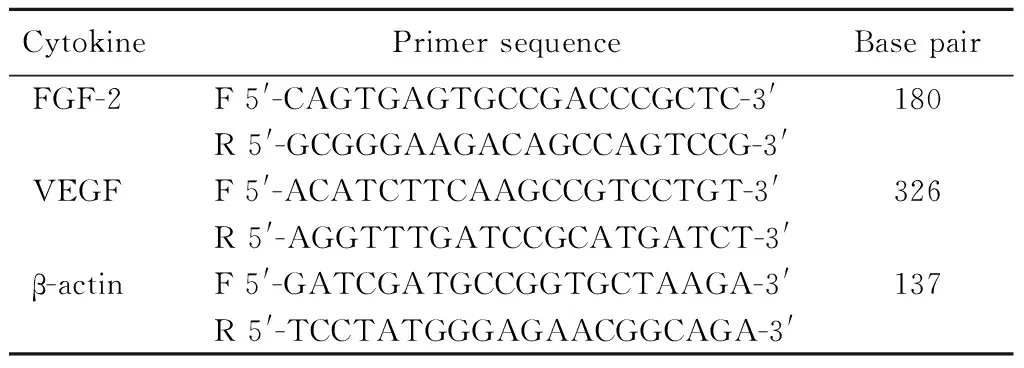
表1 RT-PCR引物序列设计结果
RT-PCR: reverse transcription-polymerase chain reaction; FGF-2: fibroblast growth factor-2; VEGF: vascular endothelial growth factor.
1.2.5 Western blotting 按照碧云天SDS-PAGE凝胶配制试剂盒操作说明配置凝胶。根据目的蛋白分子量大小选用10%的分离胶和5%的浓缩胶。加入一抗(小鼠抗大鼠FGF-2单克隆抗体;兔抗小鼠VEGF多克隆抗体;兔抗小鼠乳酸脱氢酶多克隆抗体),稀释度均为1∶400,孵育时间为2 h。将制备好的凝胶放入电泳槽中,进行SDS-PAGE凝胶电泳分析,之后分别进行转膜与杂交。
1.2.6 心肌细胞培养及氧化应激损伤模型建立 在无菌条件下,开胸取出心脏,剪心室肌,用预冷的D-Hank′s冲洗3次,剪碎至糊状,加含 0.125%胰蛋白酶消化液4~5 ml,37℃消化3 min,静置 1 min,弃上清,加入5 ml消化液,消化7 min,于室温静置1 min。收集上清,加入同体积含10%胎牛血清的DMEM培养液终止消化。1 000转/min离心4 min,以DMEM培养液(含15%胎牛血清)重悬,重复3~5 次后转移至100 ml培养瓶中,在培养前2天加阿糖胞苷抑制非心肌细胞贴壁生长。待细胞长满瓶底后传代,调节细胞数为 4×105个/孔。将模型组与药物组的心肌细胞通过500 μmol/L过氧化氢(hydrogen peroxide,H2O2)进行处理,37℃孵育2 h。应用100 μmol/L H2O2培养16 h以复制心肌细胞氧化应激损伤模型。
1.2.7 乳酸脱氢酶、线粒体膜电位和细胞死亡率的测定 各组细胞经处理后,根据试剂盒步骤,通过生化自动分析仪检测乳酸脱氢酶活性。细胞经处理后,向培养皿中加入1 ml PBS,充分混匀,加入终浓度为5 μmol/L的Rh-123,37℃避光10 min,EDTA-胰酶消化,1 000转/min离心5 min,弃上清,PBS冲洗1次,加10 ng/ml PI,充分混匀,流式细胞仪测各孔的荧光强度(各份样品计数大于10 000个细胞)。Rh-123的发射波长为525 nm、激发波长为488 nm;PI 的发射波长为 675 nm、激发波长为488 nm。计算各区域细胞的平均荧光强度以及百分比,评价细胞的线粒体膜电位(mitochondrial membrane potential,MMP)及其死亡情况。
1.3 统计学处理
2 结 果
2.1 各组大鼠心功能变化比较
与正常组及假手术组比较,模型组大鼠的LVSP、+dp/dtmax、-dp/dtmax和CF显著下降(P<0.05)。与模型组比较,药物组的LVSP、+dp/dtmax、-dp/dtmax和CF显著增加(P<0.05;表2)。
2.2 各组大鼠心脏中细胞因子mRNA转录水平的比较
通过测定血清中免疫细胞因子FGF-2和VEGF mRNA转录水平,判断各组血管生长因子的生长情况。由结果可以看出,与正常组和假手术组相比,模型组大鼠FGF-2与VEGF mRNA转录水平显著增加(P<0.05),而与模型组相比,药物组大鼠FGF-2 mRNA与VEGF mRNA转录水平显著降低(P<0.05;表3)。
2.3 各组大鼠生长因子蛋白表达量和心肌细胞乳酸脱氢酶的变化
通过Western blotting实验对各组大鼠心脏FGF-2及VEGF蛋白表达量进行测定,结果见图1。
表2 各组大鼠心功能变化比较
LVSP: left ventricular systolic pressure; +dp/dtmax: maximum rate of left ventricular pressure rise; -dp/dtmax: maximum rate of left ventricular pressure decline; CF: coronary flow. Compared with control group,*P<0.05; compared with sham operation group,#P<0.05; compared with model group,△P<0.05. 1 mmHg=0.133 kPa.
将各条带的灰度值进行计算,结果表明,与正常组和假手术组相比,模型组大鼠FGF-2与VEGF 蛋白表达水平增加(P<0.05);与模型组相比,药物组大鼠FGF-2与VEGF表达水平降低(P<0.05)。500 μmol/L H2O2作用于心肌细胞2 h后,结果表明,与正常组和假手术组相比,模型组中乳酸脱氢酶表达增加(P<0.05),表明膜通透性增加,而与模型组相比,预先用二氮嗪处理的药物组的乳酸脱氢酶表达降低(P<0.05;表4),由此推测,二氮嗪对抗H2O2诱导的乳酸脱氢酶增加可能与激活的mitoKATP有关。
表3 各组大鼠心脏中FGF-2与VEGF mRNA转录水平的比较
FGF-2: fibroblast growth factor 2; VEGF: vascular endothelial growth factor. Compared with control group,*P<0.05; compared with sham operation group,#P<0.05; compared with model group,△P<0.05.

图1 各组大鼠心脏FGF-2及VEGF蛋白表达量
FGF-2: fibroblast growth factor 2; VEGF: vascular endothelial growth factor.
表4各组大鼠生长因子蛋白和心肌细胞LDH表达量
Table 4 Comparison of expression of FGF-2, VEGF and LDH among groups (n=10)

GroupFGF-2VEGFLDH(U/L)Control0.72±0.130.81±0.2140.13±1.14Sham opera-tion0.80±0.230.75±0.2139.20±2.22Model1.32±0.33*#1.20±0.13*#156.12±10.18*#Drug0.69±0.33△0.68±0.33△49.32±3.51△
FGF-2: fibroblast growth factor 2; VEGF: vascular endothelial growth factor; LDH: lactate dehydrogenase. Compared with control group,*P<0.05; compared with sham operation group,#P<0.05; compared with model group,△P<0.05.
2.4 心肌细胞MMP和死亡率与H2O2诱导的氧化应激损伤的关联
与正常组和假手术组相比,模型组细胞MMP和死亡率增加(P<0.05),而Rh-123荧光强度降低(P<0.05)。与模型组相比,药物组细胞MMP和死亡率降低(P<0.05),而Rh-123荧光强度增加(P<0.05;图2,表5)。

图2 过氧化应激损伤对心肌细胞MMP的影响

Group Cell death rate(%)Fluorescence intensityControl28.33±2.20820.10±5.15Sham opera-tion29.20±2.23816.25±4.17Model66.12±3.23*# 220.24±6.15*#Drug30.32±3.48△780.12±9.20△
MMP: mitochondrial membrane potential. Compared with control group,*P<0.05; compared with sham operation group,#P<0.05; compared with model group,△P<0.05.
3 讨 论
二氯嗪又名氯甲苯噻,英文名diazoxide,分子式C8H7ClN2O2S,是由5-氯-2-乙酰胺基-N-乙酰基苯磺酰胺经高温环合而得。该药物可从清除氧自由基、降低心肌耗氧、促血管生成、抑制钙超载、抑制细胞凋亡等多种途径起到抗心肌缺血的效果。mitoKATP通道分布于血管、骨骼肌、胰腺、神经元等组织,在细胞缺氧损伤的保护机制中可能具有重要作用,在缺血预适应及缺血后适应心肌保护机制中起到关键作用[8]。研究表明,二氮嗪作为mitoKATP开放剂,具有抗心肌缺血缺氧损伤作用。本实验表明,二氮嗪可促进LVSP、+dp/dtmax、-dp/dtmax的绝对值、CF增加,且FGF-2和VEGF mRNA转录水平降低。有研究表明,在新血管形成的过程中,有诸多血管生长因子参与调节,FGF-2和VEGF是最强有力的2种血管生成因子。FGF-2可刺激蛋白酶原活化因子与内皮细胞分泌蛋白酶,从而导致血管基底膜降解,使细胞侵入周围基质,从而形成新的、具有空腔的血管[9,10]。VEGF能够特异性地促进血管内皮细胞分裂及增殖,促进血管生成,增强血管通透性,使血管内成分渗漏,为血管形成与内皮迁移提供基质[11,12]。
有关报道指出,缺血心肌组织可释放大量自由基,而活性氧自由基在缺血再灌注的心肌损伤中具有十分重要的作用。H2O2是体内氧化代谢的中间产物,当其大量积聚时,会导致细胞产生毒性。本研究采用H2O2诱导心肌细胞产生氧化应激性损伤,建立实验模型。Rh-123是一种阳离子亲脂性荧光染料,可使膜产生通透性,活细胞线粒体内外膜存在跨膜电位,故能特异地聚集在线粒体,Rh-123荧光强度降低表明线粒体数量降低或MMP降低和丧失。PI是分子量较大的一种化合物,不能进入细胞膜,细胞膜遭到破坏或细胞死亡时,PI可较快地进入细胞,与DNA和RNA在核着染,因此可根据PI的着染情况,评价细胞的死亡情况[13]。本研究利用流式细胞仪结合Rh-123和PI双标记法准确检测MMP,从而反映细胞存活状态。本实验结果表明,500 μmol/L H2O2作用2 h后,大鼠心肌细胞培养液乳酸脱氢酶活性增强,MMP下降,细胞存活率降低,由此表明,H2O2导致了心肌细胞受损;二氮嗪干预后,乳酸脱氢酶活性降低,MMP和细胞存活率增高。研究表明,二氮嗪可通过激活线粒体KATP通道介导的信号通路,对H2O2造成的心肌细胞氧化应激损伤起到保护作用。
综上所述,mitoKATP通道开放剂可缓解冠心病大鼠心肌氧化应激损伤,其机制与缓解FGF-2和VEGF过度上调有关。

