TNF-α对A549细胞MMPs和TIMPs mRNA的影响*
,,,,,,,
(1. 右江民族医学院附属医院,广西 百色 533000;2. 广西壮族自治区人民医院,广西 南宁 530021)
急性呼吸窘迫综合征(ARDS)的病死率高。已有研究表明基质金属蛋白酶(MMPs)和基质金属蛋白酶组织抑制剂(TIMPs)通过细胞外基质(ECM)重塑,参与了ARDS 的病理生理过程[1-2]。MMPs的过度表达或TIMPs的相对不足,导致两者之间比例失衡,影响了ARDS的转归。本研究采用肿瘤坏死因子α(TNF-α)预处理A549细胞,了解前炎细胞因子对MMPs/TIMPs表达的影响,为后续研究提供一定的实验基础。
1 材料与方法
1.1 细胞来源 A549人非小细胞肺癌细胞(2017年新引进)由中国科学院干细胞库提供。
1.2 主要试剂 TNF-α(NBP2-35076,Novus),Trizol Reagent(15596018,Invitrogen),RevertAid First Strand cDNA Synthesisi Kit(#K1622,Thermo Fisher Scientific),FastStart Universal SYBR Green Master(04913850001,Roche),F-12K培养基、胎牛血清、胰酶(Gibco公司)。
1.3 主要仪器 5424R高速冷冻离心机(德国Eppendorf公司),NanophtoometerP360 超微量分光光度计(德国Implen公司),MyCycler型梯度PCR仪(美国Bio-Rad公司),LightCycler 96荧光定量PCR仪(瑞士Roche公司)。
1.4 目的基因的选择 从美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中查找GAPDH、MMPs家族和TIMPs家族对应基因编号及基因序列,结合数据库qPrimerDB信息,通过Primer Premiers 5.0软件设计引物,并由上海Invitrogen生物公司合成。见表1。

表1 实时荧光定量PCR的引物序列
1.5 细胞培养 将A549细胞常规培养于含10%胎牛血清的F-12K培养基,置于37℃恒温、5% CO2培养箱内培养,隔日换液。待细胞贴壁融合度达90%时,用0.25%胰蛋白酶将贴壁生长的细胞消化后传代培养用于实验。
1.6 实验分组及处理 将对数期A549细胞接种于培养皿,待细胞贴壁融合度达到80%时,正常对照组中加入等量培养基,TNF-α组加入终浓度为10 ng/ml 的TNF-α,继续培养8 h后收集各组细胞用于实验。实验重复3次。
1.7 细胞总RNA的提取和实时荧光定量PCR 按Trizol Reagent试剂盒说明的使用方法,提取各组细胞总RNA,用紫外分光光度法测定总RNA 浓度和纯度,并经琼脂糖电泳检测总RNA完整性。各组分别取2.5 μg总RNA为逆转录模板,按RevertAid First Strand cDNA Synthesisi Kit试剂盒说明书进行逆转录制备20 μl cDNA,将cDNA稀释10倍后取2 μl作为模板进行qRT-PCR扩增。qRT-PCR反应体系为20 μl,每样品设3个复孔,同时设置空白对照和阴性对照,qRT-PCR循环参数为:95℃预变性600 s,95℃变性10 s,60℃退火10 s,45个循环。使用Roche LightCycler 96荧光定量PCR仪运行检测各样本的域值循环数(Ct值),并根据融解曲线分析PCR产物的特异性。以管家基因GAPDH作为对照,通过2-ΔΔCt计算反映目的基因的相对表达量。

2 结果
2.1 TNF-α对MMPs mRNA的影响 qRT-PCR结果显示,与对照组相比,TNF-α组中MMP-1、MMP-2、MMP-3、MMP-7、MMP-9、MMP-10、MMP-12、MMP-13、MMP-14、MMP-15、MMP-16、MMP-19、MMP-25和MMP-27 mRNA转录水平明显升高(P<0.05或P<0.01),MMP-17和MMP-28 mRNA转录水平下降(P<0.05或P<0.01),结果见表2和图1。
2.2 TNF-α对TIMPs mRNA的影响 qRT-PCR结果显示,与对照组相比,TNF-α组中TIMP-1和TIMP-2 mRNA转录水平升高(P<0.001),TIMP-3和TIMP-4 mRNA转录水平下降(P<0.001),结果见表3和图2。

表2 A549细胞中MMPs家族mRNA相对表达量

图1 A549细胞中MMPs家族mRNA相对表达量
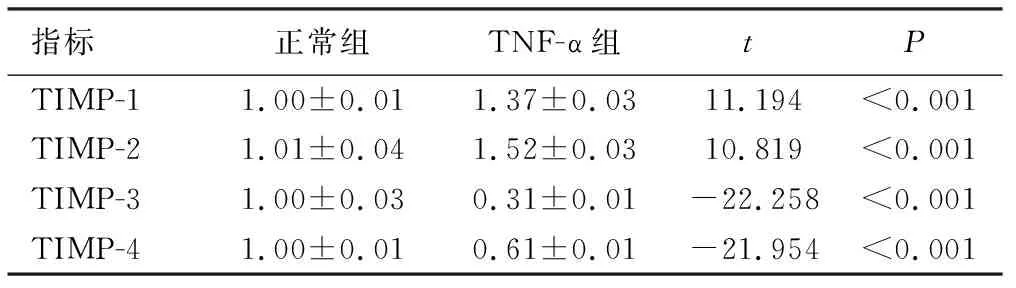
指标正常组TNF-α组tPTIMP-11.00±0.011.37±0.0311.194<0.001TIMP-21.01±0.041.52±0.0310.819<0.001TIMP-31.00±0.030.31±0.01-22.258<0.001TIMP-41.00±0.010.61±0.01-21.954<0.001

图2 A549细胞中TIMPs家族mRNA相对表达量
3 讨论
ARDS的病理基础是过度的炎症反应,引起肺上皮-血管内皮屏障损伤,导致肺水肿和透明膜形成[3]。已有研究表明,ARDS早期已产生纤维增生反应,其主要特点为成纤维细胞积聚和肺ECM成分沉积[4-5]。MMPs/TIMPs是调控ECM重塑的重要因素,二者比例失衡参与了如特发性肺纤维化等疾病进程[6]。在 ARDS相关临床研究也发现肺损伤后肺泡灌洗液中部分MMPs表达水平明显升高,这在一定程度上表明炎症初期MMPs/TIMPs失衡可能促进ARDS进展[7]。TNF-α是ARDS中重要的前炎症因子,可放大炎症反应,造成细胞炎症损伤[8]。为明确ARDS过程中MMPs和TIMPs表达谱,本研究使用TNF-α刺激肺上皮A549细胞构建ARDS体外模型初步检测炎症损伤早期MMPs和TIMPs转录水平改变情况。
MMPs是在结构上同源以编号形式命名的内肽酶,属蛋白水解酶家族,可按作用底物分6类,具有ECM重塑、促细胞迁移和激活免疫防御系统等作用[9]。本实验发现TNF-α处理A549细胞后,胞内胶原酶MMP-1、MMP-13,明胶酶MMP-2、MMP-9,间充质溶解素MMP-3、MMP-10,基质溶解素MMP-7以及巨噬细胞弹性蛋白酶MMP-12转录水平均明显升高,表明肺上皮细胞中MMPs的表达对TNF-α的刺激较敏感,其中胶原酶、明胶酶和间充质溶解素均参与细胞损伤应答。既往研究发现,这5类MMPs可降解弹性蛋白和基底膜的主要成分Ⅳ型胶原和明胶等ECM成分,破坏基底膜结构的完整性参与ECM重塑过程[10]。由此说明ARDS中肺部肺泡毛细血管通透性增加,炎性渗出增多和弥漫性间质损伤可能是因MMPs表达增多导致。此外,与正常对照组相比,TNF-α刺激后模型MMPs中MMP-14、MMP-15、MMP-16、MMP-17和MMP-25以及其他类的MMP-19、MMP-27和MMP-28转录水平也发生改变,其中MMP-17和MMP-28发生转录抑制,其余因子转录被激活。目前膜型MMPs与ARDS相关研究较少,本研究提示膜型MMPs可能参与ARDS早期炎症应答过程。另外,有研究提示MMP-19缺乏时成纤维细胞增殖更明显[11],MMP-28升高可作为特发性肺纤维化生物标志[12],但本研究结果显示炎症初期MMP-19表达增强而MMP-28表达减弱,说明炎症反应初期纤维化相关因子存在双向改变,但具体的作用及其机制有待进一步研究。
TIMPs是MMPs内源性特异抑制因子,包括TIMP-1、TIMP-2、TIMP-3和TIMP-4,TIMP-1、TIMP-2和TIMP-4是以分泌形式存在,而TIMP-3以非可溶形式存在于ECM中,TIMPs和MMPs二者形成复合体后MMPs活性可被抑制[13]。TIMPs可抑制ECM蛋白的水解,稳定ECM结构,当TIMPs过度表达时会增加ECM积聚。我们的研究发现TIMP-1和TIMP-2转录水平升高,而TIMP-3和TIMP-4转录水平降低。表明TIMPs参与炎症损伤过程,TIMPs系列因子中出现双向变化,MMPs/TIMPs比例相对改变,说明炎症早期MMPs/TIMPs平衡紊乱,ECM发生降解和沉积,影响了ARDS中肺组织的损伤和修复。
综上所述,我们的研究初步明确了MMPs和TIMPs在肺上皮A549中广泛表达,且在炎症损伤早期两家族因子转录水平都存在双向改变。尽管细胞系可模拟出炎症损伤表现,但ARDS发病机制复杂,不同种类的MMPs和TIMPs介导ECM重塑参与ARDS损伤和修复的机制仍需要在动物模型中进一步研究。

