核受体基因在家族遗传性胆囊胆固醇结石患者肝组织中 表达的变化
李春艳,赵欣,樊宁,胡勇,李亮,高巧营,陈颖,王丽,崔云峰
(1.天津医科大学研究生院,天津300070;天津市南开医院 3.超声科 4.中西医结合急腹症研究所 5.肝胆胰外科一 ,天津300100;2.天津市北辰区中医医院 普通外科,天津 300400)
胆囊胆固醇结石病(cholesterol gallstone disease,CGD)是常见的消化系统疾病,同时也是胆囊癌及胆系肿瘤的危险因素,好发于成年女性[1-2]。现今大量研究表明CGD的发生发展受到多个基因、环境和遗传因素等的相互作用调控,是多因素决定的复杂性状疾病[3]。国内外流行病学以及遗传学研究提示种族差异以及遗传异质性在CGD的发生发展过程中具有重要的作用[4-5]。现今基于数量性状位点分析和全基因组关联研究等筛选出了60余个胆石病(gallstone,GD)的易感基因/位点[6-7]。然而目前发现的大部分GD候选基因是基于小鼠GD模型发现的,这些候选基因在家族遗传性CGD患者(hereditary cholesterol gallstone,HCGD)肝组织中的表达情况尚未见报道,笔者的前期研究[8]发现固醇携带蛋白2(sterol carrier protein-2,SCP2)在HCGD中高表达,因此,基于前期研究和查阅国内外相关文献[3,6,8-10],笔者在与GD相关核受体(nuclear receptors,NRs)基因、合成酶基因、膜转运体基因中筛选了7 个与脂代谢相关的NRs基因:肝X受体α(liver X recepter α,LXRα)、法尼醇X受体(farnesoid X receptor,FXR)、甾醇调节元件结合蛋白2(sterol regulatory element binding protein 2,SREBP-2)、雌激素受体α/β(estrogen receptors α/β,ERα/β)、G 蛋白偶联受体3 0(G proteincoupled receptor30,GPR30)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)基因,并采用实时荧光定量聚合酶链反应(real-time quantitative reverse transcriptase PCR,qRT-PCR)检测其在汉族人群HCGD、散发性CGD患者(sporadic cholesterol gallstone,SCGD)和非胆结石患者(gallstone-free controls,对照组)肝组织mRNA水平表达变化,以期进一步从分子水平探讨HCGD发病机制奠定基础,同时也为探寻早期治疗HCGD患者有效药物靶点提供参考。
1 资料与方法
1.1 研究对象和实验标本来源
收集自2016年9月—2017年9月于天津市南开医院肝胆胰外科一住院行手术治疗患者肝组织20~30 mg,入选患者均为天津市汉族常住人口,经空腹B超或手术诊断为胆囊胆固醇结石。本研究经医院学术伦理委员会的批准(2017-020P),患者均签署知情同意书。
纳入标准:⑴年龄18~80周岁,性别不限;⑵ HCGD组三代直系血亲中至少两代,且每代中至少有1例CGD患者(经空腹B超或手术诊断);⑶ SCGD组除患者本人外,三代直系血亲中经空腹B超诊断无胆囊胆固醇结石;⑷ 对照组为肝血管瘤患者行手术治疗,并经空腹B超诊断无胆石病、无泌尿系结石的患者。排除标准:合并有与胆固醇代谢紊乱相关疾病,如肥胖、糖尿病、动脉粥样硬化疾病等;酗酒、药物(近1个月服用降低胆固醇的药物)、妊娠、严重的心血管疾病、恶性肿瘤等。最终纳入对照组患者7例,其中男2例,女5例;年龄30~77岁;HCGD组患者9例,其中男 4例,女5例;年龄20~58岁;SCGD组9例,其中男3例,女6例;年龄31~66岁。
1.2 实验试剂
动物组织总R N A 提取试剂盒(离心柱型,DP431)、SuperReal PreMix Plus(SYBR Green, F P 2 0 5)均购自天根生物科技(北京)有限公司,TransScript® First-Strand cDNA Synthesis SuperMix(AT301)购自北京全式金生物技术(TransGen Biotech)有限公司。
1.3 实验方法
1.3.1 标本收集 ⑴ 血液标本的收集:各实验组患者于入院次日空腹平卧外周静脉采血,离心,取血清备用。⑵ 肝组织标本收集:签署知情同意书后,于术中取20~30 mg 肝组织。
1.3.2 血脂的测定 使用全自动生化分析仪,酶法检测血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein, LDL)、载脂蛋白A1(apolipoprotein A1,ApoA1)、 载脂蛋白B(apolipoprotein B,ApoB)、脂蛋白(a)[Lipoprotein(a),Lp(a)]、总胆汁酸(total bile acid,TBA)。
1.3.3 红外光谱法定性胆囊结石化学成分 收集术后患者胆囊结石,生理盐水反复冲洗干净,晾干研磨后称取结石1 mg 和溴化钾粉末100 mg,充分混合均匀后采用红外光谱分析法检测胆囊结石成分以确定为胆固醇结石。
1.3.4 检测各实验组脂质代谢相关基因mRNA 相对表达量 通过Primer 5.0 软件设计脂质代谢相关引物,并通过Blast 检测引物的特异性,引物列表见表1,由上海生工生物技术公司合成引物。使用动物组织总RNA 提取试剂盒从人肝脏组织中提取总RNA。分别采用分光光度法和琼脂糖凝胶电泳检测RNA 浓度、纯度和完整性。采用SYBR Green 法进行qRT-PCR 检测各组核受体LXRα、FXR、SREBP2、ERα、ERβ、GPR30、PPARɣ基因mRNA 的表达。具体步骤如下:反应体系总体 积 为20 µL,包 括2× SuperReal PreMix Plus 10 µL, 50×ROX Reference Dye 1 µL,cDNA 模板2 µL,正反向引物各0.6 µL 和RNase-Free ddH2O 5.8 µL。反应条件:预变性95 ℃ 15 min,变性 95 ℃ 10 s,退火59 ℃ 20 s,进行40 个循环,终末延伸72 ℃ 32 s。ABI7500Fast 实时定量PCR 仪进行PCR 反应,结束后读取Ct 值。结果采用2-ΔΔCt法计算基因的相对表达量。

表1 相关基因引物序列Table 1 Primer sequences of the studied genes
1.4 统计学处理
采用SPSS 19.0软件和Graph Pad Prism 7.04 软件进行统计学分析和作图。正态分布计量资料采用均数±标准差(±s)表示;组间差异比较采用单因素方差分析(one-way ANOVA),总体均数有差异的,进一步采用LSD分别检验两组间均数差异;计量变量比较采用χ2检验进行分析;Spearman相关系数分析观测指标间的相关性。所有统计学检验均为双侧检验,以P<0.05作为有统计学差异的标准。
2 结 果
2.1 研究对象一般资料
临床资料显示,对照组、HCGD组、SCGD组组间性别组成、年龄、体质量指数(BMI)差异均无统计学意义(均P>0.05)(表2)。
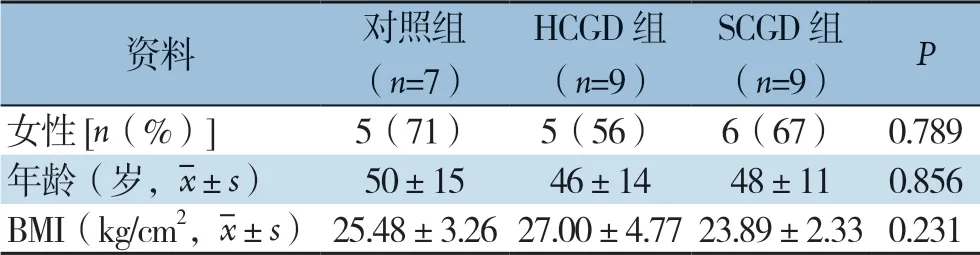
表2 三组患者一般资料比较Table 2 Comparison of the general data among the three groups of patients
2.2 血清脂代谢相关指标
HCGD组、SCGD组血清TC、TG、LDL、ApoA1、ApoB、Lp(a)含量较对照组升高,HDL含量较对照组降低,但各组间差异均无统计学意义(均P>0.05);HCGD组TBA含量较对照组、SCGD组明显降低,差异有统计学意义(均P <0.0 5)(表3)。
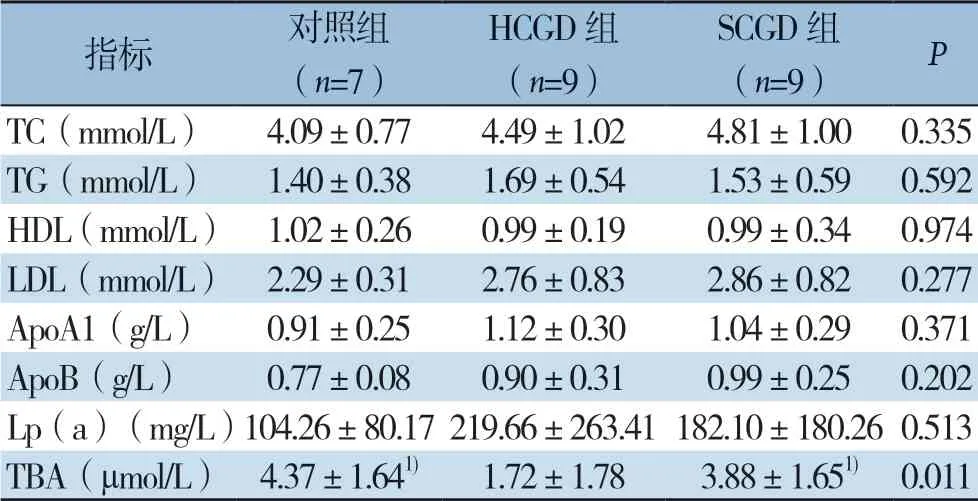
表3 三组血清脂代谢相关指标比较(x-±s)Table 3 Comparison of the serum lipids metabolism related variables among the three groups (x-±s)
2.3 调节肝脂质代谢NRs mRNA 的表达
LXRα和GPR 30m RNA在各组肝组织表达量无统计学差异(均P>0.05);与对照组比较,ERα mRNA在HCGD组和SCGD组表达均明显上调(均P<0.01),且HCGD组ERα mRNA相对表达量高于SCGD组(P<0.05);FXR mRNA在SCGD组明显上调(P<0.05),而在HCGD组无统计学差异(P>0.05);ERβ mRNA在HCGD组表达明显上调(P<0.05),而在SCGD组无统计学差异(P>0.05);SREBP2和PPARγ mRNA在HCGD组表达均明显上调(均P<0.01),而SCGD组均无统计学差异(均P>0.05)(表4)。
表4 三组患者肝组织NRs 基因相对表达量比较(±s)Table 4 Comparison of mRNA expressions of NRs among the three groups of patients (±s)
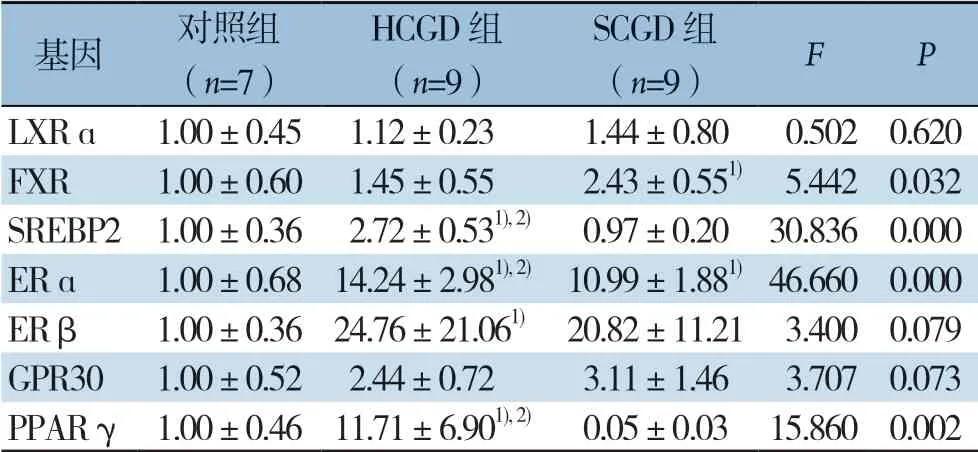
表4 三组患者肝组织NRs 基因相对表达量比较(±s)Table 4 Comparison of mRNA expressions of NRs among the three groups of patients (±s)
注:1)与对照组比较,P<0.05;2)与SCGD 组比较,P<0.05Note: 1) P<0.05 vs. control group; 2) P<0.05 vs. SCGD group
基因 对照组(n=7)HCGD 组(n=9)SCGD 组(n=9) F P LXRɑ 1.00±0.45 1.12±0.23 1.44±0.80 0.502 0.620 FXR 1.00±0.60 1.45±0.55 2.43±0.551) 5.442 0.032 SREBP2 1.00±0.36 2.72±0.531), 2) 0.97±0.20 30.836 0.000 ERɑ 1.00±0.68 14.24±2.981), 2) 10.99±1.881) 46.660 0.000 ERβ 1.00±0.36 24.76±21.061) 20.82±11.21 3.400 0.079 GPR30 1.00±0.52 2.44±0.72 3.11±1.46 3.707 0.073 PPARγ 1.00±0.46 11.71±6.901), 2) 0.05±0.03 15.860 0.002
2.4 肝组织 SREBP2、ERα、ERβ、PPARγ mRNA 表达与血清TBA 的相关性
分析结果显示,仅在HCGD组中ERα、ERβ m R N A 表达与患者血清T B A 水平呈明显负相关(r=-1.000,P=0.000;r=-0.989,P=0.011)(表5)。
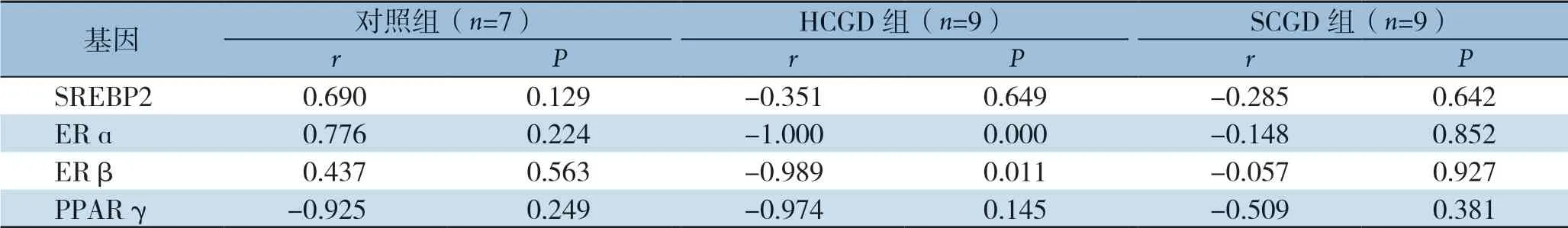
表5 三组SREBP2、ERα/β、PPARγ mRNA 表达与血清TBA 相关性分析Table 5 Correlation analysis of mRNA expressions of SREBP2, ERα/β and PPARγ with serum TBA in the three groups
3 讨 论
脂质代谢紊乱是CGD形成过程中肝细胞所发生的重要表型变化[6,11-12],与高脂血症、代谢综合征、动脉粥样硬化、冠心病、肥胖、糖尿病、阿尔兹海默病、肿瘤等多种疾病相关[13]。NRs不仅调节机体生长发育、细胞分化与增殖、免疫,而且还参与机体内众多生理,特别是代谢过程中的基因表达进行调控。与其它转录因子不同,NRs可直接与甾体、胆汁酸等配体结合[9,14]。笔者的前期研究[5]发现GD具有家族聚集性且符合常染色体延迟遗传的特点。NRs在HCGD中的表达尚未见报道。本研究显示,血清TC、TG、LDL、ApoA1、ApoB、Lp(a)在各组间无显著性差异,与Jiang等[15]的研究结果一致。
ERα和ERβ属于经典的雌激素核受体,通过调节下游靶基因的转录而发挥“基因型”调节作用[16]。研究显示小鼠CGD动物模型中,17β-雌二醇主要通过雌激素受体(estrogen receptors,ERs)对靶基因转录调控在肝胆汁胆固醇的生物合成以及致石病理生理过程中起着至关重要的作用。此外,小鼠肝脏的染色质免疫沉淀实验显示,有43种脂质相关基因是由ERα转录调控的[17]。deBari等[18]在去卵巢选择性敲除ERs的ER(-/-)雌性小鼠中观察到,其成石率较ER(+/+)组降低了70%,提示靶向性的阻断ERα基因表达,可预防高脂饮食并且暴露于高水平雌激素的小鼠CGD的形成。本研究发现,HCGD组、SCGD组ERα mRNA表达水平明显高于对照组,同时HCGD组ERαmRNA表达水平明显高于SCGD组,提示ERα基因不仅参与CGD发病,而且可能在CGD的遗传中起着一定的作用,具体的分子机制尚需进一步的研究。在本研究中,ERαmRNA 在CGD中高表达,这与大部分文献报道的一致。Wang等[19]的研究发现CGD的发病与ERα上调相关,而与ERβ无关;这可能与ERα和ERβ具有不同的转录激活结构域、组织分布特异性以及不同的剪接变异有关。然而,本研究发现,HCGD组中ERβmRNA表达水平明显高于对照组,提示ERβ可能参与了高表达ERα人群CGD遗传性。同时,本研究还发现,HCGD组血清TBA比对照组、SCGD组显著降低,并且相关性分析显示,HCGD组血清TBA与ERα/βmRNA水平相关。GPR30是 7次跨膜转运的受体蛋白,属于G蛋白受体偶联超家族。目前,GPR30在胆石病中作用的研究还较少。有研究[20]表明,17β-雌二醇不仅通过激活ERα 引起去卵巢小鼠胆汁胆固醇和胆盐代谢紊乱,而且还通过GPR30途径参与胆固醇结晶的形成过程。在本研究中未发现GPR30 mRNA在对照组、HCGD组和SCGD组中显著差异表达。
SREBP2是肝胆固醇从头合成限速酶3-羟基-3-甲基戊二酰辅酶A 还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGCR)的主要转录因子。笔者前期研究[21]发现CGD患者肝组织HMGCR mRNA表达水平显著高于对照组患者。PPARγ调控异常与肥胖、2 型糖尿病、动脉粥样硬化等糖脂代谢紊乱疾病相关,在小鼠胆石模型中被确认为胆石易感基因[22],然而,Schafmayer等[23]在德国人群中却未发现PPARγ与胆石易感的相关证据。在本研究中,HCGD组SREBP2、PPARγ mRNA表达水平高于对照组和SCGD组;然而,SCGD组SREBP2、PPARγ mRNA表达水平与对照组间无统计学差异,提示HCGD和SCGD可能存在不同的发病机制及CGD的遗传异质性;SREBP2、PPARγ可能参与了HCGD的发病,然而SCGD人群CGD的发病可能是由其他与肝脂质代谢或肝胆汁酸代谢相关的基因发挥调控作用或者是由同一基因的不同突变类型诱导,从而掩盖了SREBP2、PPARγ的调控效应,说明CGD发病机制的复杂性。
LXRα主要在肝脏、脂肪组织和小肠组织中表达[24],可调节胆固醇吸收、运输、排泄及转化为胆汁酸的蛋白质的基因表达。Jiang等[15]发现中国CGD患者(非肥胖型、血脂正常)的核受体LXRα比对照组的表达水平增加,主要是通过调节下游靶基因ABCG5/G8实现的。然而,本研究结果显示,LXR mRNA表达水平在对照组、HCGD组和SCGD组中均无统计学差异,与杨士勇等[25]的实验结果一致。FXR也称为胆汁酸受体,Moschetta 等[26]发现与野生型小鼠相比,FXR基因敲除小鼠喂食致石饲料仅1周后即表现出CGD的所有病理表型,提示FXR的功能与CGD相关。其机制可能是FXR基因敲除后引起与胆汁酸转运相关基因ABCB11 以及与磷脂转运相关基因ABCB4的表达下调,使胆汁酸和磷脂的转运受损;与胆汁酸合成的相关基因CYP27A1、CYP7A1和CYP8B1的表达上调引起胆固醇饱和指数增加,最终胆固醇结晶析出。本研究结果发现,SCGD组FXR mRNA表达水平高于对照组和HCGD组,而HCGD组FXR mRNA表达水平与对照组比较无统计学差异,提示FXR可能参与了SCGD的发生。然而杨士勇等[25]的研究显示,CGD患者肝脏FXR mRNA的表达与胆固醇结石形成无关。这也从另一侧面提示SCGD人群和HCGD人群携带的FXR基因可能存在多态性。
综上所述,核受体基因ERα/ERβ、SREBP2、PPARγ与HCGD发病相关,这些基因可能在CGD的遗传中起着一定的作用。其中,SREBP2、PPARγ在HCGD发病与SCGD发病中可能存在不同的调控机制。肝脏中“ERα-SREBP2”的调节通路可能参与了HCGD的发生。进一步明确肝组织NRs基因FXR、ERα/β、SREBP2和PPARγ在CGD形成过程中具有重要的作用,今后探寻这些基因间相互作用的重要调控点以及调控的下游靶基因,或可为防治CGD及其他脂质代谢紊乱疾病的药物靶点提供理论基础。肝NRs mRNA在CGD与非胆石肝组织中表达存在差异,而且SCGD和HCGD中也存在不同的基因表达。进一步证明CGD是微效多基因遗传性疾病。本研究仅在mRNA水平探寻与HCGD相关的核受体基因,尚需进一步进行Western blot和免疫组化等从蛋白水平证实NRs蛋白表达情况,以期进一步从转录后或翻译后水平探讨核受体在CGD中基因调控机制。

