产氨基甲酸乙酯降解酶酵母菌的筛选鉴定及发酵条件优化
周雪燕,辛敏汉,肖婧,程卫东,史学伟*
(1.石河子大学 食品学院,新疆 石河子 832000;2.石河子大学 信息科学与技术学院,新疆 石河子 832000)
氨基甲酸乙酯(ethyl carbamate,常简称为 EC),又名脲烷(urethane),是烟草叶及香烟的天然成分,也是发酵食品[1]与酒精饮品[2]发酵或贮存过程中的伴随产物[3,4]。20世纪40年代,Nettleship实验证明 EC具有致癌作用,EC可以引起肺肿瘤、淋巴癌、肝癌、皮肤癌等。现今EC被广泛用于工业涂料及动物麻醉[5]。作为一种水溶性的致癌物质,已成为2002年FAO重点监控物质,国际标准规定其含量不得超过20μg/L[6]。就食品行业而言,面包、酱油、葡萄酒、中国黄酒等生活必需品不断发展,其伴随产物EC的产生是无法避免的,对食品及饮料中的EC采取适宜又安全的方法将其含量降低至安全限量以下具有实质性的必要。
目前研究的降解或控制氨基甲酸乙酯的生成有多种方式,主要从控制EC前体物质、控制EC的产生条件和使用EC水解酶直接去除3个方面进行处理。如通过控制发酵食品的发酵条件、向食品中添加脲酶、选育低产尿素酵母菌来进行发酵等方法来减少发酵产酒时生成氨基甲酸乙酯的问题。研究表明,生物酶法降解EC是一种温和、安全有效的方法。综上所述,筛选产EC降解酶酵母菌株并研究其产酶特性具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 菌种
选取保藏于石河子大学食品学院微生物实验室的酵母菌株。
1.1.2 培养基
酵母浸出粉胨葡萄糖琼脂培养基(YPD)[7]:琼脂2.0%,蛋白胨2.0%,葡萄糖2.0%,酵母浸粉1.0%,用蒸馏水配制,自然pH,121℃高压灭菌20min。
筛选培养基:氨基甲酸乙酯(EC)2.5~20g/L,氯化钠2g/L,硫酸铵4g/L,磷酸二氢钾2.5g/L,磷酸氢二铵10g/L,七水合硫酸锌0.2g/L,七水合硫酸镁0.5g/L,七水合硫酸亚铁0.05g/L,四水合硫酸锰0.15g/L,琼脂粉20g/L,pH 5.0。
种子培养基:葡萄糖2%,蛋白胨2%,酵母浸粉1%,自然pH。
发酵培养基:葡萄糖2%,蛋白胨1%,酵母浸粉2%,自然pH,EC 5g/L。
1.1.3 主要试剂与仪器
氨基甲酸乙酯、甲酰胺、氨基甲酸甲酯、N-甲基乙酰胺:美国Sigma公司;乙酰胺、N,N-二甲基甲酰胺、亚硝基铁氰化钠、苯酚、次氯酸钠、氢氧化钠:国药集团化学试剂有限公司。
5810R高速冷冻离心机 德国Eppendorf仪器公司;LAC-5040S全自动高压灭菌锅 浙江新丰医疗器械有限公司;CX21FS1光学显微镜 Olympus公司;722紫外分光光度计 上海精密科学仪器有限公司;TC-512PCR扩增仪 英国 Techne公司;Power Pac Universal水平电泳仪、Gel DOC X0R凝胶成像系统 美国BioRad公司。
显色剂Ⅰ:称取30g苯酚和1.25g亚硝基铁氰化钠溶于超纯水并定容至500mL后冷藏于冰箱。显色剂Ⅱ:称取26.25g氢氧化钠和15mL次氯酸钠超纯水定容至500mL后冷藏于冰箱。终止剂:10%的TCA。底物溶液:用0.05mol/L磷酸缓冲液(pH 7.0)配制成3%EC溶液后冷藏。
1.2 方法
1.2.1 EC降解菌株的筛选
将保藏的36株菌株接种于YPD培养基中,于28℃恒温培养箱活化培养24h,挑取单菌落,再以EC为唯一碳源的筛选培养基上划线培养24h后,选取既可以在高浓度EC又可以在低浓度EC筛选培养基上生长的菌株作为EC降解菌株。
1.2.2 菌株的鉴定及系统发育分析
EC降解菌株的DNA采用Biospin真菌基因组DNA提取试剂盒提取,根据试剂盒提供药品及方法提取。
PCR 扩增如下[8]:
上游引物:ITS1(5'-TCCGTAGGTGAACCTGCGG-3');
下游引物:ITS4(5'-TCCTCCGCTTATTGATATGC-3')。
扩增体系:总体积为50μL:2μL的模板DNA,2μL的上游引物,2μL的下游引物,25μL的Easy Taq Supermix,19μL的ddH2O,并做空白对照。
将符合标准的扩增产物进行测序。测序结果在NCBI(National Center for Biotechnology Information)BLAST中进行同源序列比对:下载相似性在99%以上菌种的序列,连同测序菌株的序列用Claustal X1.83软件进行多序列比对,结果采用MEGA 6.0软件中的邻近法(Neighbor-Joining)进行系统发育树的构建,并用Bootstrap对进化树进行1000次置信度分析[11]。
1.2.3 EC降解酶活力测定方法
1.2.3.1 酶活测定步骤
准确吸取200μL酶液于比色管中(空白对照:将酶液在沸水中保温20min,使酶液失活),加入800μL底物溶液,30℃水浴20min后加1mL终止剂终止反应。混匀后加入1mL显色剂Ⅰ,混匀后再加1mL显色剂Ⅱ混匀,30℃水浴保温20min,用超纯水定容至10mL,测定OD625。

式中:ΔOD625为测定的EC降解酶反应后与空白样品光密度之差;n为酶活测定液稀释倍数;k为标准曲线斜率的倒数;10为样品的稀释倍数;20为酶作用的时间(min)。
1.2.3.2 NH4+标准曲线的绘制
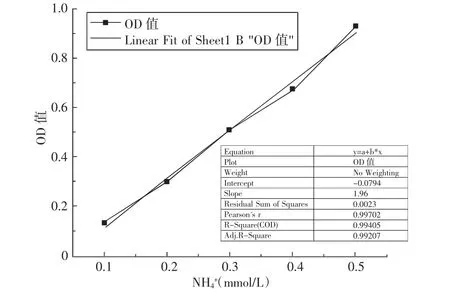
图1 NH4+标准拟合曲线Fig.1 NH4+ standard curve
将氨水配成0.1mol/L的NH4+溶液,再分别配制成0.1,0.2,0.3,0.4,0.5mmol/L 的 NH4+标准溶液。准确吸取1mL标准浓度NH4+溶液,分别置于编号的比色管中,在50℃下水浴30min,加入1mL终止液,充分混匀,再依次加入1mL显色剂Ⅰ和显色剂Ⅱ振荡并充分混匀,反应20min,用超纯水定容至10mL,在625nm下比色测定OD值,以OD值为纵坐标,NH4+标准液浓度为横坐标作图,标准曲线图见图1。
1.2.4 产酶条件优化
热敏灸联合枇杷清肺饮加减方治疗寻常性痤疮的临床观察…………………………………………………… 黄 青等(2):229
1.2.4.1 培养基优化
碳源及其浓度对菌体发酵产酶的影响:将蔗糖、麦芽糖、葡萄糖作为培养基中的碳源物质(总量均为20g/L),菌株按4%的接种量接种,在30℃,200r/min条件下摇床震荡培养4天,分别取样测定其发酵产酶情况。筛选出合适的碳源之后,将其碳源浓度分别设置为10,20,30,40,50,60g/L,得到菌体发酵产酶最佳时的碳源浓度。
氮源及其浓度对菌体发酵产酶的影响:以葡萄糖为碳源,分别用不同的氮源:酵母粉、蛋白胨、硫酸铵、硫酸铵+酵母粉、蛋白胨+硫酸铵、酵母粉+蛋白胨+硫酸铵(1∶1∶2)代替摇瓶发酵培养基中的氮源物质,其余条件同上,按期取样测定菌株的产酶情况。选出合适的氮源之后,设置不同的氮源浓度10,20,30,40,50,60,70g/L来研究其对菌株发酵产酶的影响。
无机盐对菌体发酵产酶的影响:向发酵培养基中添加 浓 度 为 1mmol/L 的 CuSO4,FeSO4,ZnSO4,MnSO4,KH2PO4及CaCl2,以不添加无机盐的培养基作为空白对照,其他条件均相同,考察无机盐对菌株发酵产酶情况的影响。
底物浓度对菌体发酵产酶的影响:分别在对数中期向培养基中添加浓度为2.5,5.0,7.5,10.0g/L的底物EC,以不添加EC为对照,考察初始底物浓度对发酵产酶的影响。
1.2.4.2 培养条件优化
将菌株按4%的接种量接种于发酵培养基中,在30℃,200r/min摇床震荡培养,发酵过程中每隔12h取样测定其发酵产酶量。
将菌株按4%的接种量接种于发酵培养基中,分别于25,28,30,33,35℃,200r/min摇床震荡培养,测定同上。
将菌株按4%的接种量接种于发酵培养基中,调节培养基初始 pH 分别为 3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,在30℃,200r/min条件下摇床震荡培养,测定同上。
将菌株按4%的接种量接种于发酵培养基中,初始 pH 6.0,装液量分别为10%,20%,30%,40%,50%,60%,于30℃,200r/min摇床震荡培养,测定同上。
按接种量分别为2%,4%,6%,8%,10%,12%将菌株接种于发酵培养基中,培养基初始pH 6.0,装液量75mL,在30℃,200r/min摇床震荡培养,测定同上。
1.2.5 正交试验验证
采用正交试验对其显著的因素进行试验设计,并进行验证。
根据单因素试验结果,选取底物浓度、培养时间、初始pH、装液量、温度、氮源浓度6个因素为考察对象,以及各个因素最优的3个水平,以发酵产酶能力为评价指标,进行6因素3水平L18(37)正交试验。
1.3 数据处理与分析
采用Origin 8.0软件进行单因素分析,用DPS软件进行正交分析。
2 结果与分析
2.1 产 EC降解酶酵母菌的筛选与鉴定[12-14]
将实验室已存的36株酵母菌在筛选培养基上初步筛选得到6株产EC降解酶菌株,分别为N6,P2,Y13,Y18,Y4,Y9。增加EC浓度,对6株菌进一步复筛,结果表明 Y4,Y9,Y13,N6在EC最高浓度为17.5g/L的培养基上正常生长,菌落形态见图2。

图2 酵母菌菌落形态Fig.2 Yeast colony morphology
2.2 16SrDNA扩增产物电泳检测结果
提取菌株N6,Y13,Y9,Y4的DNA后进行PCR扩展,将PCR扩展产物进行凝胶电泳检测,结果见图3。4株菌在500~600bp之间出现了特异性条带,明亮清晰,符合测序标准。
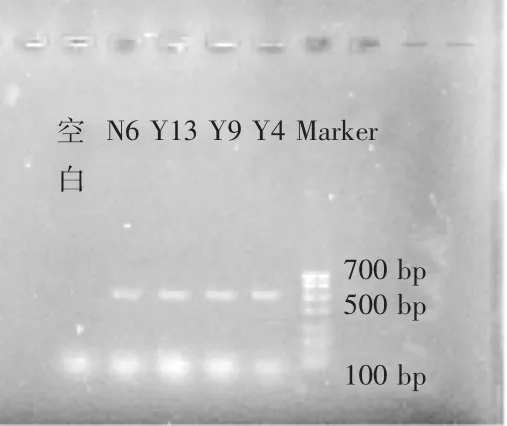
图3 16SrDNA扩增产物电泳检测图Fig.3 The electrophoretogram of 16SrDNA amplification products
2.3 酵母菌的系统发育分析
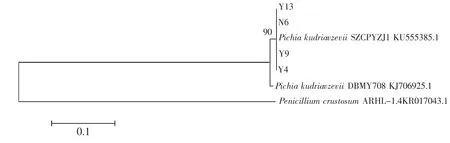
图4 酵母菌ITS系统发育树Fig.4 The phylogenetic tree of yeast ITS
由图4可知,供试菌株Y13,N6,Y9,Y4与Pichia kudriavzevii SZCPYZJ1 同源性强,属于 Pichia kudriavzevii(库德里阿兹威氏毕赤酵母)。通过系统发育分析4株供试菌株均属于1个属,且均在EC浓度为17.5g/L的培养基上正常生长,因此选取其中生长活性较好的菌株Y13进行后续试验。
2.4 发酵产酶条件优化
2.4.1 不同碳源及碳源浓度对Y13产酶能力的影响

图5 不同碳源对酵母菌产酶能力的影响(A)和不同碳源浓度对酵母菌产酶能力的影响(B)Fig.5 Effects of different carbon sources on enzyme production ability of yeast(A)and the effects of different carbon sources concentration on enzyme production ability of yeast(B)
由图5中A可知,在蔗糖、葡萄糖和麦芽糖3种碳源中,菌株Y13在以麦芽糖为碳源时产酶活性最好,其次是蔗糖,最后是葡萄糖。由此表明,双糖比单糖更易被Y13利用。由图5中B可知,以麦芽糖为Y13碳源,当其浓度为10g/L时,酶活最高,这是因为碳源浓度过高会提高培养基中的渗透压,抑制微生物的生长。
2.4.2 不同氮源及其浓度对Y13产酶能力的影响

图6 不同氮源对酵母菌产酶能力的影响(A)和不同氮源浓度对酵母菌产酶能力的影响(B)Fig.6 Effects of different nitrogen sources on enzyme production ability of yeast(A)and the effects of different nitrogen sources concentration on enzyme production ability of yeast(B)
由图6中A可知,在供试的7种不同配比的氮源中,Y13在单独以酵母粉为氮源发酵时,产酶的酶活最优;以酵母粉为氮源。由图6中B可知,当酵母粉浓度为30g/L时,Y13的发酵产酶能力最好。2.4.3 不同无机盐对Y13产酶能力的影响

图7 不同无机盐对酵母菌产酶能力的影响Fig.7 Effects of different inorganic salts on enzyme production ability of yeast
由图7可知,在发酵培养基中添加6种不同无机盐,以不添加无机盐为空白对照,结果表明无机盐的有无对Y13发酵产酶的酶活影响不大,因此在培养菌株Y13时无机盐对其影响不作考虑。
2.4.4 不同底物浓度对Y13产酶能力的影响

图8 不同底物浓度对酵母菌产酶能力的影响Fig.8 Effects of different substrate concentration on enzyme production ability of yeast
在菌株Y13的摇瓶发酵试验时,培养基中含有底物EC。而不同的底物浓度对菌株Y13的发酵产酶情况有着较大的影响。由图8可知,底物浓度为5.00%时,Y13菌株发酵产酶的酶活最高。
2.5 培养条件优化
2.5.1 接种量与培养时间对酵母菌产酶能力的影响
由图9中A可知,接种量为6%时,酵母菌的产酶能力最佳,且提升显著。由图9中B可知,随着培养时间的增长,菌株的生长活性逐渐增加,当培养至115h时生长活性最强,之后随着时间延长,生长活性也随之降低。
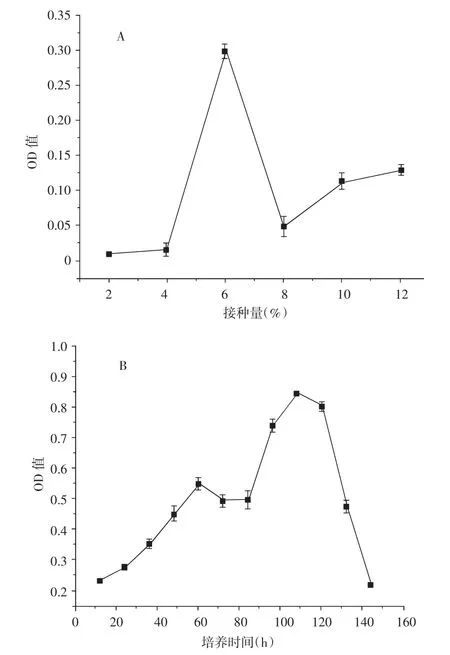
图9 不同接种量与培养时间对酵母菌产酶能力的影响Fig.9 Effects of different inoculum size and culture time on yeast enzyme-producing ability
2.5.2 初始pH与装液量对酵母菌产酶能力的影响
由图10中A可知,随着初始pH值的增加,菌株的生长活性也随之上升,当初始pH为6时,菌株的生长活性最佳。由图10中B可知,当装液量在20%时菌株的生长活性最为旺盛,但20%以后菌株的生长活性逐渐降低。

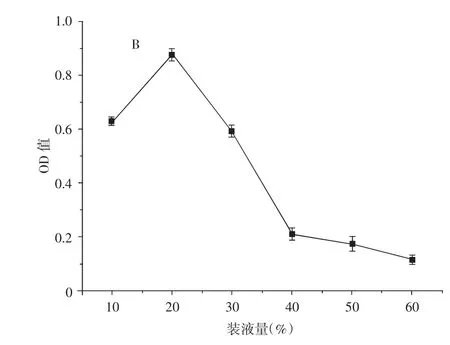
图10 不同pH值与装液量对酵母菌产酶能力的影响Fig.10 Effects of different pH values and liquid volume on yeast enzyme-producing ability
2.5.3 不同温度对酵母菌产酶能力的影响

图11 不同温度对酵母菌产酶能力的影响Fig.11 Effect of different temperatures on yeast enzyme-producing ability
由图11可知,菌株在30℃环境下生长活性最好,与通常的酵母菌最佳生长温度基本一致。
2.5.4 Y13菌株产酶条件正交试验分析

表1 产酶条件优化正交试验结果与分析Table1 Optimization of orthogonal test results and analysis of enzyme production conditions
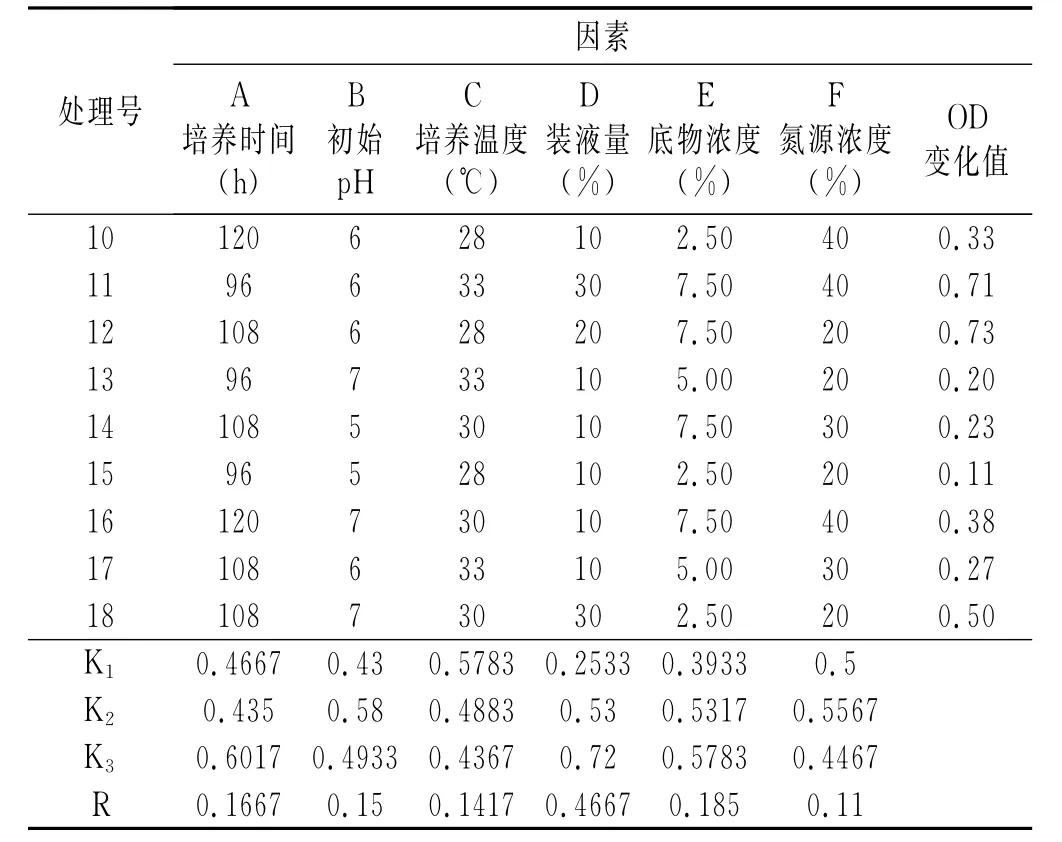
续 表
由表1正交表极差分析可知,对Y13菌株产酶影响的重要性为D>E>A>B>C>F,即装液量>底物浓度>培养时间>初始pH>培养温度>氮源浓度。由正交试验可知菌株Y13产酶最佳条件为D3E2A1B3C2F2,即培养温度为28℃,初始pH为6,装液量为20%,底物浓度为5.00%,氮源浓度为30g/L的条件下培养120h时菌株的发酵产酶情况最佳。综合单因素优化和正交优化的结果,菌株Y13的最优培养条件为:麦芽糖浓度为10g/L,酵母粉浓度为30g/L,接种量为6%,培养基中的底物浓度为5.00%,装液量为20%,初始pH为6,培养温度为28℃,培养时间为120h。
3 结论
发酵食品和酒精饮料的加工过程中会产生EC,酒精又会促进EC的致癌作用,随着人们生活水平的提高,酒精饮料和发酵食品的消费量增大,对于EC降解的研究也变得至关重要。众多研究表明,最行之有效的方法为生物降解法,而本文就产氨基甲酸乙酯水解酶酵母菌的筛选、鉴定及发酵产酶条件进行了研究。筛选出菌株Y13,经鉴定为库德毕赤酵母,具有较好的发酵产酶能力,并且经过单因素和正交试验优化,得到了该菌株的最佳发酵产酶条件,为研究氨基甲酸乙酯的降解奠定了基础。

