水酶法提取金耳多糖的工艺优化
, ,,,,*
(1.云南省供销合作社科学研究所,云南昆明 650221; 2.云南大学农学院,云南昆明 650091)
金耳(Tremellaaurantialba),是异担子菌纲(Heterobasi-diomycetes),银耳目(Tremellales),银耳科(Tremellaceae)的名贵食药用真菌[1],又称黄木耳、茂若色尔布(藏语)、黄耳、脑耳,自然分布于我国西藏、云南等地。金耳性甘、温,具有清肺生津、化痰止咳、调气定喘、平肝阳、补心养气的功效[2]。金耳主要活性成分为金耳多糖,子实体多糖的主链为木糖和甘露糖,具有免疫增强、保肝、促进造血功能、抑制炎症及溃疡、抗辐射、抗衰老等作用[3]。
金耳子实体多糖的分子量较大,约300~500 kD[3],常规提取工序中易产生大量泡沫,提取分离困难,不利于云南地区丰富金耳资源的开发。目前金耳多糖提取方法主要有水提取[4]、超声波提取[5-7]、微波提取[8]、酶法提取[9]等,其中利用酶法辅助提取金耳多糖的方法具有节能环保、可减少高温及超声对活性成分的影响、更高得率等优势。纤维素酶、果胶酶为最为常用提取用酶,温和的酶处理条件在提高提取物的品质、提取率以及提高副产物质量等方面存在优势[10-15],水酶法在植物油提取方面的研究和应用也越来越广泛。
水酶法提取金耳多糖相关工艺研究报道较少,影响多糖得率的主要因素有酶添加量、提取温度、提取液料比、提取时间、粒径等[4,14],本试验采用响应面分析法研究纤维素酶及果胶复合酶添加量、提取温度、提取液料比、提取时间及粒径因素对提取金耳多糖得率的影响,拟获得水酶法提取金耳子实体多糖最佳提取工艺,为金耳多糖提取开发奠定基础。
1 材料与方法
1.1 材料与仪器
金耳子实体干品 由昆明食用菌研究所提供;浓硫酸、苯酚 分析纯,国药集团化学试剂有限公司;D-无水葡萄糖 纯度99.9%,中国食品药品检定研究院;纤维素酶,台州海松化工产品有限公司;果胶酶 食品级,酶活105U/g,苏柯汉(澳资)生物工程有限公司。
J-301型低温超速离心机 美国贝克曼库尔特有限公司;SPECORD® 200 PLUS型分光光度计 德国耶拿分析仪器股份公司;ME204/02型电子天平 梅特勒-托利多仪器(上海)有限公司;DGF-80型粉碎机 沧州方圆公路建筑仪器厂;HH.S21-8型数显电热恒温水浴锅 杭州科晓化工仪器设备有限公司;OKP-S0标准通用型超纯水机 上海涞科仪器有限公司。
1.2 实验方法
1.2.1 金耳多糖的制备 将金耳子实体切碎后于60 ℃烘干,冷却至室温后用粉碎机粉碎,过一定目数的样品筛得到金耳粉。称取一定质量的金耳粉,加5倍体积的80%乙醇在80 ℃水浴条件下进行回流去脂2 h,然后抽滤、烘干得到脱脂金耳粉。准确称取一定量的脱脂金耳粉,加入蒸馏水和一定比例的纤维素酶及果胶酶后进行提取。提取完成后10000 r/min离心10 min取上清液,将上清液浓缩至一定体积后加入4倍体积的无水乙醇静置过夜。10000 r/min离心10 min后得到沉淀,再用适量丙酮洗涤后-80 ℃冰箱预冷冻24 h,冷冻干燥24 h即为金耳粗多糖[16]。
1.2.2 多糖得率的计算 以D-无水葡萄糖标准品为标准,采用苯酚-硫酸法[17]测定金耳多糖的浓度。
1.2.2.1 葡萄糖标准方程的建立 苯酚-硫酸法建立标准方程:准确称取10 mg干燥的D-无水葡萄糖溶解,在250 mL的容量瓶中定容。分别吸取0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL标准葡萄糖溶液,以蒸馏水补充至2 mL,加入1 mL 6%的苯酚及5 mL浓硫酸,冷却至室温后在490 nm处测吸光度。取2 mL的蒸馏水按同样的步骤作为空白对照。以葡萄糖溶液的质量浓度(mg/mL)为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.2.2 金耳多糖得率的计算 将冷冻干燥之后获得的金耳多糖40 mg用200 mL蒸馏水溶解后,量取2 mL金耳多糖溶液按照1.2.2.1的苯酚-硫酸法在490 nm处测定金耳多糖溶液的吸光度,参照标准方程计算金耳多糖的浓度,依据式(1)计算金耳多糖的得率(W)。
式(1)
式中:w-金耳多糖的得率(%);c-检测样品溶液的浓度(mg/mL);v-检测样品溶液的体积(mL);m-金耳粉的质量(mg)。
1.2.3 复合酶比例的确定 称取粉碎至60目的金耳粉1 g,液料比为100∶1 (mL/g),提取温度为50 ℃,提取时间为30 min的条件下探究果胶酶与纤维素酶不同比例(2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2)对金耳多糖得率的影响,通过复合酶添加量预实验优选果胶酶与纤维素酶添加量为20 mg。
1.2.4 单因素实验 分别以不同的复合酶添加量、提取时间、提取温度、液料比、粒径为单因素[4,14]进行试验,探究各因素对金耳多糖得率的影响。
1.2.4.1 复合酶添加量 称取粉碎至60目的金耳粉1 g,液料比为100∶1 (mL/g),提取温度为50 ℃,提取时间为30 min的条件下探究不同果胶酶与纤维素酶复合酶添加量(5、10、15、20、25、30 mg)对金耳多糖得率的影响。
1.2.4.2 提取时间 称取粉碎至60目的金耳粉1 g,液料比为100∶1 (mL/g),提取温度为50 ℃,复合酶添加量为20 mg的条件下探究不同提取时间(10、20、30、40、50、60 min)对金耳多糖得率的影响。
1.2.4.3 提取温度 称取粉碎至60目的金耳粉1 g,液料比为100∶1 (mL/g),复合酶添加量为20 mg,提取时间为30 min的条件下探究不同提取温度(40、45、50、55、60、65 ℃)对金耳多糖得率的影响。
1.2.4.4 液料比 称取粉碎至60目的金耳粉1 g,复合酶添加量为20 mg,提取温度为50 ℃,提取时间为30 min的条件下探究不同液料比(100∶1、200∶1、300∶1、400∶1、500∶1 mL/g)对金耳多糖得率的影响。
1.2.4.5 粒径 分别称取不同粒径(40、60、80、100、120、140目)的金耳粉1 g,在液料比为100∶1 (mL/g),提取温度为50 ℃,提取时间为30 min的条件下探究粒径对金耳多糖得率的影响。
1.2.5 响应面试验 根据单因素实验的结果,选取液料比、提取时间、提取温度、复合酶的添加量4因素为自变量,以金耳多糖的得率为响应值。采用Box-Behnken中心组合设计响应面试验。试验因素和水平见表1。
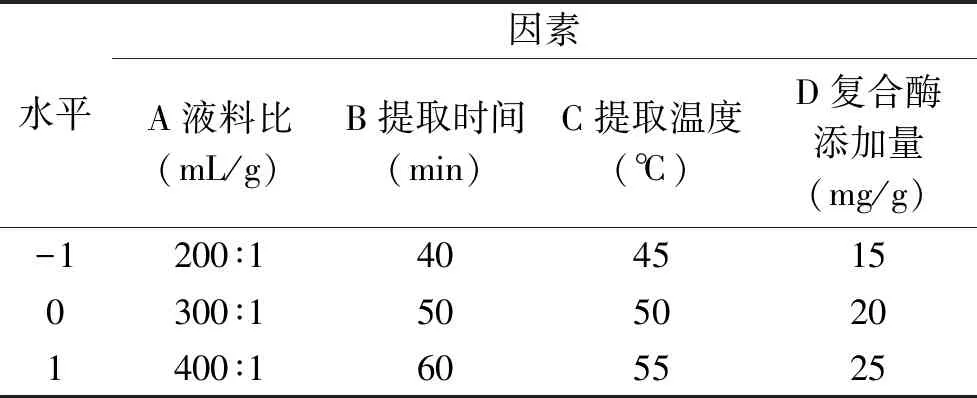
表1 响应面试验因素与水平设计Table 1 Factors and levels in response surface design
1.3 数据统计分析
应用Excel 2010软件统计数据及作图,应用软件Design Expert 8.0.5中Box-Behnken中心组合设计响应面试验。并进行3次平行验证试验。
2 结果与分析
2.1 葡萄糖标准曲线
葡萄糖标准曲线方程:y=6.2328x+0.0232,R2=0.9914。其中y为490 nm处的吸光度,x为葡萄糖的质量浓度(mg/mL)。
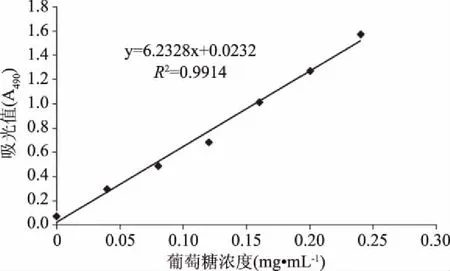
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 复合酶比例的确定
果胶酶与纤维素酶的不同复配比例(共20 mg/g)对金耳多糖得率的影响如图2所示,随着果胶酶与纤维素酶比例由2∶8升高至6∶4,金耳多糖得率随之增加,但当果胶酶与纤维素酶比例由6∶4升高至8∶2,金耳多糖得率呈明显下降趋势,表明果胶酶与纤维素酶配比为6∶4时金耳多糖的得率最高,故后续实验中,优选复合酶中果胶酶与纤维素酶复配比例为6∶4。

图2 果胶酶与纤维素酶的配比对金耳多糖得率的影响Fig.2 Effect of the ratio of pectinase to cellulase on extraction rate of polysaccharide from Tremella aurantialba
2.3 单因素实验
2.3.1 复合酶添加量对金耳多糖得率的影响 在复合酶添加量为20 mg/g时金耳多糖得率最高(图3)。当复合酶添加量少于20 mg/g时,金耳多糖得率随复合酶添加量增大而增大,但复合酶添加量多于20 mg/g时,金耳多糖得率基本恒定。分析其原因可能为复合酶添加量较少,金耳细胞壁在一定时间和一定接触面条件下分解不完全,无法促进胞内多糖从细胞中全部释放出来与溶剂直接接触;随着酶浓度的增加,相同时间内底物与酶充分作用,使反应速度加快,金耳多糖的得率从而迅速增加;而随着酶浓度的继续加大,酶开始处于饱和状态,底物已经最大限度的与酶结合,导致酶的利用率降低,金耳多糖的得率不再明显增加[16]。因此选择的最适复合酶添加量为20 mg/g。
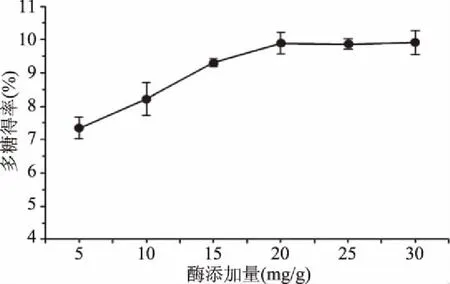
图3 复合酶添加量对金耳多糖得率的影响Fig.3 Effect of enzyme addition on extraction rate of polysaccharide from Tremella aurantialba
2.3.2 提取时间对金耳多糖得率的影响 如图4所示,当提取时间小于50 min时,随着提取时间的延长,金耳多糖的得率迅速增加,当提取时间超过50 min时得率增加趋于平缓,随着提取时间的增长,得率不再升高。分析原因可能是提取时间在50 min之前,随着提取时间的延长金耳多糖可以更充分的溶出,提高金耳多糖的得率,但提取时间超过50 min后无法继续溶出更多的多糖导致金耳多糖的得率不再升高。因此选择最适的提取时间为50 min。
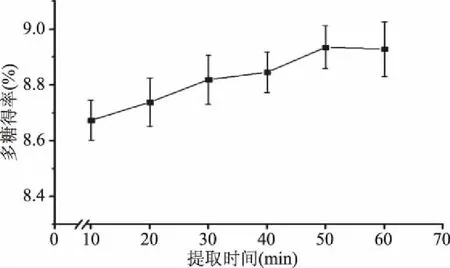
图4 提取时间对金耳多糖得率的影响Fig.4 Effect of extraction time on extraction rate of polysaccharide from Tremella aurantialba
2.3.3 提取温度对金耳多糖得率的影响 如图5所示,在温度为50 ℃时金耳多糖的得率达到最高,可能由于此温度是果胶酶与纤维素酶在提取条件下的最适温度[18]。因此当温度高于或低于50 ℃时均对复合酶产生抑制作用导致金耳多糖的得率降低。因此,选择金耳多糖提取的最佳温度为50 ℃。
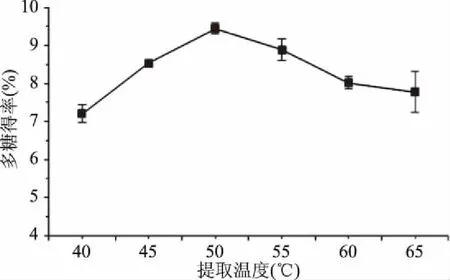
图5 提取温度对金耳多糖得率的影响Fig.5 Effect of extraction temperature on extraction rate of polysaccharide from Tremella aurantialba
2.3.4 提取液料比对金耳多糖得率的影响 如图6所示,在液料比为100∶1~300∶1 (mL/g)时多糖得率上升随着液体体积的增加而明显增加,在液料比为300∶1 (mL/g)时多糖得率达到最高,当液料比继续增加时,多糖得率变化并不明显。分析原因可能是当液体比较少时,不利于多糖的溶出,使得得率较低,而当液体体积过大时,酶浓度降低导致酶的作用下降,且多糖成分已溶出充分,因此得率会趋于恒定甚至下降[16]。因此选取最适液料比300∶1 (mL/g)。
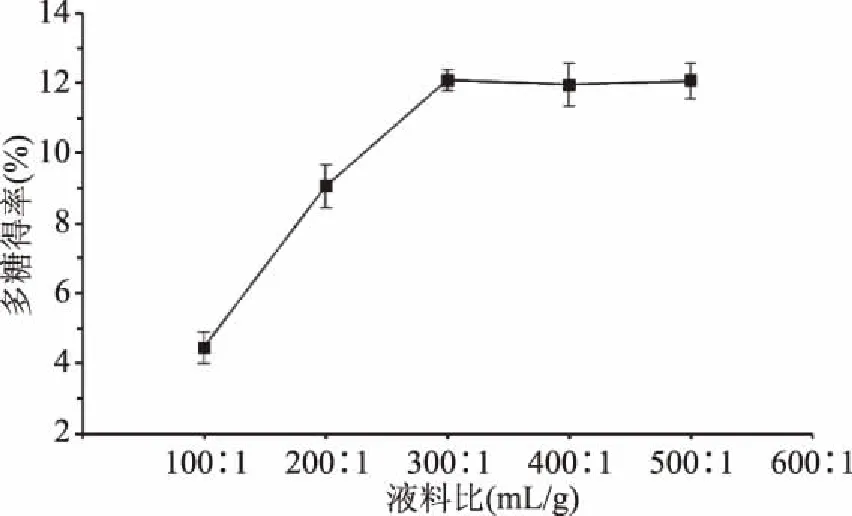
图6 液料比对金耳多糖得率的影响Fig.6 Effect of solid-liquid ratio on extraction rate of polysaccharide from Tremella aurantialba
2.3.5 粒径对金耳多糖得率的影响 如图7所示,随着粒径的减小,多糖的得率逐步提高,在120目时达到最大值,120目多糖得率较40目仅提高1.38%,即粒径对得率的影响不明显。综合考虑,后续响应面实验不以粒径为自变量进行实验设计。
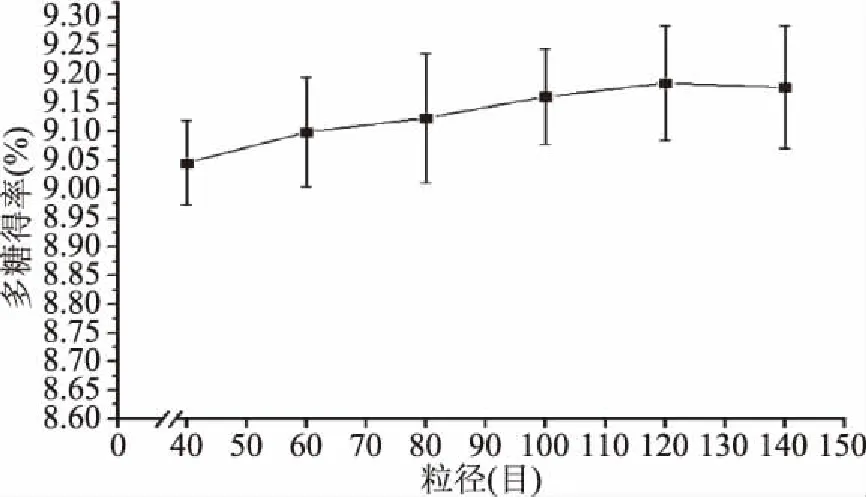
图7 粒径对金耳多糖得率的影响Fig.7 Effect of grain size on extraction rate of polysaccharide from Tremella aurantialba
2.4 响应面试验结果及数据分析
2.4.1 响应面实验设计方案及结果 根据单因素实验结果,由Design Expert 8.0.5统计分析软件设计出的实验方案及实验结果如表2所示,以金耳多糖的得率为响应值,以液料比(A)、提取时间(B)、提取温度(C)、复合酶的添加量(D)为自变量,建立四因素三水平中心组合实验设计共计包括29个实验方案,其中24个析因实验点,5个中心实验点,用以计算实验误差。

表2 Box-Benhnken响应面试验结果Table 2 Results of Box-Benhnken experiment
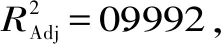
由表3可知,模型项极显著(p<0.0001),失拟项不显著,表明该方程对试验拟合情况好,试验误差小。回归方程较好地描述了各因素与响应值之间的真实关系。因此,可以用该回归方程代替试验真实点对试验结果进行分析。
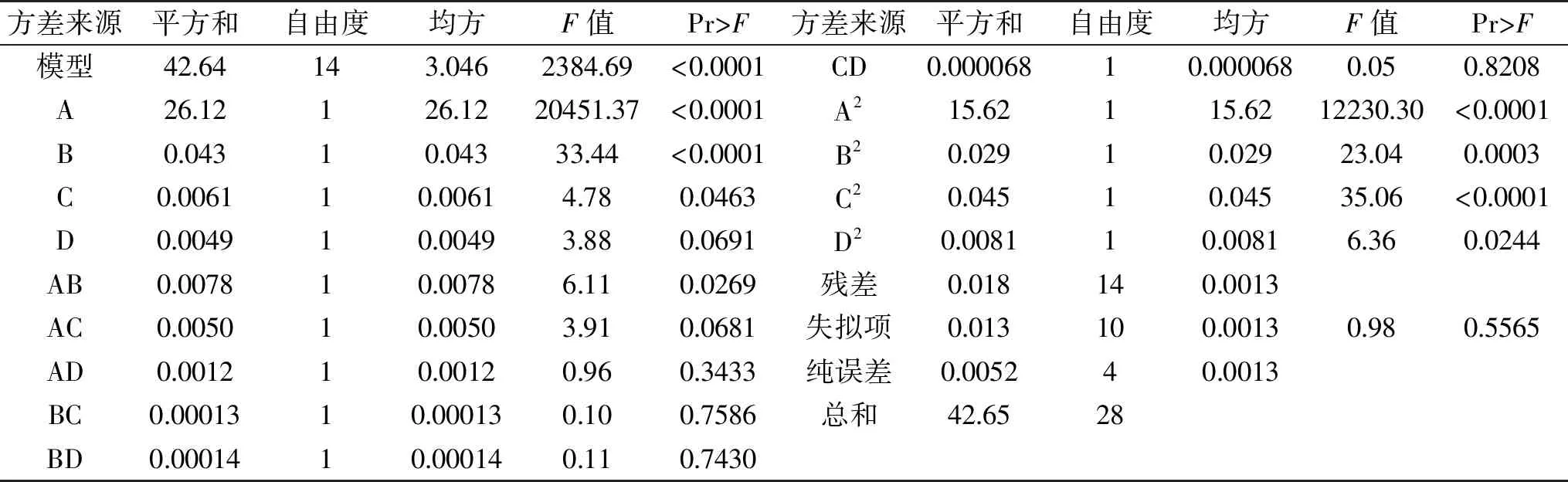
表3 回归方程方差分析Table 3 Analysis of variance of regression model
结果表明,液料比(A)、提取时间(B)、液料比二次项(A2)、提取时间二次项(B2)、提取温度二次项(C2)对响应值影响极显著(p<0.01),提取温度(C)、液料比提取时间(AB)、复合酶的添加量二次方(D2)对响应值影响显著(p<0.05);各因素对响应值显著性的排序为A>B>C>D。由该回归方程确定出最佳提取工艺条件为:液料比为347.38∶1 (mL/g),提取时间为52.71 min,提取温度为52.32 ℃,复合酶添加量为20.79 mg/g,此时金耳多糖得率理论值12.78%。
2.4.3 响应面图分析 根据软件Design-Expert获得响应值的3D曲面,分析各因素对金耳多糖得率的影响及各因素间的交互作用,当固定液料比、提取时间、提取温度、复合酶的添加量中任意两个因素为零水平时,其余两个因素间的交互作用对多糖得率的影响。如图8,多糖得率随其中任意两个变量的增加均呈上升趋势,
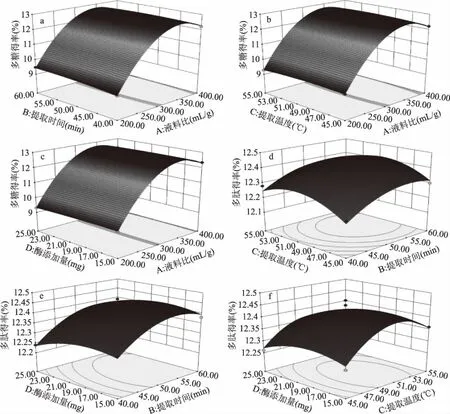
图8 各因素的交互作用对多糖得率的响应面图Fig.8 Response surface plots of variable parameters on the yield of polysaccharides from Tremella aurantialba
达到一定值时,曲面稍下降或趋于平缓。由图8a、图8b、图8d可以看出液料比相对于浸提时间、提取温度而言复合酶添加量对多糖得率的影响较大,与方差分析结果相符。
2.4.4 验证试验 由回归方程确定出最佳提取工艺条件为:液料比为347.38∶1 (mL/g),提取时间为52.71 min,提取温度为52.32 ℃,复合酶添加量为20.79 mg/g,此时金耳多糖得率理论值12.78%。为方便试验的实际操作,将最佳提取条件调整为液料比为347∶1 (mL/g),提取时间52 min,提取温度为52 ℃,复合酶添加量为20.50 mg/g,进行3次平行验证试验,在此条件下金耳多糖的得率平均值为12.69%±0.52%。验证试验结果表明,经过相应面回归方程拟合出的理论值与实际值相吻合,验证了方程的可靠性。
3 结论
本试验采用酶法辅助提取技术提取金耳中的多糖,以液料比、提取时间、提取温度、复合酶添加量为单因素,以金耳多糖得率为响应值,采用Box-Behnken中心组合设计响应面试验设计,得到酶法辅助提取金耳多糖的最佳工艺条件为液料比为347∶1 (mL/g),提取时间52 min,提取温度为52 ℃,复合酶添加量为20.50 mg/g,在此条件下金耳多糖的得率为12.69%±0.52%。
通过研究可知,酶辅助法提取[9]较水提取法、超声波提取法、微波提取法有较大的优势,提取温度较低,提取时间短,且得率较高,节能环保、可减少高温及超声对活性成分的影响[10-15]。故该方法为金耳多糖的一种较理想的提取方法,研究结果可为金耳多糖的提取及开发研究提供依据,具有一定的实际应用前景。

