茶粕多糖纯化及其理化特性、抗氧化和抑菌活性
,,, ,*
(1.浙江工业大学食品科学与工程系,浙江杭州 310014; 2.中国林业科学院亚热带林业研究所,浙江杭州 311400)
山茶籽经过冷榨、超临界CO2或溶剂浸提等技术提取油脂后,剩下的部分即为山茶籽粕。山茶籽除了能够提取山茶籽油以外,剩下的山茶籽粕还含有许多的生物活性物质,如茶多糖、茶皂素、蛋白质、生物碱、茶多酚等。而茶多糖作为茶叶、茶籽、茶花等茶作物及其相关产物中的一种重要化合物,具有显著降低血糖、提高免疫活性、抗肿瘤和抗氧化等功效[1]。现阶段茶多糖加工制备常采用凝胶柱层析法和纤维素阴离子交换柱层析法[2]。Wei等[3]用水提法提取了茶籽多糖,通过分离纯化得到了三种不同的组分,研究了其化学组成、分子量和生物活性,在研究中发现,茶籽多糖能够有效地抑制K562癌细胞的生长,同时还能促进小鼠脾淋巴细胞的增殖。郭红艳[4]通过水提法从饼粕中获得茶叶籽多糖,发现在浓度达到5 mL/mol时,其具有良好的α-葡萄糖苷酶抑制活性,最高抑制率达82.28%,比茶叶、茶花中提取的多糖抑制效果高很多。国内外对茶多糖的研究较多,但是主要集中于多糖的提取和单糖组成分析,鲜见关于茶多糖的抗氧化性和生物活性的研究。
茶粕多糖(Tea seed cake polysaccharide,TSCP)作为一种重要的提取物和活性多糖,具有极高的研究和应用价值。而茶粕多糖的功能活性与其组成、结构、构象等因素有关,因此对其进行分离并对其结构和活性进行研究,对于茶粕多糖的开发利用具有指导意义。本研究对热水浸提的茶粕多糖进行进一步的分离纯化,并且对比研究了粗多糖和纯化组分的化学组成、初步结构、抗氧化性及抑菌性,为其进一步的开发利用提供了重要的参考依据。
1 材料与方法
1.1 材料与仪器
脱脂山茶籽粕 浙江刘家香食品有限公司;甲醇、乙醇、苯酚、浓硫酸、30% H2O2、3,5-二硝基水杨酸、葡萄糖、正丁醇、三氯甲烷、过硫酸钾、醋酐、硼氢化钠、冰乙酸、溴化钾、氯化钠、牛肉膏、蛋白胨、琼脂均为分析纯,DPPH、ABTS、D-葡萄糖醛酸(≥98%)、三氟乙酸 阿拉丁试剂(上海)有限公司;考马斯亮蓝 上海绿鸟科技发展有限公司;邻二氮菲 天津市福晨化学试剂厂;牛血清白蛋白(≥96%) 上海伯奥生物科技有限公司;透析袋(500 Da),间羟基联苯(85%),D-葡萄糖、L-鼠李糖、L-阿拉伯糖等6种单糖标准品(≥99%) 美国Sigma公司;大肠埃希氏菌CICC 10.389、金黄色葡萄球菌CICC 21600、枯草芽孢杆菌CICC 10275 中国微生物菌种保藏管理中心。
QT-80FC-LCD型智能自动部份收集器 上海琪特分析仪器有限公司;XK 26 mm×100 cm DEAE Sepharose Fast Flow离子交换柱 美国GE公司;Sephadex-G25 Amersham Pharmacia Biotech;Nicolet 6700型FTIR红外光谱仪 美国Thermo Nicolet公司;Trace1300/ISQ型气质联用仪 美国Thermo Scientific公司;TU-1900型紫外可见分光光度计 北京普析通用仪器有限公司;ALPHA 2-4LD型真空冷冻干燥机 德国Marin Christ公司;PHS-3C型酸度计 杭州奥立龙仪器有限公司;YXQ-LS-SⅡ型高压灭菌锅 上海博讯实业有限公司医疗设备;SW-CJ-1FD型洁净工作台 苏净集团苏州安泰空气技术有限;DHP9082型恒温培养箱 上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 茶粕多糖的提取 通过预试验得到最佳提取条件:称取1 kg的脱脂山茶籽粕,于100 ℃水浴中提取3 h,所得残渣提取2 h,合并多糖提取液。提取液经过滤离心后,用80%乙醇醇沉过夜,将所得沉淀溶于蒸馏水中,用Sevag试剂(正丁醇∶氯仿=1∶4)脱除其中的蛋白质。重复5次后,低压蒸发除去残留溶剂,用大孔树脂脱色两次,浓缩溶液。将浓缩液用80%乙醇醇沉,所得沉淀经冷冻干燥(-70 ℃,0.133 Pa,3 d)获得茶粕多糖粗品(TSCP)。
1.2.2 茶粕多糖的初步纯化 通过预试验得到最佳纯化条件:称取一定量茶粕多糖粗品,溶于蒸馏水中配制成10 mg/mL,8000 r/min离心15 min,取上清液,经0.45 μm膜过滤,在DEAE-Sepharose Fast Flow离子柱上进行上样,通过自动部分收集器收集洗脱液。洗脱参数为:上样量5 mL,每管收集时间3 min,10 mL/管,洗脱液体积为2倍柱体积,收集100管。洗脱液为蒸馏水和不同浓度的NaCl溶液。采用苯酚硫酸法[5]跟踪检测每两管洗脱液A490 nm,以溶液吸光值和NaCl浓度为纵坐标,试管数为横坐标,绘制洗脱曲线。收集洗脱液中的主要成分,50 ℃浓缩至约30 mL,然后真空冷冻干燥(-70 ℃,0.133 Pa,3 d)后获得初步纯化的多糖组分。
1.2.3 脱盐
1.2.3.1 透析袋脱盐 取500 Da的透析袋,加入100 mL 10 mg/mL多糖溶液,置于蒸馏水中并不断搅拌。每次搅拌2 h,重复若干次,直至加入2% AgNO3后无明显浑浊。合并几次透析后的溶液并适当浓缩,以便进行下一步的凝胶柱脱盐。
1.2.3.2 G-25凝胶柱脱盐 取5 mL初步脱盐的多糖溶液,进行Sephadex-G25葡聚糖凝胶柱上样。用蒸馏水洗脱并收集,每管收集3 min,体积10 mL。用2% AgNO3溶液进行判断溶液中是否含盐,并分别收集洗脱液中的含糖无盐部分和含糖有盐部分,并将后者浓缩后重新上样。合并所得含糖无盐部分,50 ℃浓缩至约30 mL,然后真空冷冻干燥,获得最终试验样品。
1.2.4 组成成分测定 总糖含量测定:参照王联珠等[6]的方法;还原糖含量测定:参照赵凯等[7]的方法;糖醛酸含量测定:参照李波等[8]的方法;蛋白质含量测定:参照黄婉玉等[9]的方法;硫酸根含量测定:参照Dodgson等[10]的方法。
1.2.5 单糖组成分析 多糖水解[11]:取5 mg多糖样品于梨形瓶中,加入2 mol/L三氟乙酸(TFA)5 mL,置于120 ℃烘箱中水解2 h,冷却,40 ℃下减压旋干,加入5 mL甲醇溶液,重复4~5次以充分除去残留的TFA。所得样品按下述单糖标准品还原、乙酰化方法进行后续处理。
单糖标准品还原、乙酰化:准确称取3~5 mg的D-葡萄糖、D-半乳糖、D-甘露糖、L-鼠李糖、L-阿拉伯糖和L-岩藻糖,溶于5 mL蒸馏水中,加入20~30 mg硼氢化钠(NaBH4),于室温下间歇振荡3 h。反应结束后,加入冰醋酸中和过量的NaBH4,直至无起泡产生。加入甲醇5 mL,减压浓缩,重复4~5次。次日,将反应产物置于110 ℃烘箱中干燥20 min,除去残留溶剂。加入4 mL醋酐,于100 ℃烘箱中反应2 h,冷却后加入3~5 mL甲醇减压浓缩,并重复4~5次。加入10 mL氯仿溶解乙酰化产物,并加入少量蒸馏水振荡。静置5 min,吸去上层水溶液,再加入蒸馏水重复多次,直至氯仿层溶液变得澄清透明。加入过量无水硫酸钠,振荡,溶液过0.45 μm有机膜,GC-MS上样分析。
GC-MS分析条件:柱温60 ℃,初始温度120 ℃,保持1 min,以5 ℃/min升温至240 ℃,保持10 min。传输线温度250 ℃,离子源EI温度280 ℃,分流比30∶1。质谱扫描范围40~500 amu,间隔时间0.2 s。以高纯氮气作载气,溶剂延迟3 min。
1.2.6 红外分析 参照徐金楠等[12]的方法。取3 mg左右的多糖样品,采用KBr压制成片后进行红外光谱分析,光谱扫描范围为4000~400 cm-1。
1.2.7 抗氧化性评价
1.2.7.1 DPPH自由基清除率测定 参照Wu等[13]的方法,取2.5 mL多糖溶液和0.5 mL 430 μmol/L DPPH无水乙醇溶液混合均匀,2500 r/min下离心5 min,在25 ℃下于暗处避光反应,60 min(含离心时间)后,于517 nm处测定其吸光值。
DPPH自由基清除率=(Asample-Acontrol)/(Ab-Acontrol)
式中:Asample:加入样品反应液吸光值,Acontrol:不含样品反应液吸光值,Ab:含样品但不含DPPH自由基反应液吸光值。
1.2.7.2 ABTS自由基清除率测定 参照Luo等[14]的方法,取等体积的7 mmol/L ABTS自由基和2.45 mmol/L过硫酸钾溶液,25 ℃条件下避光反应16 h,用磷酸缓冲溶液(pH=7.4)将其稀释至OD=0.70±0.02(734 nm),作为ABTS+·工作液。
取0.4 mL样品溶液和3 mL ABTS+·工作液混合均匀,在25 ℃下,避光反应10 min后,于732 nm处测定其吸光值。
ABTS自由基清除率=(Asample-Acontrol)/(Ab-Acontrol)
式中:Asample:加入样品反应液吸光值,Acontrol:不含样品反应液吸光值,Ab:含样品但不含ABTS自由基反应液吸光值。
1.2.7.3 ·OH自由基清除率测定 参照Jin等[15]的方法,将19 mL 0.2 mol/L NaH2PO4与81 mL 0.2 mol/L Na2HPO4混合均匀,配制0.2 mol/L pH7.4磷酸盐缓冲液(PBS)。向20 mL试管中依次加入0.6 mL 5 mmol/L邻二氮菲、0.4 mL 0.2 mol/L PBS、0.6 mL 5 mmol/L FeSO4和1.5 mL样品溶液,混合均匀后,加入0.5 mL 0.1% H2O2振荡,随即置于37 ℃水浴中60 min,于536 nm处测定,吸光值为Asample。
·OH自由基清除率=(Asample-Acontrol)/(Ab-Acontrol)
式中:Asample:加入样品反应液吸光值,Acontrol:不含样品反应液吸光值,Ab:含样品但不含·OH自由基反应液吸光值。
1.2.8 抑菌活性研究 培养基选用牛肉膏蛋白胨琼脂培养基。
菌种活化:将大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌3种菌种接种至斜面培养基,于37 ℃恒温培养箱中活化24 h。
抑菌试验:将菌种稀释于无菌水中制备成菌悬液,再将灭菌后的牛肉膏蛋白胨琼脂培养基倒入培养基,凝固后取1 mL菌悬液倒入培养皿中,并用涂布棒涂抹均匀。用镊子将浸泡过无菌水和茶粕多糖溶液(10 mg/mL)的滤纸片(直径6 mm),轻放在培养基表面,左右各一片。将培养皿置于37 ℃恒温箱中培养,24 h后观察抑菌效果。
1.3 数据处理
采用Origin 8.5工具进行图表的绘制。
2 结果与分析
2.1 多糖的洗脱曲线
在DEAE-Sepharose离子柱上用不同浓度的NaCl溶液洗脱茶粕多糖,洗脱结果如图1所示。从图1中可以看出,洗脱曲线上有三个明显的洗脱峰,分别是用蒸馏水、0.1 mol/L NaCl和0.5 mol/L NaCl溶液洗脱所得。其中,用蒸馏水和0.1 mol/L NaCl洗脱液得到的多糖含量较高,而0.5 mol/L NaCl洗脱得到的多糖含量较低,因此收集前两种洗脱液洗脱得到的多糖组分,经过脱盐和冷冻干燥之后,得到TSCP-1和TSCP-2两种多糖组分。
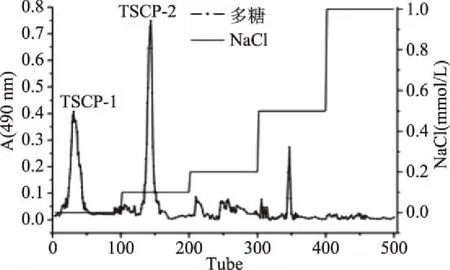
图1 TSCP DEAE-Sepharose洗脱曲线Fig.1 The elution curve of DEAE-Sepharose column for TSCP
2.2 组成分析
从表1中可以看出,TSCP、TSCP-1和TSCP-2的总糖含量分别为72.25%、84.75%和88.75%。经离子柱分离纯化后,TSCP-1和TSCP-2中的蛋白质含量分别为0.013和0.25%,而未经过柱子的TSCP中蛋白质含量为4.06%,说明DEAE-Sepharose离子柱可以有效地除去茶粕多糖中的蛋白质组分。此外,在纯化过程中糖醛酸的含量也降低了50%左右。而且三种多糖组分中均含有一定量的硫酸根,这表明三种多糖均为硫酸多糖。在王黎明[16]的研究中也发现茶多糖结构中含有硫酸根。
通过GC-MS分析三种多糖组分,对照标准品图谱(图2),确定了三种单糖成分的组成,结果如表1所示。从表1中可以看出,茶粕多糖主要由葡萄糖(92.59%)组成,其次为阿拉伯糖(4.47%)和半乳糖(2.94%),还含有微量鼠李糖和甘露糖(表中未列出),而岩藻糖则未检出。经过离子柱后的两种多糖组分,几乎全部由葡萄糖组成,含量均超过99%,而阿拉伯糖和半乳糖的含量则明显下降,分别减少至0.20%和0.40%。
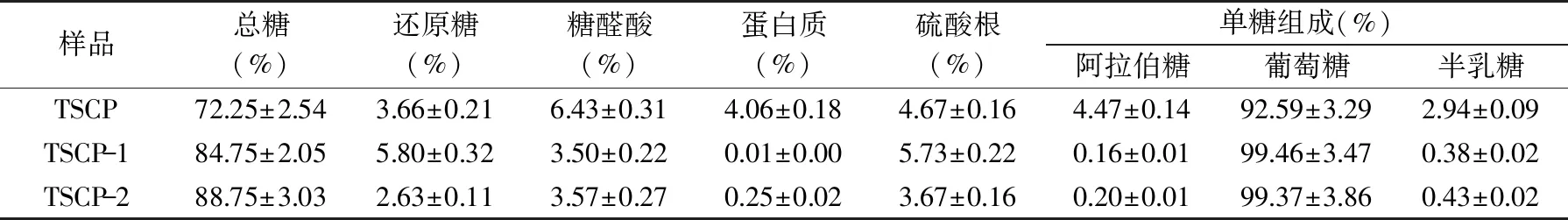
表1 三种多糖组分的化学组成Table 1 Chemical composition of three polysaccharide components
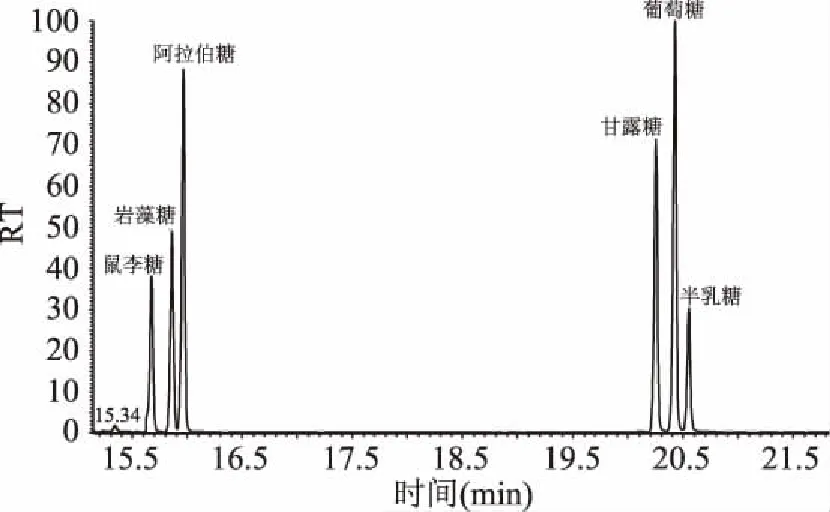
图2 六种不同单糖标准品的GC-MS图谱Fig.2 The GC-MS chromatograms of 6 standard monosaccharides
2.3 红外分析
图3为三种多糖组分的红外光谱图,从图3中可以看出3个多糖组分具有相似的吸收峰。其中,3395 cm-1处的强宽峰为羟基基团[17],在2929 cm-1的吸收峰较弱,为C-H伸缩振动峰,1418 cm-1处的吸收峰更是进一步证实了C-H伸缩振动的存在[18]。1650 cm-1处出现一个明显的峰,为羟基的变形振动峰,而1369 cm-1的峰可能对应着CH3的对称变形振动。三种多糖组分差异性在于,TSCP在1240 cm-1处出现一个明显的峰,而另外两种多糖组分则在850 cm-1处出现一个吸收峰,两个吸收峰分别对应着硫酸酯中S-O基团的伸缩振动和轴向位置硫酸酯中C-O-S的弯曲振动(也可能为α-糖苷键的振动),这也证实了茶粕多糖为硫酸根多糖。此外,多个吸收峰在1000~1200 cm-1范围内出现,表明C-O-C和C-O-H键的存在[19];其中,1080 cm-1左右处的吸收峰为呋喃糖苷的特征吸收峰[20]。
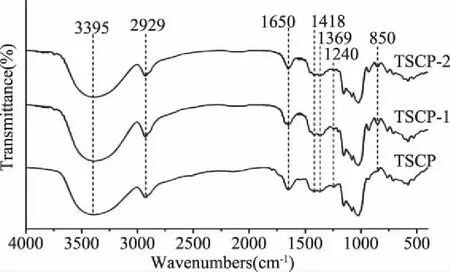
图3 三种多糖组分的红外光谱图Fig.3 FT-IR spectra of the three polysaccharide components
2.4 抗氧化性分析
2.4.1 DPPH自由基清除能力 DPPH·是一种稳定的有机自由基,能够接受抗氧化剂提供的电子或质子形成稳定的化合物[21]。三种多糖组分对DPPH自由基清除能力如图4所示。从图4中可以看出,DPPH·的清除率随着多糖浓度的增加而增加。三种多糖组分在浓度低于0.5 mg/mL时,对DPPH·的清除效果较差,不到10%。当浓度超过1.0 mg/mL时,TSCP对DPPH·的清除率迅速上升,并在最大浓度10.0 mg/mL时达到59.15%。而TSCP-1和TSCP-2对DPPH·的清除能力则较弱,清除率均只有20%左右,远远低于TSCP的清除能力。茶粕多糖经离子柱纯化后,对DPPH·的清除能力明显下降,主要原因是TSCP中糖醛酸和蛋白质含量较高,而糖醛酸含有丰富的羧基和羟基,能够给DPPH·提供质子,从而清除DPPH自由基[22]。Wang等[23]的研究表明DPPH·清除能力与糖醛酸和蛋白质的含量有着密切联系。
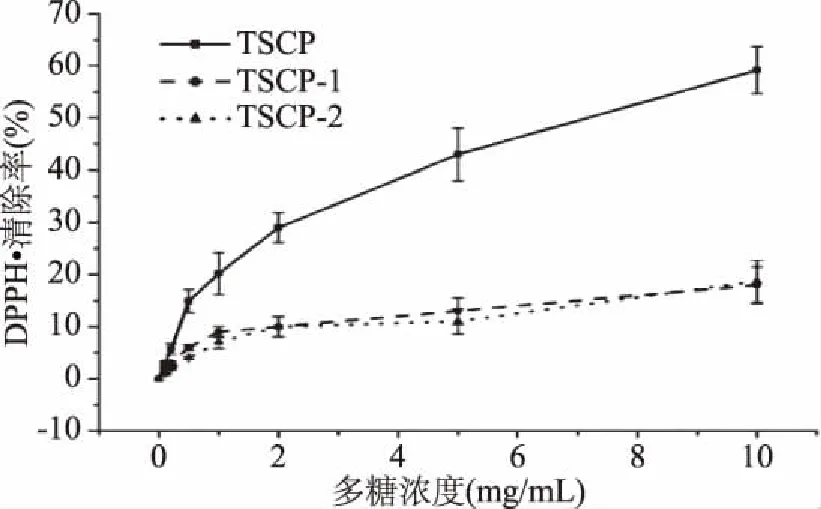
图4 三种多糖组分对DPPH·自由基的清除能力Fig.4 Scavenging ability of DPPH free radicals by three polysaccharide components
2.4.2 ABTS自由基清除能力 三种多糖组分对ABTS+·的清除能力如图5所示,其结果与DPPH·清除能力类似,TSCP具有最佳的ABTS+·清除效果。在0~10 mg/mL范围内,ABTS+·清除率随多糖含量的增加而增加,并在10 mg/mL浓度时达到45.23%,明显要低于DPPH·清除率。而在多糖浓度高于2.0 mg/mL,TSCP-2的清除效率要高于TSCP-1。因此,三者对ABTS+·的清除能力为TSCP>TSCP-2>TSCP-1。这与三者中蛋白质含量一致,表明蛋白质含量与ABTS+·的清除率有着密切的联系。
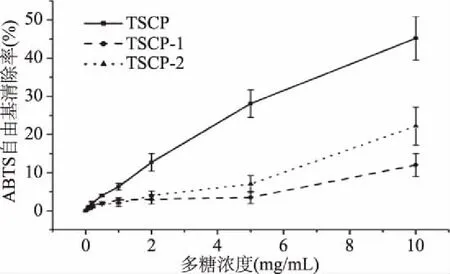
图5 三种多糖组分对ABTS自由基的清除能力Fig.5 Scavenging test of ABTS free radicals by three polysaccharide components
2.4.3 ·OH自由基清除能力 三种多糖组分对·OH清除能力见图6,从图6中可以看出,在0.5~10 mol/L范围内,TSCP和TSCP-1对·OH的清除率随着多糖浓度的增加而迅速增强,并同时在10 mg/mL时,对·OH的清除率达到50%。随着TSCP-2浓度的提升,对·OH的清除率趋于平缓,而且TSCP-2对·OH的清除率较前两者明显降低,只有10%左右。TSCP和TSCP-1对于·OH的清除率要远高于TSCP-2,这可能是由于TSCP-2中硫酸根含量较少,只有3.67%,而TSCP和TSCP-1中硫酸根含量分别为4.67%和5.63%。有研究[24]表明,硫酸根多糖在体外具有很强的·OH清除能力,是因为硫酸根能与金属离子发生螯合反应,从而抑制了·OH的生成。
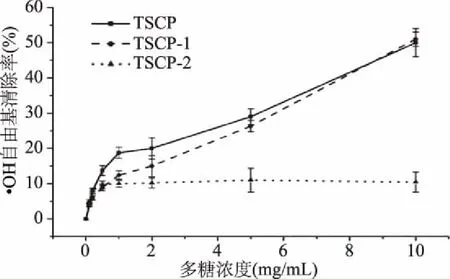
图6 三种多糖组分对·OH自由基的清除能力Fig.6 Scavenging test of ·OH free radicals by three polysaccharide components
综上可知,三种多糖组分对不同自由基表现出差异性的清除效果,可以初步判断,其抗氧化能力依次为TSCP、TSCP-1和TSCP-2。茶粕多糖对DPPH·和ABTS+·的清除效果与糖醛酸和蛋白质含量密切相关,而·OH清除效果则与多糖中硫酸根含量密切相关。除此之外,其化学组成[25]、分子量、结构及存在的抗氧化物质也是抗氧化性能主要的影响因素[26]。
2.5 抑菌活性分析
本文对多糖抑菌活性进行了探究,结果如表2所示。从表中可以看出,TSCP对大肠杆菌(E.coli)、金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(B.subtilis)的抑菌效果最差,TSCP-1和TSCP-2对3种菌种的抑制效果则较为明显。其中,TSCP对大肠杆菌和枯草芽孢杆菌表现出比较微弱的抑制作用,而对金黄色葡萄球菌没有抑制作用。而TSCP-1和TSCP-2对3种菌种的抑制效果相似,都对E.coli和S.aureus具有较好的抑制效果,而对B.subtilis的抑制效果一般,而且TSCP-2和TSCP-1都比TSCP抑菌效果好。这表明经过纯化的多糖组分具有更好的抑菌效果,这与王晶晶等[27]的研究结论类似:经纯化后的多糖组分相比粗多糖具有更好的抑菌活性。然而,目前对茶粕多糖抑菌机理的研究报道较少,这将是今后潜在的研究方向。

表2 三种多糖组分的抑菌效果Table 2 Antibacterial activities of 3 different TSCP fractions
3 结论
热水浸提茶粕多糖TSCP经DEAE-Sepharose离子柱分离纯化后,得到两种主要的多糖组分TSCP-1和TSCP-2。结果表明此多糖为硫酸根多糖,且主要单糖组成为葡萄糖。纯化后的组分TSCP-1和TSCP-2对大肠杆菌和金黄色葡萄球菌具有较好的抑制效果,而对枯草芽孢杆菌效果较差。茶粕多糖粗品对DPPH自由基清除率、ABTS自由基清除率和·OH自由基清除率均优于纯化组分,且清除率随多糖浓度升高而增大,并于10 mg/mL达到最大清除率,分别为59.15%、45.23%和50%。这表明茶粕多糖具有良好的自由基清除效果,并且具有一定的抑菌效果。这为进一步探讨茶粕多糖功能活性奠定了基础,同时也为茶粕多糖的精深加工及高值化利用提供了一定的理论依据。

