低氮胁迫对蛋白核小球藻生化组分和絮凝性能的影响
赵 艳,汪 成
(浙江工商大学食品与生物工程学院,浙江杭州 310018)
以小球藻为代表的微藻是一类能进行光合自养生长的单细胞绿藻,易于培养且生长迅速,富含蛋白、油脂、维生素、矿物质及多种生理活性成分,在医药、食品、饲料和生物柴油新能源方面的应用潜力巨大[1-2]。2011年,我国“神舟8号”搭载小球藻上天进行生态循环科学实验,发现小球藻能提供氧气,并作为食物来源确保宇航员在空间站的全面营养,而且还可能对很多医学难题提供重要的解决方案[3]。特别是蛋白核小球藻 (Chlorella pyrenoidosa)具有蛋白含量高,富含各种必需氨基酸和多种营养保健因子,2012年被我国增列为新资源食品[4],其研究开发很快成为热点。微藻的大规模培养是实现工业化生产的前提。人工培养技术中比基因工程或代谢工程手段更简单有效的策略是通过改变培养基或培养条件影响藻细胞代谢途径,以达到提高油脂、多糖等目标化合物生产率的目的[5]。氮是蛋白质、核酸、磷脂和叶绿素等物质合成的基本元素,在新陈代谢中至关重要。研究表明,降低培养基中的氮素供应使藻细胞处于低氮胁迫状态能影响藻细胞光合效率、生物量与生化组分合成[6]。低氮胁迫作为提高微藻生产效益的低成本技术,增效作用在不同藻种之间差异很大[7],这是因为藻种不同细胞氮代谢途径和整体代谢网络模式不同,对低氮胁迫信号的响应机制也不一致。只有针对不同藻种研究低氮胁迫的适宜水平和收获时间等因素才能使收益最大化。代瑞华等[8]报道适宜的低氮胁迫处理会促进铜绿微囊藻细胞分裂,缩短生长周期。吴桂秀等[9]发现低氮胁迫有利于大真眼点藻和波氏真眼点藻的总脂和中性脂的积累。Adams等[6]研究了低氮胁迫对6种微藻生长与油脂累积的影响,发现普通小球藻经4 mmol/L低氮胁迫培养12天后,其生物量比对照减少了51%,但藻细胞油脂含量增加了302%。Gong等[10]研究了低氮胁迫对4株海洋微藻油脂含量的影响,发现培养5天后角毛藻、三角褐指藻和绿色巴夫藻细胞内总脂肪酸含量已增加了一倍,眼点拟微绿球藻总脂肪酸含量却增长不明显。此外,微藻作为一个代谢整体,在氮胁迫下生长和生化组分的合成变化密切相关。如球等鞭金藻 (Isochrysis galbana) 当细胞内源型储存氮达到最低阈值时,藻细胞生长缓慢同时细胞内的脂质和类胡萝卜素开始大量积累[11]。微拟球藻在氮源不足时,细胞蛋白与氨基酸含量显著下降,碳代谢流向碳水化合物或者脂质从而提高糖类或油脂积累量[12]。莱茵衣藻在低氮胁迫条件下,淀粉含量和油脂合成之间存在着竞争关系[13]。国内外对低氮胁迫下微藻的代谢研究鲜见涉及蛋白核小球藻藻种,报道多集中于微藻生长和胞内生化组分方面,尚缺乏自养和葡萄糖兼养营养方式来源的藻细胞对低氮胁迫响应的系统比较,而且对胞外聚合物质 (extracellular polymeric substances,EPS) 研究极少。葡萄糖不仅是细胞的主要能量来源,还可以作为信号触发特定的信号转导通路控制细胞代谢状态[14],葡萄糖兼养藻细胞对低氮胁迫处理的生化反应是否与自养藻细胞存在差异值得探究。微藻EPS主要为多糖、蛋白质等代谢产物,积累在细胞表面,通过稳定的膜结构来保护细胞,与藻细胞絮凝性能密切相关,并且在营养缺失时能为细胞提供碳与能量供应[15]。由此推测培养条件的改变可能通过影响EPS组成进而影响细胞絮凝收获性能。由于微藻细胞尺寸小,当前普遍采用的离心沉降等物理收获方法成本约占微藻生产总成本的三分之一,严重限制了其生产应用[16],因此研究低氮胁迫对藻细胞EPS组分及絮凝性能的影响具有重要现实意义。系统比较研究自养和兼养来源的蛋白核小球藻在生长速率、油脂含量、胞内外蛋白和淀粉等生化组分对低氮胁迫处理的响应差异,从EPS组分变化角度初步探究低氮胁迫处理对藻细胞絮凝性能的影响和相关机制,为蛋白核小球藻的人工培养技术优化提供科学依据。
1 材料和方法
1.1 供试材料
蛋白核小球藻藻种购自中国科学院武汉水生生物研究所,藻种编号为FACHB-1222。
1.2 主要仪器与试剂来源
电热鼓风干燥箱101-3购自上海申光制造仪器公司;智能人工气候箱safe PRX-600B购自宁波赛福实验仪器有限公司;台式冷冻恒温振荡器THZ-C-1购自苏州培英实验设备有限公司;电热恒温水浴锅XMTD-8222购自上海精宏实验设备有限公司;台式高速离心机H1650购自湘仪仪器有限公司;超速冷冻离心机Centrifuge 5417R购自北京伯乐有限公司;显微镜BM1000购自江南永新;荧光光度计HitachiF-7000型购自日立高新技术公司。葡萄糖、NaNO3等生化试剂购自上海生工公司。
1.3 试验方法
1.3.1 小球藻的培养和生长指标测定 以BG11培养基[17]为基础培养基,挑取单藻落纯化后接入BG11培养至对数期作为种子细胞,分别接入BG11自养培养基和添加10 g/L葡萄糖的BG11兼养培养基,接种初始浓度均为2 × 106cell/mL。待培养至稳定期,收获藻细胞接种到低氮培养基,藻细胞接种后初始浓度均为1 × 107cell/mL。培养条件为25℃,光强2000 Lux,光周期中光暗比L∶D为12 h∶12 h,每天早晚各摇动一次。每组设置3个平行,自养和兼养来源藻细胞的培养周期均为5 d。BG11基本培养基氮素为18 mmol/L硝酸钠 (1N),作为对照;以添加3种不同初始浓度 (3、6、9 mmol/L氮浓度,即,1/6N、1/3N、1/2N) 的硝酸钠作为低氮胁迫处理培养基。
接种培养后每天取样一次,取样时间为光照10 h后,离心收集适量藻细胞并烘干至恒重,计算干重生物量。
1.3.2 藻细胞油脂提取和含量的测定 采用溶剂提取法和脂染色法对蛋白核小球藻油脂含量进行测定,并建立油脂含量与脂染色后在645 nm吸光度(A) 的线性回归方程,采用脂染色法测定培养过程中的油脂。溶剂提取法操作参考Zhao等[18]的方法,脂染色法具体操作参照任洁等[19]的方法。油脂产率按照如下公式计算:
藻细胞油脂产率[mg/(L·d)] = 收获藻细胞干重(mg/L) × 油脂含量/培养天数 (d)
1.3.3 小球藻胞内蛋白的提取和测定 在PBS缓冲液中冰浴条件下以超声波破碎藻细胞后,用0.1 mol/L的NaOH振荡提取2 h,8000 r/min离心15 min,收集上清,即为总蛋白。采用Bradford法[20]以牛血清白蛋白作标准测定蛋白浓度,换算出每克干重藻细胞总蛋白质含量。总蛋白含量减去藻细胞EPS中蛋白含量即为胞内蛋白含量。
总蛋白含量 (mg/g,藻细胞干重) = 蛋白浓度(mg/mL) × 提取液体积 (mL)/藻细胞干重 (g)
1.3.4 小球藻胞内淀粉的提取和测定 参照徐嫔等[21]的方法,以淀粉标准溶液测定绘制的标准曲线计算样品中淀粉含量。藻细胞总淀粉含量减去胞外聚合物 (EPS) 中淀粉含量即为胞内淀粉含量。
1.3.5 小球藻胞外产物EPS的提取与分析 小球藻EPS的提取与分析参照Yang等[22]的方法。培养结束后,取藻细胞干重相当于0.1 g的微藻悬浮液,8 000 r/min离心10 min,弃上清,用5 mL去离子水洗涤沉淀,8 000 r/min离心5 min,微藻沉淀用5 mL去离子水悬浮并加热至80℃,水浴30 min。随后以8 000 r/min离心10 min,得上清液用0.45 μm醋酸纤维素膜过滤,滤液即EPS组分。按如1.3.4所述测定EPS组分中的胞外蛋白质含量和以淀粉含量表征的胞外多糖含量。
小球藻EPS三维荧光光谱 (3D-EEM) 的测定条件参照Lv等[23]的方法。使用150 W氙弧灯为激发光源,光电倍增管 (PMT) 电压为700 V;设定激发狭缝宽度为10 nm,发射狭缝宽度为1 nm。光谱仪扫描范围为激发波长/发射波长 (EX/EM) = 200~450 nm/250~550 nm,扫描速度为1200 nm/min。得到每个EX/EM所对应的荧光强度 (Intensity,单位为arbitary units,a.u.),对所有数据点采用Origin9.0软件进行处理,形成等高线荧光光谱图。
1.3.6 藻细胞絮凝率测定 参照Alam等[24]的方法并稍作修改。测定时摇动培养液以使藻细胞分散均匀,然后将10 mL细胞悬浮液转移到试管中摇匀并测定藻细胞总浓度A (cell/mL),将培养液静置12 h后,在距离液面顶部4 cm处取细胞悬液试样,测量试样藻细胞浓度B (cell/mL)。絮凝率按照如下公式计算:
絮凝率 (flocculating ability) = (A-B)/A × 100%
1.4 数据处理与统计分析
每个试验处理设3次重复,各指标测定结果以“平均数 ± 标准误”表示,应用SPSS22.0软件对对照和各处理组数据进行方差分析,P< 0.05为差异显著,P< 0.01为差异极显著。采集数据利用Origin 9.0软件进行分析作图。
2 结果与分析
2.1 葡萄糖兼养培养对蛋白核小球藻生长和油脂积累的影响
表1显示,自养与兼养的蛋白核小球藻分别在培养15 d和10 d时生长达到稳定期,此时兼养组的藻细胞干重生物量、油脂含量同比是自养组的1.62~2.82倍,油脂产率达到自养组的7.60倍。可见葡萄糖兼养培养使藻细胞生长周期缩短,产油效益大幅度提升。
2.2 低氮胁迫对不同来源蛋白核小球藻生长和油脂积累的影响
不同浓度低氮胁迫处理,自养和兼养来源的蛋白核小球藻生长和油脂积累如图1所示。自养和兼养来源的蛋白核小球藻均在1/3N培养基中生长最快,4 d后进入稳定期,藻细胞干重分别达到2.56 g/L和4.62 g/L,分别为对照组 (1N) 的1.13倍和1.18倍,差异显著。

表 1 自养与兼养培养对蛋白核小球藻生长和油脂积累的影响Table 1 The effect on growth and lipid accumulation of Chlorella pyrenoidosa of autotrophic and mixotrophic culture
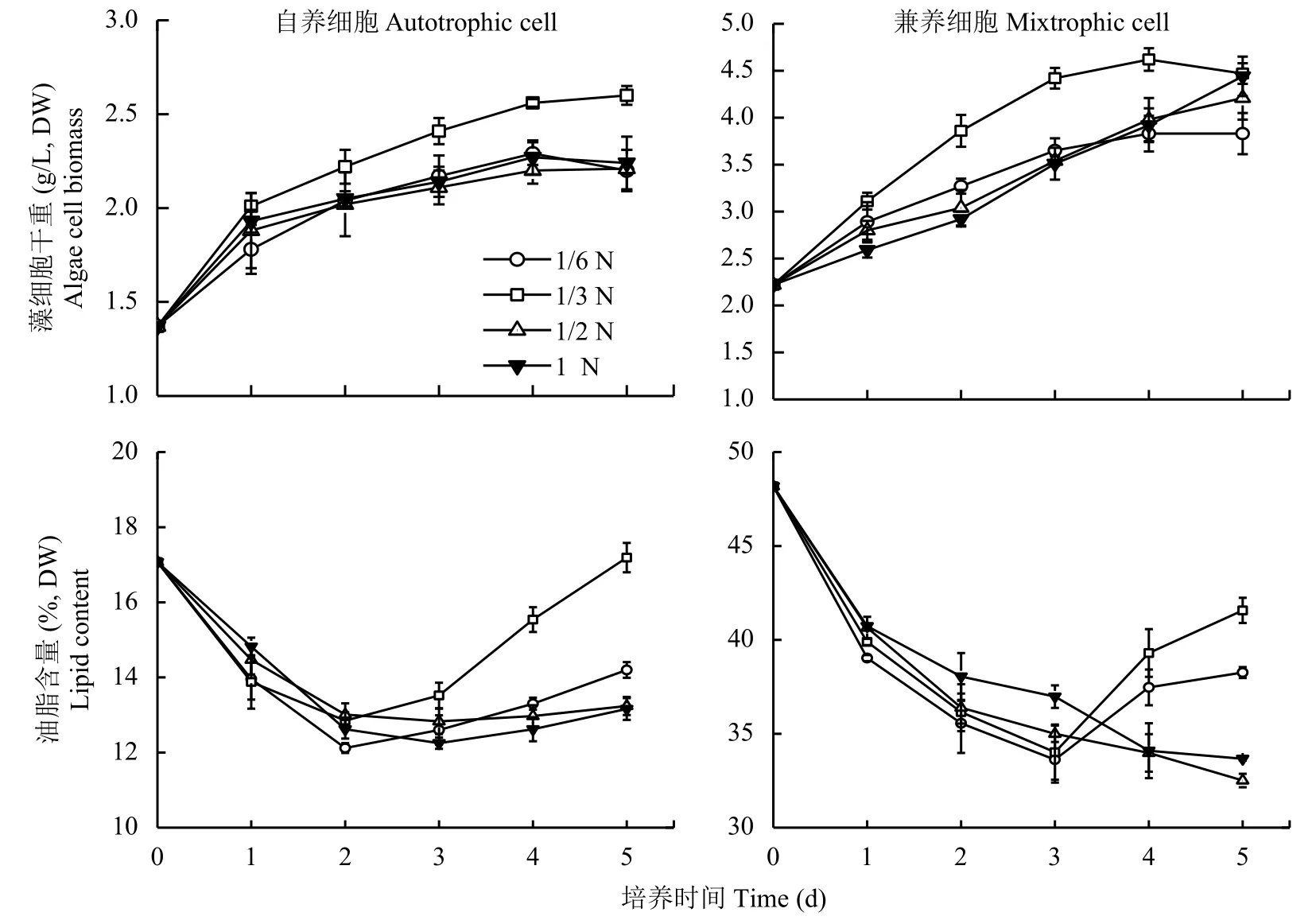
图 1 不同浓度低氮胁迫下蛋白核小球藻干重和油脂含量Fig. 1 Dry biomass and lipid contents of Chlorella pyrenoidosa under low N stresses
随着低氮胁迫处理时间的延长,自养和兼养来源的藻细胞油脂含量变化趋势相似,1/2N和1N处理组藻细胞油脂含量下降后回升不明显,1/6N和1/3N低氮胁迫的藻细胞油脂含量先下降后回升,具有明显的拐点现象 (图1),其中1/3N处理组油脂含量显著高于其它组,可见1/3N低氮胁迫最能激发细胞的油脂合成。自养和兼养藻细胞油脂含量回升拐点分别出现在2 d和3 d,说明兼养来源的藻细胞对低氮胁迫响应较慢。培养至5 d时,1/3N处理的自养组藻细胞油脂含量为17.19%,与种子藻细胞初始值相当,但兼养组藻细胞油脂含量仍显著低于其种子细胞初始值。
综合藻细胞干重与油脂含量两个指标计算油脂产率,自养与兼养组的蛋白核小球藻均是在1/3N低氮培养基中油脂产率最大,4 d油脂产率分别达到峰值 16.30 mg/(L·d) 和 129.56 mg/(L·d),同比 1N 对照组增幅分别为12.65%和35.82%,均显著高于处理前藻细胞。可见,自养组藻细胞虽然对低氮胁迫的响应较敏感,但低氮胁迫对兼养组藻细胞油脂产率的提升效果更显著。
2.3 低氮胁迫对不同来源蛋白核小球藻胞内蛋白和淀粉含量的影响
为了研究低氮胁迫处理对小球藻细胞的油脂合成与胞内其他生化组分的相关性,以1N组为对照,比较分析了1/3N低氮胁迫处理 (简称低氮组) 对自养和兼养来源的蛋白核小球藻胞内蛋白和淀粉含量的影响 (图 2)。
自养和兼养来源的藻细胞胞内蛋白初始含量不同,兼养组藻细胞胞内初始蛋白含量 (152.07 mg/g)比自养组藻细胞高53.9%。转接后第1天兼养组藻细胞胞内蛋白含量下降幅度均超过20.0%,高于自养组藻细胞的下降幅度 (8.0%以下)。自养组藻细胞胞内蛋白含量在4天内均逐日下降,只是低氮组每天降幅 (8.0%~10.0%) 高于对照组 (3.0%~6.0%),且最大降幅出现第3天,比对照组 (第2天) 晚。兼养组藻细胞对低氮胁迫处理的反应有所不同,1N对照组前3天胞内蛋白含量持续下降至谷值99.22 mg/g,第4天显著回升至132.17 mg/g。可见在氮素供应充足(1N) 时,储能相对丰富的兼养组藻细胞在转接入新鲜培养基渡过适应性初期后,胞内蛋白即开始合成积累。相比而言,接入1/3N低氮培养基的兼养组藻细胞胞内蛋白含量呈持续下降趋势。
自养组藻细胞胞内淀粉含量在转接后先下降后上升,均于第3天达到谷值,与对照组相比,低氮组胞内淀粉含量降幅较大,第4天升幅更小。兼养来源的藻细胞胞内淀粉含量于转接后第1天显著下降,第2~3天维持在相对低值,之后明显回升,4天时低氮组藻细胞胞内淀粉含量回升幅度也显著低于对照组。
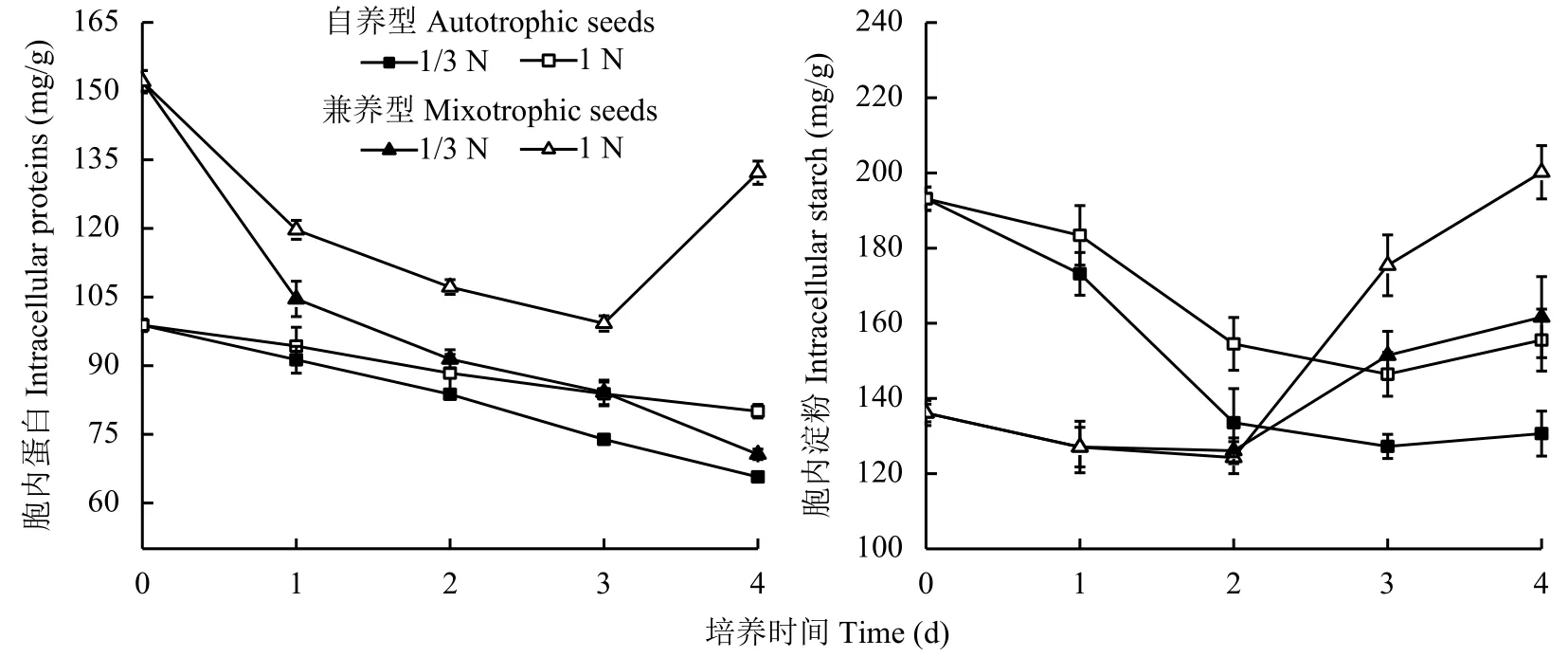
图 2 培养基供氮水平1 N和1/3 N时蛋白核小球藻胞内蛋白和淀粉含量变化Fig. 2 Change incontents of intracellular proteins and starch of Chlorella pyrenoidosa grown in media with nitrogen supply levels of 1 N and 1/3 N
2.4 低氮胁迫对不同来源蛋白核小球藻胞外蛋白和多糖含量的影响
图3表明,兼养组藻细胞EPS中蛋白含量显著高于自养组,所有藻细胞转接后EPS中蛋白含量均低于种子细胞的初始值。自养藻细胞对照组胞外蛋白含量持续下降,低氮组则前2天逐渐降至最低值2.69 mg/g,之后有所回升。兼养藻细胞EPS中蛋白含量均持续降低,低氮组同比对照组降幅更大,4天时低氮组藻细胞EPS蛋白含量比对照组低33.2%。
所有试验组藻细胞EPS中多糖含量变化趋势一致,均随培养时间的延长而逐渐降低。兼养组藻细胞胞外多糖含量同比高于自养组,低氮组同比低于对照组。4天时兼养低氮组藻细胞EPS中多糖含量比对照组下降37.7%。
2.5 低氮胁迫对不同来源蛋白核小球藻EPS组分和絮凝性能的影响
2.5.1 对藻细胞EPS组分的影响 以1/3N低氮胁迫处理第4天的藻细胞为例,采用三维荧光扫描进一步比较了低氮胁迫处理对自养和兼养来源的藻细胞EPS组分的影响 (图4)。自养与兼养组种子藻细胞EPS荧光扫描图谱均在T、A和C区各存在一个主峰 (图4A、B),分别代表不同类型的荧光基团。Chen等[25]对各峰的生化组分进行图谱解析可知,T峰 (Ex/Em:280/352 nm) 为蛋白样类色氨酸物质;A峰 (Ex/Em:230/373 nm) 是以富里酸为代表的类腐殖酸物质;C峰 (Ex/Em:330/373 nm) 是以胡敏酸为代表的类腐殖酸物质。T峰代表的蛋白样类色氨酸物质中色氨酸属于疏水性氨基酸,能促进藻细胞的絮凝,A和C峰代表的腐殖酸类物质具有亲水性胶体性质,在高浓度时呈胶体溶液或分散体系[26],会抑制藻细胞絮凝。其中兼养组藻细胞EPS中T、A和C峰强度比显著高于自养藻细胞。
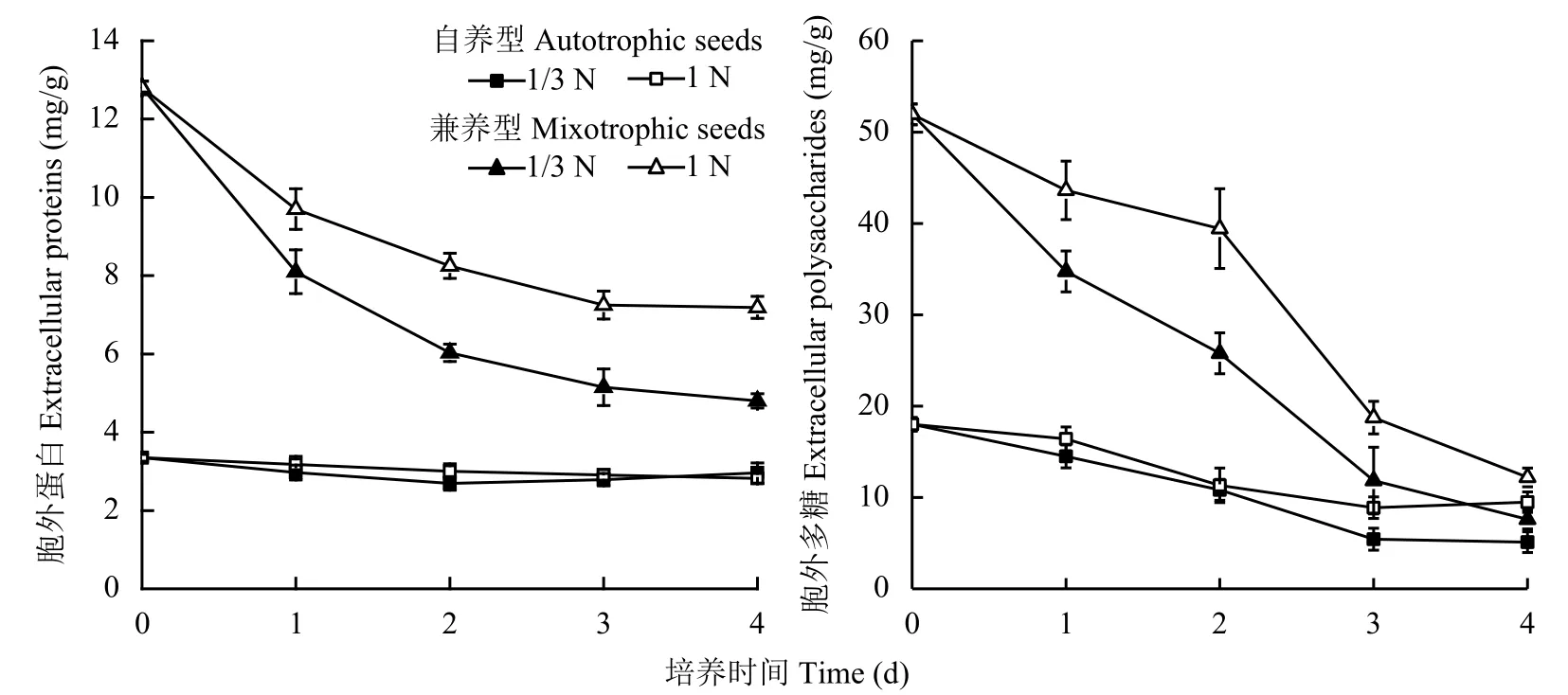
图 3 培养基供氮水平1 N和1/3 N时蛋白核小球藻胞外蛋白和多糖含量变化Fig. 3 Change in contents of extracellular proteins and polysaccharides of Chlorella pyrenoidosa grown in media with nitrogen supply levels of 1N and 1/3N
与转接前种子藻细胞 (图4A) 相比,第4天自养对照组和低氮组藻细胞EPS荧光图中A峰和C峰均消失,T峰强度明显减弱 (图4A1、A2),说明此时胞外类腐殖酸物质的含量极低,蛋白样色氨酸物质含量也下降;但1/3N低氮组T峰强度比对照组增加40.3%,说明低氮胁迫处理能适当减缓藻细胞EPS中蛋白样色氨酸含量的降幅。兼养来源的藻细胞转接培养4 d后,EPS荧光扫描图中T、A和C峰强度均显著降低,其中1/3N低氮组T峰、C峰和A峰的强度分别是对照组的83.6%、74.8%和54.8% (图4B、B1、B2),差异显著,可见低氮胁迫组EPS中腐殖酸类物质含量降幅较大。
2.5.2 对藻细胞絮凝率的影响 藻细胞EPS组分含量的改变可能影响其絮凝率,测定自养和兼养来源种子藻细胞絮凝率和低氮胁迫处理4天后的絮凝率(表2)。兼养组藻细胞絮凝率显著低于自养组。经1/3N低氮处理4天后,兼养和自养组藻细胞絮凝率为分别为78.46%和80.28%,均比对照组显著提高。
3 讨论
本结果表明,自养与葡萄糖兼养来源的蛋白核小球藻转接入低氮培养基的第1天即开始生长分裂,3天后生长减缓 (图1),说明低氮胁迫对藻细胞的促生长效应主要表现在培养初期。所有试验组藻细胞转接后初期油脂含量均显著下降,随着培养时间延长,1/6N和1/3N低氮胁迫处理组油脂含量出现先下降后回升的拐点现象 (图1)。前人研究低氮胁迫提高藻细胞油脂含量的处理时间在5~12天之间,检测间隔在1~3天之间[6,10,27],但一般藻细胞油脂含量随培养时间而升高,未报道油脂含量升降拐点现象。原因可能在于不同藻种存储油脂的代谢功用存在差异,油脂合成与分解代谢对培养环境变化的响应速率也不同。本文自养和兼养来源的藻细胞接入1/3N低氮培养基后油脂含量分别于第2天和3天出现回升拐点,说明自养组蛋白核小球藻种子细胞对低氮胁迫的响应速度比兼养组更为迅速。但葡萄糖兼养来源的藻细胞不仅初始油脂含量较高 (图1),胞内外蛋白和淀粉 (多糖) 含量也较丰富 (图2和图3),1/3N低氮胁迫4天后油脂产率最高,同比是自养组藻细胞的7.95倍。说明种子细胞营养方式影响其对低氮胁迫处理的响应水平,而且藻细胞生物量增长与生化组分积累并不同步。Griffiths等[7]报道除螺旋藻外,小球藻、栅藻等10种微藻的生长速率和油脂含量均在1/10N低氮胁迫条件下最高。本研究中蛋白核小球藻的油脂含量在1/3N即6 mmol/L硝酸钠低氮处理条件下效果最佳。
对蛋白核小球藻胞内外蛋白和淀粉 (多糖) 含量的监测数据表明,低氮组藻细胞胞内外蛋白、淀粉含量在培养初期均显著下降,且降幅高于对照组 (图2和图3),这与Lee等[28]在莱茵衣藻C. reinhardtii上的研究结果相似。莱茵衣藻在氮限制条件下,氨基酸氧化酶的基因表达水平提高而淀粉的合成途径将会被阻断,原因在于藻细胞为了适应低氮环境,既加强了非必需蛋白的降解,也阻断了淀粉合成对能量的消耗。但Fernandes等[29]研究却发现,氮限制条件下凯式拟小球藻细胞内淀粉首先积累,待氮源耗尽之后,油脂含量开始逐步上升,说明淀粉是作为凯式拟小球藻碳与能量的初步储存物质。本研究发现自养与兼养来源的藻细胞在低氮胁迫初期,油脂、淀粉和蛋白含量均迅速降低,与此相应的是生物量的大幅升高,待藻细胞生长逐步稳定的3天时,油脂和胞内淀粉作为储备能源才开始逐步回升 (图1和图2)。而且兼养和自养种子藻细胞油脂含量 (图1)和胞内淀粉含量高低变化同步,低氮胁迫处理后二者回升拐点出现时间也基本一致 (图3),由此可推测淀粉和油脂均作为蛋白核小球藻的储能物质,合成基本同步或淀粉合成后很快转化为油脂储存。至于蛋白质含量指标,除了兼养来源的藻细胞转接入1N对照培养基3天后胞内蛋白含量明显回升外,其他组藻细胞转接后胞内外蛋白水平均维持在较低水平或持续下降,低氮胁迫组下降更为明显 (图2和图3)。Geider等[30]报道三角褐指藻在氮胁迫条件下原初电子受体还原受阻而抑制了相关蛋白质的合成。Chen等[31]发现低氮胁迫后藻细胞蛋白质中部分氨基酸会发生分解代谢并能通过γ-氨基丁酸途径、三羧酸循环再分配到脂质代谢途径进行油脂合成。本研究蛋白核小球藻在1/3N低氮胁迫2天或3天后藻细胞油脂含量回升但胞内外蛋白含量持续下降,是否涉及蛋白降解氨基酸的转化分配有待进一步探究。
微藻细胞的收获成本在其生产成本中占比较大,藻细胞EPS组成与藻细胞絮凝收获特性密切相关[32]。本研究所用蛋白核小球藻自养种子细胞EPS胞外蛋白和多糖含量较低 (图3),二者比值也较低,而且含有一定比例的富里酸和胡敏酸类腐殖酸物质 (图4A),这可能是其自絮凝率较低的原因。葡萄糖兼养的藻细胞EPS中对絮凝有促进作用的蛋白类色氨酸物质T峰强度比自养藻细胞增加34.3%,而不利于絮凝的腐殖酸类物质,A峰和C峰强度却比自养组分别增加了141.8%和64.3% (图4),这可能是葡萄糖兼养培养使藻细胞絮凝率下降的主要原因。与1N对照组相比,1/3N低氮组藻细胞EPS组分中蛋白样类色氨酸和类腐殖酸物质均显著下降,但T峰下降幅度低于A峰和C峰,从而显著提高了藻细胞的絮凝率 (图4和表2)。可见培养基组成的改变能影响微藻细胞EPS组分从而影响其絮凝收获特性,在微藻人工培养技术中引入该项指标具有重要意义。本研究结果能为蛋白核小球藻人工培养技术的优化设计提供科学依据。
4 结论
蛋白核小球藻作为新食品资源开发的优良藻种,营养方式和低氮胁迫处理对其藻细胞生化组分积累转化动态和收获性能都具有显著影响,而且胞内外不同组分的含量变化与其生长速率并不同步。1/3N低氮胁迫提高蛋白核小球藻的油脂产率和絮凝性能的效果最佳。

