改良人子宫肌瘤原代细胞体外培养的建立及效果▲
胡光云 宋 阳 孙 哲 甄玉花 全小明 王一飞
(1 陆军军医大学护理系,重庆市 400038,电子邮箱:2234381336@qq.com:2 广州中医药大学护理学院,广东省广州市 510405;广州中医药大学第一附属医院3 肿瘤科,4 护理部,广东省广州市 510405)
子宫肌瘤是女性生殖系统最常见的良性肿瘤之一,主要由平滑肌细胞增殖引起[1],常见于30~50岁妇女,患病率呈逐年上升趋势。研究表明,子宫肌瘤是未绝经妇女行全子宫切除的最主要原因[2]。但该病发病机制杂,目前尚未完全明确[3],需要进行体外细胞及动物实验等研究进一步探讨[4]。体外细胞模型的建立是研究本病发生机制及防治措施的有效手段,但原代细胞培养存在贴壁率低、复苏存活率低等特点。本研究旨在不影响培养效果的前提下,改良原代细胞培养技术,为子宫肌瘤的研究提供基础。
1 材料与方法
1.1 标本来源 本研究所用病理组织取自在广州中医药大学第一附属医院行全子宫切除术或行子宫肌瘤剔除术的15例子宫肌瘤患者。患者年龄35~50(43.0±5.0)岁,术前至少3个月没有接受激素治疗,术后病理学诊断为子宫肌瘤。
1.2 实验试剂及设备 杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)购自Gibco公司(批号:25200-056),胎牛血清购自Gibco公司(批号:10270-106),青霉素/链霉素购自南京凯基生物公司生产(批号:15140-122),胰蛋白酶-乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)购自南京凯基生物公司(批号:25200-056),磷酸缓冲盐溶液(phosphate-buffered saline,PBS)购自HyClone公司(批号:SH30256.01),Ⅰ型胶原酶购自Sigma公司(批号:C0130),平滑肌肌动蛋白抗体购自Abcam公司(批号:ab134813)。CO2细胞培养箱(NAPCO公司,型号:Series 5400),细胞培养瓶(Corning公司),LX70倒置显微镜(Olympus公司,型号:CX41),全自动拍照装置(Lumenera公司INFINITYLite系列,型号:PMZO-35),水浴箱:(德国Memert公司),低速离心机(ANKE公司,型号:TDL-5c),超低温冰箱(SANYO公司,型号:MDF-U53V)。
1.3 实验方法
1.3.1 人子宫肌瘤组织的保存:在无菌操作下取数块子宫肌瘤瘤核组织块,大小约为1 cm3,将组织块分为常规组及改良组。将常规组标本置于4℃ PBS中(内含青霉素/链霉素1 000 IU /ml),改良组标本放入Hank液(Gibco公司,批号:8118275)(内含青霉素/链霉素1 000 IU/ml)中,低温(0~4℃)条件下迅速送至实验室进行细胞培养。
1.3.2 原代细胞的获取与细胞培养:(1)常规组采用胶原酶消化法获得人子宫肌瘤原代细胞:参照韩虹娟等[5]改进的人子宫肌瘤细胞培养方法获取原代细胞,首先将子宫肌瘤组织块放入含PBS(含3%青霉素/链霉素)的无菌培养皿中进行梯度漂洗3次,除去血迹及组织外层;然后将漂洗好的组织块移入无血清DMEM培养基,用弯镊和眼科剪将组织块修剪成约1 mm3大小;最后用无菌吸管将修剪后的组织小块及DMEM液移至50 ml的离心管中,待组织沉淀后弃上清,并向管中加入0.2%的Ⅰ型胶原酶10 ml,37℃水浴消化1.5~2 h(每30 min摇晃1次),组织块明显变小且消化液变浑浊后,加入足量的完全培养基终止消化;1 000 r/min离心10 min弃上清,再用200目的细胞筛过滤收集滤液,将细胞接种于25 cm3培养瓶中,加入20%的完全培养基(DMEM+20%胎牛血清+1%青霉素/链霉素)后置于37℃、5% CO2培养箱中培养。培养24 h后待细胞贴壁进行第1次换液,以后每48 h换液1次,待细胞融合达70%~80%时用0.25%胰蛋白酶-EDTA消化传代。(2)改良组采用改良的胶原酶消化法获得原代细胞:漂洗、修剪组织过程同常规组,将约1 mm3大小的组织块移至50 ml的离心管,待组织沉淀后弃上清,加入0.2%的Ⅰ型胶原酶(胶原酶与组织块体积比例为2 ∶1)消化,混合均匀后,放入37℃、5% CO2培养箱。消化2 h后,摇晃离心管,再消化5~6 h,组织块明显变小且消化液变浑浊后,用200目不锈钢滤网过滤,收集滤液,滤液加入完全培养基终止消化,培养基与胶原酶体积比为2 ∶1;滤网上的组织块再次放入50 ml离心管中,加入胶原酶(组织块与胶原酶体积比为1 ∶1)再次消化,再次消化1 h后过滤组织悬液,收集细胞悬液,终止消化。将两次终止消化后的细胞悬液,以1 000 r/min离心10 min,弃上清,加入培养基(DMEM+10%胎牛血清+1%青霉素/链霉素)吹打均匀,再次1 000 r/min离心5 mim,弃上清,将细胞接种于25 cm3培养瓶中,加入10%的完全培养基(DMEM+10%胎牛血清+1%青霉素/链霉素),于37℃、5%CO2培养箱中孵育培养,每48 h换液1次,待细胞融合达70%~80%时用0.25%胰蛋白酶-EDTA消化传代。
1.3.3 细胞的冻存:从传带后第2代开始,待细胞融合80%时准备冻存,冻存前一晚换液,按细胞传代方法获取细胞悬液,离心过程中按PBS ∶胎牛血清 ∶二甲基亚砜为6 ∶3 ∶1 配置冻存液,放入4℃的冰箱中待用。细胞离心结束,倒掉上层清液,将预冷好的冻存液缓慢加入离心管中,吹打均匀后放入冻存管,静止几分钟,写明冻存细胞种类,冻存日期,放入程序降温盒,冻存24 h后,移至-80℃的冰箱。
1.3.4 子宫肌瘤细胞的复苏:迅速从-80℃冰箱中取出冻存管,直接浸入37℃恒温水浴箱中,并不时摇动使其尽快融化。注意不可使水浸没瓶盖,以避免污染。然后从37℃水浴箱中取出冻存管,打开盖子,用吸管吸出细胞悬液,放入离心管并滴加10倍以上含10%胎牛血清的DMEM培养基混匀,1 000 r/min离心5 min ,弃上清,加入含10%胎牛血清的培养液重悬细胞,计数,调整细胞密度,接种培养瓶,37℃、5% CO2培养箱静置培养,次日更换1次培养液,继续培养。
1.4 观察指标
1.4.1 细胞形态观察及细胞鉴定:细胞贴壁后,在倒置显微镜下直接观察细胞的形态及生长情况,并应用全自动拍照系统记录细胞的形态变化;培养至第3代,采用α-平滑肌肌动蛋白免疫细胞化学法鉴定细胞,评估细胞首次传代成功的时间。传代周期为5~7 d,传至第3~5代时细胞形态均匀,生长良好,质量稳定,经鉴定后用于实验[5]。
1.4.2 获得细胞数及细胞贴壁率:(1)两组均于终止消化后,收集细胞悬液进行细胞计数。(2)将原代细胞分别以(5~10)×107个/L接种于含有10% 完全培养基的25 mm3培养皿中,于5% CO2、37℃培养箱中培养6 h后,吸取上清液,计算细胞贴壁率:细胞贴壁率=(接种细胞数-上清细胞数)/接种细胞数×100%。实验重复3次,取3次的平均值为细胞贴壁率。
1.4.3 细胞传代次数及复苏情况:(1)如在显微镜下观察到细胞形态均匀、生长良好、质量稳定,则评定为生长良好的细胞,当出现细胞体积增大、细胞核凹陷、核膜崩解等细胞结构的变化时,说明细胞已出现衰老[6],不宜再进行传代培养,记录两组细胞可传代培养的次数。(2)取冻存后的细胞进行复苏培养,24 h后如镜下观察到细胞融合50%~60%,则说明复苏成功。
1.5 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 人子宫肌瘤原代细胞形态及细胞鉴定 倒置显微镜下可见两组细胞均呈长梭形,放射状生长,成束的细胞平行排列,部分区域细胞多层重叠,部分呈单层,高低起伏呈现平滑肌细胞特征性的“峰-谷”状生长[5],见图1~2。免疫组化鉴定结果显示α-平滑肌肌动蛋白抗体呈阳性反应,光镜下细胞轮廓清楚,中央有卵圆形的核,核仁及胞质清晰, 核旁可见空泡, 胞浆饱满,见图3~4。


图1 改良组子宫肌瘤原代细胞形态图2 常规组子宫肌瘤原代细胞形态图3 改良组免疫组化鉴定(×100)图4 常规组免疫组化鉴定(×100)
2.2 两组细胞数、贴壁率和首次传代时间比较 改良组获取的细胞数多于常规组,贴壁率高于常规组,首次传代时间短于常规组(均P<0.05),见表1。
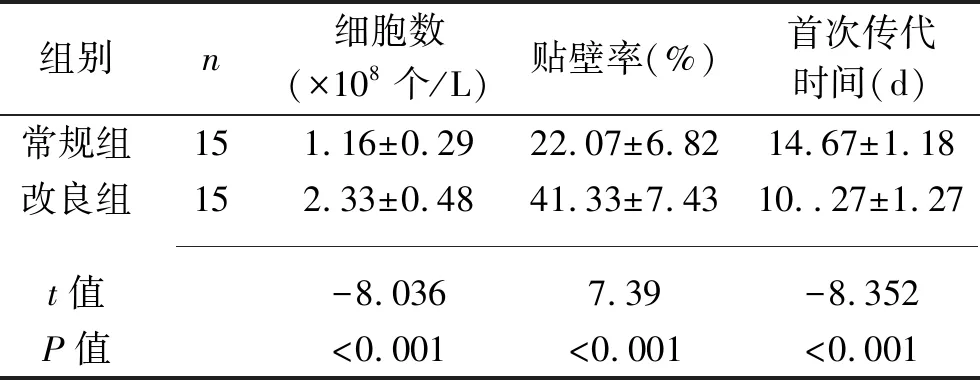
表1 两组细胞数及贴壁率、首次传代时间比较(x±s)
2.3 两组细胞传代次数及复苏情况比较 改良组细胞传代(6.60±0.83)次,常规组细胞传代(6.33±0.72)次,两组比较差异无统计学意义(t=-0.943,P=0.356)。两组细胞均复苏成功。
3 讨 论
子宫肌瘤体外细胞模型可用于药物敏感性实验及疾病机制的相关研究,但原代细胞体外培养困难[7],程序复杂,无菌要求严格,细胞生长受到培养基、操作方法、培养环境及无菌条件等诸多因素影响[8]。具有重复性好、稳定性强、纯度高等优点的细胞体外培养方法是培养人子宫肌瘤细胞系的关键,也是相关实验的能否顺利进行的基本保障[9]。
3.1 强化实验的无菌操作 无菌操作关乎每一个实验环节,包括标本取材过程,器械的清洗、消毒、保存,培养液的配置,双抗等试剂的添加等,任何环节出现纰漏均会使细胞发生污染,导致培养失败[10]。
3.2 组织块运输过程中缓冲液的选择 肌瘤组织离体后,组织块即使处于低温环境中也仍在进行代谢。在国内多采用PBS或DMEM来暂存组织标本。PBS是只含有磷酸根、钠、钾、氯离子的盐平衡缓冲液,不能为细胞提供暂时的营养;DMEM是一种含各种氨基酸和葡萄糖的培养基,但缺少必需的盐离子[11];而Hank液中盐成分较PBS复杂,且含有葡萄糖,可为细胞提供简单的营养。本研究中,改良组在取材过程中采用Hanks液代替PBS或DMEM,结果显示改良组原代细胞贴壁率高于常规组,细胞活性高于常规组(均P<0.05),这可能与肌瘤组织离体后Hanks液能有效保护组织细胞的活力有关。
3.3 胶原酶消化时间及二次消化 研究表明,在进行人子宫肌瘤细胞体外培养时,分别用胶原酶消化0.5 h和6 h,均能成功培养出原代子宫肌瘤细胞[5,12]。本研究中,常规组消化时间1.5~2 h,而改良组的消化时间改为4~7 h,并根据组织韧度的不同调整消化时间,如韧性大、质硬组织的消化时间相对较长。结果显示改良组仍能获得较多细胞,且细胞的贴壁率高于常规组(P<0.05)。这可能与二次消化可将组织深层的细胞不断暴露于消化酶中,进而获得更多的细胞有关。笔者还发现二次消化时间过长可导致细胞损伤,建议二次消化的时间为1~2 h。
3.4 两组细胞形态及平滑肌肌动蛋白抗体对比 两组细胞的细胞形态、大小、排列方式基本相似。α-平滑肌肌动蛋白含量变化是判断平滑肌细胞表型变化的主要依据[13]。本研究中,免疫组化鉴定结果显示α-平滑肌肌动蛋白抗体呈阳性反应,提示所培养的细胞为子宫肌瘤细胞,且细胞表型未发生明显变化。
综上所述,改良的人子宫肌瘤细胞培养方法是一种能快速获得较多人子宫肌瘤细胞的简便且可行的方法,能有效缩短细胞首次传代时间,保证较多的传代次数及较高的复苏成功率,其所培养的原代细胞具有较高的贴壁率及纯度。

