转化生长因子β1 诱导A549 细胞上皮-间充质转化的时间相关性
阮越勇,张浩军,疏欣杨,王蓓蕾,张纾难,2⋆
(1.北京中医药大学 研究生院,北京 100029;2.国家呼吸疾病临床研究中心,中日友好医院 呼吸中心中医肺病,北京 100029;3.中日友好医院 临床医学研究所,北京 100029)
弥漫性间质性肺疾病(ILD)或称肺纤维化,为最常见的呼吸系统疾病之一,其发病机制尚未完全清楚[1]。 之前观点认为肺间质细胞的激活和增殖,是由于进行性炎症、炎症细胞侵袭、细胞因子失衡诱导的[2]。近些年来,大量研究报道,尤其是特发性肺纤维化和间质性肺炎,炎症反应不一定是必要条件,而肺泡上皮-间充质转化 (epithelialmesenchymat transition,EMT) 和信号传导通路在诱导肺纤维化中的作用逐步获得了认可[3,4]。 EMT是一种生物学现象,其中上皮细胞在某种病理生理条件下转变为间充质细胞。它由3 个类型组成,凡是涉及修复创伤、组织再生和器官功能障碍,归类为2 型EMT,主要生物学功能是修复成纤维细胞和由于创伤和炎症状况引起的组织损伤[1,5,6]。虽然体内实验在肺、肾、肝脏等脏器纤维化进程中是否存在EMT 仍存在争议,但体外研究中EMT 的发生已被证实[2]。 作为一种多功能生长因子,人转化生长因子 (transforming growth factor-β1,TGFβ1)可在各种上皮细胞中诱导EMT,包括肺、肝、肾上皮细胞,被认为是器官纤维化的“总开关”[3]。EMT 涉及肿瘤侵袭和纤维化发生发展,已成为近年来的研究热点,越来越引起国内外相关学者的重视[7]。
本实验通过TGF-β1 刺激A549 细胞,分析不同时间点,从细胞外形至基因蛋白的表达,探索是否存在时间的依赖性,从而进一步了解TGFβ1 诱导EMT 发生的机制。
1 材料与方法
1.1 材料
A549 上皮细胞系,购自国家实验细胞资源共享平台。 F12 培养基和胎牛血清购买自Gibco 公司;DMSO(dimethyl sulfoxide)购自Amresco 公司;MTT 购自Sigma 公司;TGF-β1 购自PeproTech 公司;E-Cadherin (E-Cad) 抗体、Fibronectin (FN)抗体、Vimentin (Vim)抗体购自proteintech 公司;逆转录酶试剂盒购自美国Thermo scientific。 IX71荧光倒置相差显微镜购自日本Olympus 公司;CO2孵育箱、 酶标仪购自美国Thermo scientific 公司;7500 Real-Time PCR 仪购自Applied Biosystems公司;半干转仪器购自Bio-Rad 公司;发光检测仪购自Bio-Rad ChemiDoc 公司。
1.2 方法
1.2.1 细胞培养及分组
A549 细胞用F-12 培养基( 含有100U/ml 青霉 素,100mg/L链霉素和10%胎牛血清) 于37℃,5% CO2条件下在孵育箱中培养,待细胞生长汇合至80%以上,以0.25% 胰蛋白酶消化,进行相关实验。取6 孔培养板,每孔加入2.5ml 的5×104细胞,以无血清培养基饥饿15h。 将体外培养A549 细胞分随机2 组:空白组、模型组。空白组为A549 细胞+F-12 培养基; 模型组为A549 细胞+F-12 培养基+10ng/ml TGF-β1。 继续培养24h、48h、72h。
1.2.2 MTT 实验
将8×103个A549 细胞加到96 孔板,24h 后细胞贴壁,吸出培养液,加入5、10ng/ml 浓度的TGF-β1 为模型组,加入F-12 完全培养液为空白组,并在24h、48h、72h 继续培养。 随后加入10μl MTT,并在培养箱中孵育4h,再加入100μl 三联溶解液放培养箱中孵育过夜。 在490nm 波长检测吸光度。 空白孔的平均吸光度作为100%,模型孔的吸光度除以正常孔的平均吸光度,乘以100%,得到每孔的增殖率。
1.2.3 细胞形态检测
TGF-β1 经过24h、48h、72h 诱导A549 细胞后,将细胞放置显微镜在60 倍条件下观察。 每组随机分成5 个样本,每样本随机拍照5 个视野,其相片用在细胞形态对比。
1.2.4 实时荧光定量PCR(qPCR)
TGF-β1 干预24h、48h、72h 后,用Trizol 一步法提取总RNA。 测定RNA 水平,通过逆转录制备cDNA,以cDNA 为模板加入靶基因(Fn,Vim,ECad),参照基因(β-actin)为反应体系的基础,设定反应参数并扩增目标基因,样品的Ct 值与样品的第一版本的拷贝之间存在线性关系。其中以βactin,Fn,Vim,E-Cad,外显子序列为模板,Oligo 7.0 为设计模板。 引物序列如表1。
1.2.5 Western blot(蛋白印迹法)分析
TGF-β1 处理细胞24h、48h、72h 的A549 细胞。 细胞用适量的0.1%PMSF 裂解,20s 超声破碎,冰上孵育30min。 高速离心后采集漂浮物质并在BCA 模式下测量。 将蛋白质浓度调节至标准浓度后,取12~15μl 样品用于SDS-PAGE 电泳,并将半干膜法转移至PVDF 膜上。5%脱脂奶粉封闭1h 后,加入一抗,稀释比例为1:3000 并在4℃下孵育过夜。 IgG 抗兔二抗在37℃下孵育1h。 用PBST 冲洗10min×3 次,并使发光检测仪曝光拍照。以β-actin 为内参,用Quantity One 系统分析,并对凝胶条带的信号强度进行E-Cad、FN、Vim半定量分析。

表1 引物序列
1.2.6 免疫荧光法
将细胞爬片放置孔底,将细胞种植到6 孔板,分别加入TGF-β1 刺激24h、48h、72h。 移入1 个干净的六孔板冷PBS 浸泡<3min。 每个玻片滴加4%的多聚甲醛冰上固定15min。 用微量移液枪加一抗,稀释比例1:100,4℃冰箱过夜。 PBS-Tween洗,3 次×5min。 用微量移液枪加入二抗,稀释比例1:150,覆盖均匀平放室温孵育1h,避光。 PBSTween 洗3 次×5min,将6 孔板倒置显微镜在200倍条件下观察每孔细胞。每组随机选取5 个样本、每个样本随机选取5 个视野拍照。 应用Image J软件处理图片。
1.3 统计学方法

图1 TGF-β1 刺激不同时间对A549 细胞增殖的影响
使用Prism5.0 软件分析组间差异,组间数据比较采用独立样本t 检验,然后应用Tukey 法。
2 结果
2.1 TGF-β1 对A549 细胞增殖的影响
通过MTT 法在5ng/ml 和10ng/ml 浓度和24h、48h、72h 条件点下,结果发现48h、72h 与空白组比较,在5ng/ml TGF-β1 细胞有增殖作用,差异有统计学意义(P<0.05),在10ng/ml TGF-β1 细胞有明显增殖作用,差异有统计学意义 (均P<0.01),见图1。
2.2 TGF-β1 刺激在不同时间细胞形态的变化
据MTT 实验结果,选10ng/ml 作为TGF-β1的刺激浓度。 将细胞放置倒置显微镜下,图2(见封二)示,在24h 与空白组比较,模型组无明显变化。在48h 与空白组比较,模型组细胞有形态学改变,部分细胞从类似于椭圆形变为类似伸长的纺锤样的形状,细胞圆形度明显下降。在72h 与空白组比较,模型组细胞有明显形态学改变,几乎所有细胞呈伸长的纺锤形态,细胞圆形度极度降低。
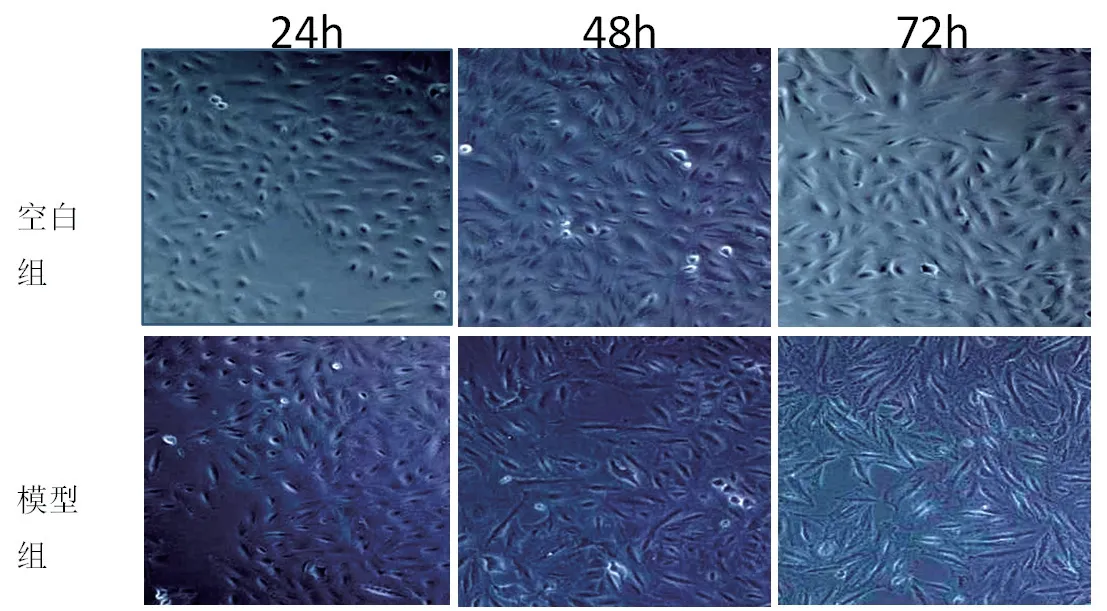
图2 TGF-β1刺激不同时间对A549细胞形态的影响(×50)
72h时与空白组比较,模型组细胞有明显形态学改变,几乎所有细胞呈伸长的纺锤样的形态,细胞圆形度极度降低。
2.3 TGF-β1 诱导EMT 在不同时间点FN、Vim、E-Cad mRNA 表达水平
通过q-PCR 检测,图3 示,在48h 与空白组比较,模型组FN mRNA 表达上调,差异均有统计学意义(P<0.05),E-Cad mRNA 表达明显下调,差异均有统计学意义(P<0.01)。 在72h 与空白组比较,模型组FN mRNA 表达上调,差异均有统计学意义(P<0.01),E-Cad mRNA 表达明显下调,差异有统计学意义(P<0.01)。
2.4 TGF-β1 诱导EMT 在不同时间点FN、Vim、E-Cad 荧光表达水平
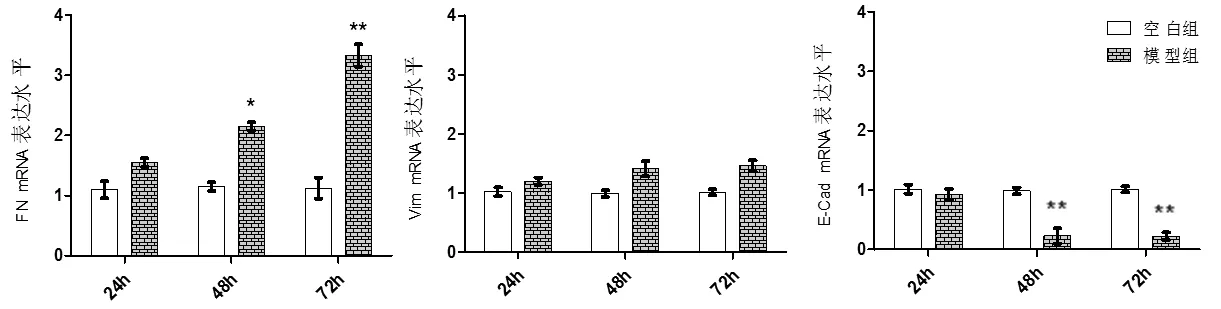
图3 FN、Vim、E-Cad mRNA 表达水平
通过免疫荧光法,结果显示在48h、72h 与空白组比较,模型组FN、Vim 荧光表达上调,E-Cad荧光表达下调(图4,见封二)。
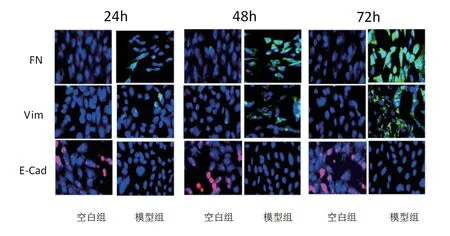
图4 FN、Vim、E-Cad 荧光表达水平(×200)
免疫荧光法显示,在48h、72h时与空白组比较,模型组FN、Vim 荧光表达上调,E-Cad 荧光表达下调。
2.5 TGF-β1 诱导EMT 在不同时间点FN、Vim、E-Cad 蛋白表达水平
通过Western blot 检测,结果显示在48h 与空白组比较,模型组FN 蛋白表达上调,差异均有统计学意义(P<0.01),E-Cad 蛋白表达明显下调,差异均有统计学意义(P<0.01)。 在72h 与空白组比较,模型组FN、Vim 蛋白表达明显上调,差异均有统计学意义(P<0.01),E-Cad 蛋白表达明显下调,差异有统计学意义(P<0.01)(图5)。
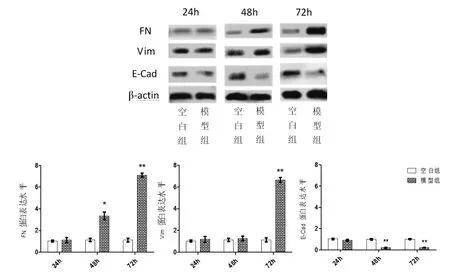
图5 FN、Vim、E-Cad 蛋白表达水平
3 讨论
EMT 是参与胚胎发育及许多慢性疾病和纤维化及肿瘤疾病发展有关的一种现象。 EMT 的过程,也称为“转分化”。 此现象中,细胞失去上皮特性,包括极化和与特定细胞的间接处,获得迁移的能力,允许它们离开上皮层并融入周围组织[8~10]。EMT 是指上皮细胞通过其间充质特性极化的细胞和分子转换。大量研究表明,这些转录因子的表达与人类许多癌症的不良预后和远处转移有关。EMT 现象不但促进肿瘤细胞侵袭的作用以外,而且还显示赋予肿瘤细胞对细胞凋亡和失去凋亡的抗性[11]。TGF-β1 为诱导EMT 发生的主要因子,大多数学者认为TGF-β1 诱导EMT 有两个途径,依赖Smad 信号通路和非依赖Smad 信号通路。正常情况下,细胞外基质的TGF-β1 处于无活性状态。在各种刺激因素作用下,TGF-β1 被激活形成二聚体,此二聚体与TGF-β2 型和TGF-β1 型受体相结合,形成异二聚体,使Smad2、Smad3 磷酸化,磷酸化的Smad2/3 与Smad4 形成复合体并发生核转位,激活转录因子Snail、Slug 等,致EMT 发生。 此外,TGF-β1 诱导的EMT 也能激活非Smad信号转导途径,包括MAPK、Akt 等通路。 TGF-β1与受体结合后激活MAPKK,然后MAPKK 激活MAPK,最终致EMT[12]。
本实验为了证实在体外实验TGF-β1 刺激时间越长,则EMT 现象发生越为明显。 本研究将A549 细胞为模型,以TGF-β1 为刺激因子 诱导EMT 发生,并且使用当前的先进技术,从形态学和分子学角度,对EMT 发生的时间和信号通路进行研究。 首先,从细胞形态学结果来看,在48h、72h 与空白组比较,模型组大部分细胞呈纺锤样的形状,细胞的圆形度极度降低。 提示48h 和72h均为TGF-β1 促进细胞形态变化的时间,尤其72h 最为显著。 根据上述的结果,以q-PCR、Western blot、免疫荧光技术,来观察TGF-β1 对肺泡上皮细胞间质转化不同时间点基因和蛋白的表达。 结果示在48h 和72h 时间点,FN mRNA、蛋白及荧光表达上调,E-Cad mRNA、蛋白及荧光表达下调。 说明在这2 个时间段TGF-β1 能够降低上细胞标志物E-Cad,并增加间质细胞标志物FN、Vim 的表达,从而诱导EMT 现象的发生。 但仔细观察结合统计学,可以看出上皮细胞标志物ECad,在48h 和72h 时mRNA、蛋白均有同样程度的下调。 而间质细胞标志物FN 和Vim,在48h 和72h 时mRNA、 蛋白有不同程度的上调,尤其在72h FN 和Vim mRNA、 蛋白表达上调更为明显。提示在早期时候肺泡上皮细胞先受损,晚期随着上皮细胞的损伤,间质细胞亦出现上升的趋势,最终导致EMT 的发生。本研究的结果基本符合临床上肺纤维化的临床表现及影像学特征,以特发性肺纤维化(IPF)为例,初期患者主要表现为干咳少谈或没有任何症状,影像学表现为双侧,不对称,伴有肺容积缩小; 随着时间越长久到了晚期患者表现为咳嗽、进行性呼吸困难、活动后明显,肺部出现网状影,牵拉性支扩、蜂窝影多见,外周及两肺底分布,新老病灶共存。
综上所述,本实验以A549 上皮细胞为模型,从细胞外形到基因及蛋白表达,研究在不同时间段,TGF-β1 诱导EMT 发生的关系。 最终结果发现在体外实验,EMT 发生与TGF-β1 刺激的时间长短有关。提示72h 和48h 为为体外实验EMT 发生的时间,但48h 只能影响到上皮细胞标志物的表达,对间质细胞标志物的表达影响不大,其在72h 二者表达均很明显。 研究结果亦符合临床实际,EMT 为肿瘤和纤维化疾病发病的重要机制,这些疾病发病大多数为老年病患,其形成是长年累月的最终结果。 本实验下一步研究可探讨某些通路在不同时间段的基因和蛋白表达水平,进一步了解EMT 发生机制,从而助于临床对肿瘤和纤维化等疾病的预防和治疗。

