hUC-MSCs在LPS诱导肺上皮细胞线粒体损伤中的作用
宋 航,陈 霞,杨 艳,姜晓芳,冯 静
(中国人民解放军第三二四医院,重庆 400020)
严重感染、有毒气体吸入、休克等均可导致急性肺损伤,组织学上可表现为不同程度的肺水肿和肺不张等[1]。现临床治疗手段有限,预后差。而间充质干细胞(mesenchymal stem cells,MSCs)移植急性肺损伤模型的体内、体外实验取得了较大成功[2]。前期课题组也证实了人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)对内毒素诱导的急性肺损伤(acute lung injury,ALI)小鼠模型的治疗作用,但是目前治疗机制不明。近年来发现MSCs治疗成功的关键在于肺泡上皮细胞(alveolar epithelial cell,AEC)的修复[3]。因此探索MSCs修复AEC损伤的主要作用部位意义重大。多项研究表明AEC线粒体功能异常在ALI中起着关键作用[4]。但是目前MSCs对ALI患者AEC线粒体功能的影响,国内外相关报道较少。因此,本研究选择A549细胞作为AEC的代表,希望通过本研究探明hUC-MSC修复脂多糖(LPS)诱导的ALI细胞模型中,hUC-MSC对人Ⅱ型肺泡上皮细胞素A549细胞线粒体功能的影响。
1 材料与方法
1.1材料
1.1.1细胞来源 hUC-MSCs为课题组前期由人脐带组织成功分离获得,A549细胞株购自南京科佰生物科技有限公司。
1.1.2主要试剂 DMEM/F12、澳洲胎牛血清(美国Gibco),二甲基亚砜(DMSO,美国Sigma-Aldrich),增强型CCK-8试剂盒、增强型腺嘌呤核苷三磷酸(ATP)检测试剂盒、活性氧(ROS)检测试剂盒、线粒体膜电位检测试剂盒(JC-1)、细胞线粒体分离试剂盒、Western blot制胶试剂盒、脱脂奶粉(杭州碧云天生物技术有限公司),兔多克隆线粒体融合相关蛋白(Mfn1)抗体、兔多克隆线粒体呼吸相关蛋白(Miro1)抗体(英国Abcam公司),兔多克隆线粒体移动基因蛋白(NRF1)抗体(北京博奥森公司),TBS缓冲液(武汉博士德生物制品公司),无水甲醇(重庆川东化工有限公司)。
1.1.3主要实验仪器 超净工作台(苏州苏洁净化设备有限公司),电子天平(Storious公司),CO2细胞培养箱(美国Thermo Fisher Scientific),细胞计数板(上海求精生化试剂仪器公司),倒置显微镜(德国Leica公司)。
1.2方法
1.2.1LPS诱导ALI模型的建立 取A549细胞5×106/mL接种于6孔板,待细胞长至80%融合时,DEME培养液中加入10 μg/mL的LPS继续培养24 h,建立ALI细胞模型。
1.2.2A549和hUC-MSCs直接共培养及实验分组 取hUC-MSCs悬液500 μL,细胞密度5×106/mL直接加入已加入LPS的A549培养瓶中,5% CO2培养箱中培养48~72 h。实验分为4组:A549+PBS、A549+LPS、A549+MSCs、A549+MSCs+LPS。
1.2.3流式细胞分选术 无菌条件下采用流式细胞分选术,将混合共培养A549和hUC-MSCs相互分离。上机分选时将共培养的细胞按体积大小明显分为两群,分选出体积小的细胞群。再利用增强型绿色荧光蛋白(EGFP)标记,分选出其中EGFP阴性表达的A549,在激光共聚焦显微镜下观察,证实分选出的细胞为EGFP阴性,并且呈现出上皮细胞特征性的大小均一的短梭形状。分选出的A549用于线粒体提取、免疫荧光标记、功能测定等实验。
1.2.4细胞线粒体荧光探针染色 加入Mito-Tracker Green染色工作液,与细胞37 ℃共孵育15~45 min。然后去除染色工作液,加入37 ℃预温育的新鲜细胞培养液。用荧光显微镜或激光共聚焦显微镜进行观察。
1.2.5线粒体提取 首先收集A549细胞并洗涤细胞,通过预处理后匀浆,并对匀浆效果进行鉴定。细胞匀浆1 000×g离心10 min后,小心把上清液转移到另一离心管中继续3 500×g离心10 min,小心去除上清液。沉淀即为分离得到的细胞线粒体。在分离得到的线粒体样品中可以加入150~200 μL线粒体储存液,重悬线粒体。
1.2.6细胞ATP及ROS测定
1.2.6.1细胞ATP测定 吸除培养液裂解细胞。裂解后4 ℃ 12 000×g离心5 min,取上清液,用于后续的测定。每孔加入100 μL ATP检测工作液及20 μL样品或标准品,迅速混匀后,用液闪仪测定RLU值。根据标准曲线计算出样品中ATP的水平。
1.2.6.2细胞ROS测定 收集细胞后装载探针,稀释2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)使终浓度为10 μmol/L。细胞收集后悬浮于稀释好的DCFH-DA中,细胞浓度为1×106/mL,继续孵育20 min。收集细胞后用荧光分光光度计检测。
1.2.7线粒体膜电位测定 配制JC-1染色工作液后设置阳性对照,把配制好的JC-1染色工作液再用JC-1染色缓冲液(1×)稀释5倍。加入0.1 mL总量为10~100 μg纯化的线粒体。用荧光分光光度计或荧光酶标仪检测。
1.2.8Western blot方法测定线粒体功能因子(Mfn1、Drp1、Miro1)表达水平 制胶后加样及电泳,然后转膜封闭,一抗孵育后二抗孵育,确保抗体均匀孵育在聚偏氯乙烯(PVDF)膜上。并行显影及图像分析,以GAPDH 作为内参进行标准化,用ImageQuant TL对图像进行灰度值半定量分析。

2 结 果
2.1分选后A549行荧光探针染色标记 分选后A549细胞在荧光显微镜下满视野可见明亮的强荧光染色,证实提取后的细胞线粒体活性可,见图1。
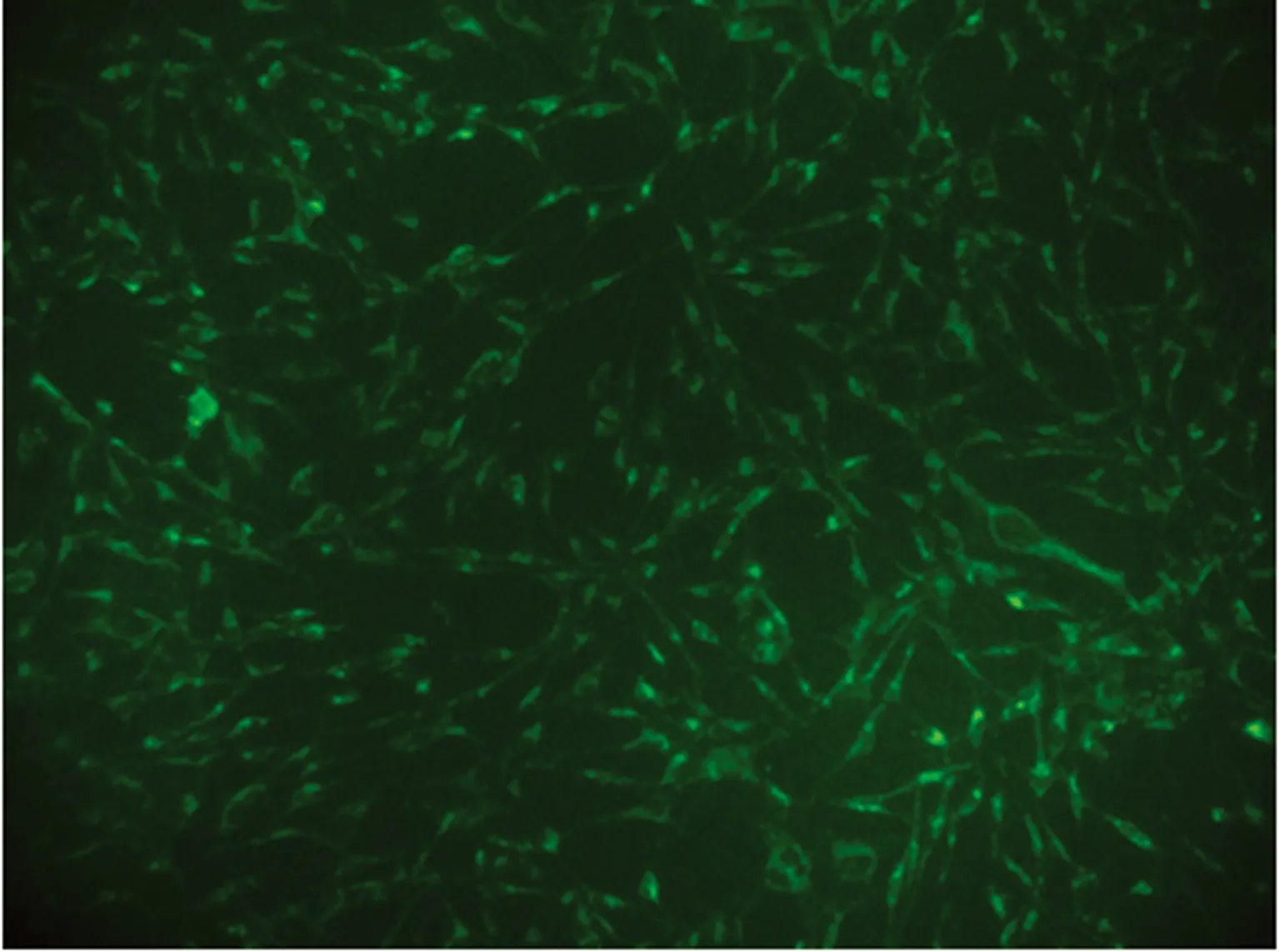
图1 分选后AEC线粒体荧光探针染色
2.2混合培养后A549细胞的ATP及ROS变化 A549+PBS组与A549+LPS组比较,ATP与ROS水平差异有统计学意义(P<0.05,P<0.01);A549+LPS组与A549+MSCs+LPS组比较,ATP与ROS水平差异有统计学意义(P<0.05,P<0.01),而A549+MSCs+LPS组与A549+PBS组比较,差异无统计学意义(P>0.05)。可以看出,LPS刺激下A549细胞单独培养组ATP下降,ROS升高;而与hUC-MSCs混合培养后,细胞ATP升高,ROS下降,见图2。

①:A549+MSCs+LPS组;②:A549+LPS组;③:A549+PBS组;④:A549+MSCs组;a:P<0.05,b:P<0.01
图2 LPS诱导下A549的ATP及ROS水平
2.3混合培养后A549线粒体膜电位变化 A549+PBS组线粒体膜电位与A549+LPS组比较,差异有统计学意义(P<0.05),而A549+MSCs+LPS组与A549+PBS组比较,差异无统计学意义(P<0.01);A549+LPS组与A549+MSCs+LPS组比较,差异有统计学意义(P<0.01)。证实LPS刺激下AEC线粒体膜电位显著下降,hUC-MSCs可有效提高AEC线粒体膜电位,见图3。

①:A549+MSCs+LPS组;②:A549+LPS组;③:A549+PBS组;④:A549+MSCs组;a:P<0.01
图3 LPS诱导下A549的线粒体膜电位
2.4Western blot测定混合培养后AEC线粒体功能因子的变化 与A549+PBS组比较,LPS+A549组Mfn1、Miro1、NRF1明显降低(P<0.01)。A549+LPS组Mfn1、NRF1、Miro1表达水平显著低于A549+MSCs+LPS组(P<0.01)。A549+PBS组与A549+MSCs组比较Mfn1、Miro1蛋白表达水平显著减低(P<0.01),而NRF1差异无统计学意义(P>0.05)。

A:Western blot结果;B:Mfn1定量分析;C:NRF1定量分析;D:Miro1定量分析;①:A549+MSCs+LPS组;②:A549+LPS组;③:A549+PBS组;④:A549+MSCs组
图4 LPS刺激下AEC 线粒体相关功能蛋白变化
3 讨 论
近年来有关ALI致病机制的研究及治疗手段都取得较大进步,但是其发病率及病死率仍然很高。ALI主要表现为肺血气交换屏障破坏,伴有体内炎症因子和趋化因子水平明显升高[5]。AEC作为肺泡壁的重要组成成分,主要构筑肺血管内皮-肺泡上皮屏障,在ALI进程中起着稳定肺泡结构,减轻全身炎性反应,维持凝血/纤溶平衡,促进肺泡内液体的清除及免疫调节的作用。因此AEC的完整性与ALI的预后和生存密切相关[6]。而线粒体做为一个结构和功能复杂的重要细胞器,在细胞能量代谢和信号通路传导等方面发挥关键作用[7]。研究发现AEC在ALI进程中线粒体发生酶活性改变,钙超载及通透性转换等,随之线粒体融合/分裂、移动、能量代谢等功能受到严重影响,加重AEC的损伤[8]。由此可见,ALI触发的炎性反应与AEC线粒体功能完整性明确相关,修复AEC线粒体的功能将成为ALI治疗的新目标[9]。
截止目前,针对AEC修复的临床治疗策略非常有限,主要集中在MSCs移植治疗[10]。MSCs治疗肺损伤的疗效及安全性已得到了国内外学者一致认可[11]。多项研究认为MSCs治疗ALI的机制主要为3个方面:抗炎作用、旁分泌作用及免疫调节作用[12]。但是MSCs对AEC线粒体功能的影响尚不明确。
研究已证实线粒体通过融合和分裂实现动态变化,融合和分裂间的平衡与氧自由基产生量有关[13]。介导机体线粒体融合的蛋白主要包括Mfnl、Mfn2,其中以Mfn1最常见,位于线粒体外膜[14]。核呼吸因子NRF1的表达受到PRARr-1共激活因子-1α(PGC-1α)的诱导,而且PGC-1α和NRF1二者结合能够直接调控DNA编码过程线粒体氧化磷酸化复合物的表达[15]。另Miro1通过支持膜突出和病灶黏附性的稳定,调节线粒体在前缘位置,以提供局部能量生成促进细胞移动。故认为Miro1做为线粒体动力学相关蛋白,可调控线粒体移动促进细胞修复[16]。
本研究发现:A549细胞与hUC-MSCs直接混合培养后,采用流式细胞仪对A549成功分选,分选后A549细胞线粒体染色呈明亮的强荧光。hUC-MSCs可以调控A549线粒体的能量代谢功能,保护LPS刺激下A549线粒体膜电位,可明显提高A549线粒体Miro1水平,而且此作用与LPS刺激无关,且hUC-MSCs对A549线粒体损伤的修复是多方面的,包括移动、融合分裂、呼吸链功能。
本研究证实了hUC-MSCs可能通过调控AEC的线粒体功能,修复LPS诱导的AEC损伤,但其调节机制还需进一步研究探索。

