哺乳动物内耳扁平上皮的研究进展
贺璐 龚树生 王国鹏
首都医科大学附属北京友谊医院耳鼻咽喉头颈外科(100050北京)
哺乳动物的内耳感觉上皮分布于Corti’s器、椭圆囊斑、球囊斑和半规管的壶腹嵴中,是感受听觉和平衡觉的重要部位。多种损伤因素可以导致内耳感觉上皮不同程度的损伤,轻中度者只有毛细胞损伤,而支持细胞存活;重度者毛细胞和支持细胞都受到损伤、感觉上皮极度退化,由一层缺乏分化特点的扁平细胞所替代,称之为“扁平上皮”[1]。目前关于内耳感觉上皮损伤与修复的研究多集中于轻中度损伤。已有多项研究发现,内耳感觉上皮受到重度损伤后呈现为扁平上皮[2-4],且重度听力损失和/或前庭功能障碍的患者内耳感觉上皮演变为扁平上皮的现象也并不少见[5-7]。因此,针对内耳扁平上皮的病理特点、形成机制及干预的深入研究对于防治重度听力损失和前庭功能障碍具有重要意义。本文将对内耳扁平上皮的病因、特点、形成机制和干预研究进展展开综述。
1 内耳扁平上皮形成的成因
内耳感觉上皮对多种损伤因素敏感,这些损伤因素可直接作用于毛细胞,亦或作用于支持细胞和螺旋神经节细胞(Spiral ganglion neurons,SGNs)[8]。感觉上皮损伤导致内耳扁平上皮形成的常见因素有:
1.1 耳毒性药物:在多个哺乳动物模型中都观察到大剂量耳毒性药物损伤后导致内耳扁平上皮的形成:Raphael等[2]报道豚鼠注射大剂量新霉素后第4天耳蜗即出现扁平上皮。Coco等[9]在大剂量卡那霉素和利尿酸致聋的猫耳蜗中观察到底回的毛细胞消失,形成扁平上皮。Taylor等[3]报道C57小鼠卡那霉素和布美他尼损伤后第4周耳蜗局部扁平上皮形成。
1.2 遗传因素:缝隙连接蛋白26(Connexin26,Cx26)表达异常是非综合征型遗传性耳聋的主要原因之一,Sun等[10]发现不表达Cx26的小鼠生后1月耳蜗毛细胞和支持细胞全部丢失,形成扁平上皮。Pcdh15基因突变与综合征型(Usher’s综合征I型)和非综合征型耳聋(DFNB23)相关,Pcdh15基因敲除小鼠可出现耳蜗感觉上皮扁平化[4]。此外部分Usher I型综合征和常染色体显性遗传性耳蜗发育不良患者可出现Corti’s器感觉上皮完全消失,代之以扁平上皮组织[6]。
1.3 噪声:Cotanche等[11]发现,纯音噪声(123dB)暴露后的鸡内耳听觉上皮被扁平上皮替代。在鼠中同样发现,严重噪声暴露后Corti’s器消失,基底膜被扁平上皮覆盖[12]。
除此之外,梅尼埃病[5]、内耳感染[7]等也可能是内耳扁平上皮形成的原因。
2 内耳扁平上皮的特点
2.1 组织结构:扁平上皮由一层菲薄的上皮细胞构成,细胞的大小形态不一[2],表面被覆微绒毛[13]。此类细胞核大于正常细胞核,细胞器稀少。组织结构有时可呈现极性,形成放射状形态[3]。
2.2 细胞特性
2.2.1 保留细胞间连接:扁平上皮细胞顶端存在紧密连接蛋白ZO-1[2]及缝隙连接蛋白Cx26和Cx30[3]。在正常哺乳动物内耳中,ZO-1主要分布于耳蜗表皮板内外毛细胞和与之相连的支持细胞之间,是构成内外淋巴屏障的重要组成部分。Cx26主要表达于耳蜗基底膜的深面和耳蜗外侧壁,参与内外淋巴液的离子转运[14]。扁平上皮中保留细胞间连接表明即使内耳感觉上皮极度退化,扁平上皮可能仍保留维持内外淋巴屏障完整和离子转运的能力,进而维持内外淋巴电位稳定。
2.2.2 高细胞代谢水平:蛋白激酶C(Protein kinase C,PKC)在糖代谢、细胞分化控制、基因表达调控、长时程抑制等过程中发挥重要作用。Ladrech等[15]发现在耳蜗损伤后的扁平上皮组织中,所有的细胞都高表达PKC,提示扁平上皮细胞可能具有较高的代谢活性。
2.2.3 高有丝分裂水平:Raphael等[2]在豚鼠耳蜗扁平上皮形成早期观察到活跃的有丝分裂现象,细胞周期抑制因子p27kip1也与有丝分裂程度同步变化。上皮细胞的有丝分裂有助于上皮屏障的快速形成。
2.2.4 再生潜能:Wang等[13]报道小鼠椭圆囊感觉上皮损伤后1个月形成的扁平上皮中具有同时表达毛细胞标记物Myosin VIIa和表达Sox2的细胞,且细胞表面在损伤后3个月出现幼稚的纤毛,细胞形态类似II型毛细胞。
2.3 神经支配的变化:Izumikawa等[16]和Shibata等[17]发现,耳蜗扁平上皮中神经纤维出现回缩,SGNs的数目也明显减少,神经元胞体较正常缩小。但在前庭扁平上皮中,神经纤维和神经细胞表现为迟发性退化[13]。人类扁平上皮的神经退化过程可能更加漫长:人类耳蜗扁平上皮标本中SGNs的数量减少,但并不会完全消失[6]。人类前庭终器退化为扁平上皮数年后神经盏和神经纤维的形态仍可基本维持正常[5]。
3 内耳扁平上皮的形成机制
3.1 非哺乳动物内耳扁平上皮的形成机制
鸟类等非哺乳动物内耳毛细胞损伤后具有自我修复的特性。感觉上皮受到重度损伤后,毛细胞和支持细胞均消失。伤后早期,位于基底乳头(即毛细胞和支持细胞所在区域)边缘的透明细胞或立方细胞迁移至感觉上皮区域,形成扁平上皮,继而分裂、分化为成熟的毛细胞和支持细胞[18]。
3.2 哺乳动物内耳扁平上皮的形成机制
哺乳动物内耳扁平上皮的形成机制目前尚不明确,其内耳感觉上皮受损后有可能经历以下一个或几个阶段[19]:
3.2.1 瘢痕形成:耳蜗毛细胞丢失后,周围的Deiters细胞和Pillar细胞顶端扩张,在表皮板封闭毛细胞丢失遗留的空缺,形成“瘢痕”。相似的过程也发生在前庭感觉上皮损伤修复的过程中:前庭毛细胞受损后,线粒体崩解,纤毛融合甚至消失,严重者毛细胞死亡,而前庭感觉上皮中的支持细胞存活,并参与毛细胞残骸的清除。有报道前庭毛细胞损伤后其周围支持细胞形成瘢痕结构填充原毛细胞所在的位置[20]。瘢痕的形成维持了内耳感觉上皮结构的完整,减少内外淋巴电位发生波动,避免毛细胞和神经突触的进一步损伤。瘢痕形成是轻中度损伤情况下的病理变化,当损伤程度较重时,内耳感觉上皮的形态将继续发生以下变化。
3.2.2 感觉上皮重组:Ladrech等[15]在大鼠耳蜗感觉上皮受损后的不同时间点进行扫描电镜观察,发现在瘢痕形成以后,耳蜗外螺旋沟处的上皮细胞和部分间质细胞向内侧迁移覆盖感觉上皮受损形成的瘢痕。这些迁移细胞的上皮标记物E-cadherin和Laminin表达降低,并表达间叶标志物Vimentin,提示这些细胞可能通过上皮-间质转换(Epithelial–mesenchymal transition,EMT)获得了间叶细胞的某些特性。EMT在机体的胚胎发育、组织再生与修复等过程中扮演重要角色,它能够增强细胞的分化潜能、迁徙和凋亡能力[21]。
3.2.3 扁平上皮形成:是内耳感觉上皮退化的最终结果,有关扁平上皮的细胞来源目前还所知甚少,主要有以下两个可能(图1):①原有感觉上皮的支持细胞(Deiter细胞、Pillar细胞、Hensen细胞、Phalangeal细胞、前庭支持细胞)去分化。尽管目前没有直接的证据,但在前庭扁平上皮中观察到某些细胞具有支持细胞的特性(表达支持细胞的标记物Sox2,但不表达毛细胞标记物Myosin VIIa),表明这些扁平细胞有可能是去分化的支持细胞[13]。②原有支持细胞死亡,周围的细胞迁移、分裂形成。在耳蜗感觉上皮重组的阶段中,Tectal细胞、Hensen细胞等Corti’s器外侧的细胞向内迁移覆盖疤痕结构,同时扁平上皮细胞的某些性质也与这些细胞相似,比如高表达Cx26和Cx30,不表达Cx43、乙酰化微管蛋白、KCC4等标记物,细胞外侧壁存在大的缝隙连接等[15]。在部分扁平化的基底膜中观察到,疤痕部位的细胞保留支持细胞的特点,但疤痕部位和扁平上皮区域之间不存在过渡形态的细胞,且扁平上皮区域的细胞核数量与疤痕部位的细胞核数量相比明显减少,提示在扁平上皮形成的过程中部分支持细胞可能死亡。支持细胞在何种情况下会被损伤从而导致扁平上皮的形成,原因并不清楚。在同一个受损的耳蜗中,可能并非所有部位都是扁平上皮[2],甚至在同一个部位,也可以出现仅一小片组织为扁平上皮的情况[3]。在未来的研究中,利用细胞谱系示踪技术特异性标记内耳感觉上皮特定的细胞类型或许可以揭示扁平上皮的形成机制。
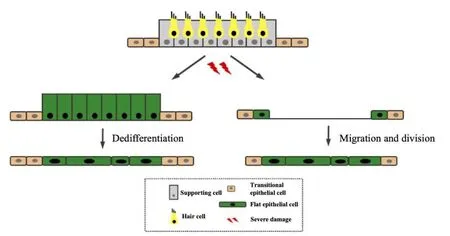
图1 哺乳动物前庭扁平上皮形成的可能机制Fig.1 The potential mechanisms of mammalian vestibular flat epithelium formation
4 干预研究
目前对于扁平上皮的性质和发病机制还没有完全阐明,扁平上皮中的很多细胞已经失去了原有毛细胞或者支持细胞的特性,这些因素使得对内耳“重度损伤”引起的扁平上皮进行干预较“轻中度损伤”时更为棘手。
4.1 基因治疗
内耳基因治疗研究已有20余年的历史,通过特定的途径将携带目的基因的载体导入内耳,进行基因的修饰和表达,能够起到特定的治疗作用[19,22,23]。碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)基因转录调控因子Atoh1是调控毛细胞发育分化的最重要的调控因子之一。外源性过表达Atoh1可以促使支持细胞分化为毛细胞[24,25],然而在耳蜗扁平上皮中过表达Atoh1却并没有出现毛细胞的诱导再生[16],提示表达Atoh1的细胞是否能够转化为毛细胞与该细胞的性质有关。多信号通路的联合调控来诱导重度损伤后毛细胞的再生是未来研究方向之一。
4.2 干细胞治疗
对于支持细胞缺失、组织形态退化的扁平上皮来说,干细胞治疗是一种值得考虑的选择。干细胞具有自我更新能力并可分化为多种类型的细胞,目前已经能够使干细胞在体外成功的分化为毛细胞样细胞,但其在内耳扁平上皮中分化为成熟的毛细胞面临着以下几个困难:①外源性的干细胞无法适应内淋巴液的高钾离子环境,将导致细胞迅速死亡[26];②扁平上皮顶端的紧密连接不利于干细胞的定植;③分化成具有功能的毛细胞可能需要一系列复杂的调控过程。
4.3 神经支配的保护策略
重度耳聋和前庭功能障碍患者的内耳病理可表现为扁平上皮,由于这部分患者是人工耳蜗或前庭植入的潜在对象[27,28],而植入体能够有效工作的前提是内耳有足够数量的神经元细胞和神经纤维,因此,感觉上皮损伤后神经元和神经纤维的保存对于发挥人工耳蜗或人工前庭的功能至关重要。在耳蜗损伤后的扁平上皮中,通过中阶和鼓阶病毒转染扁平上皮和间质细胞诱导基因过表达的方式,促进神经纤维再生是扁平上皮中保存神经支配或诱导神经再生的潜在方法[29,30]。
5 总结与展望
哺乳动物内耳扁平上皮是感觉上皮受到重度损伤后形成的一种病理状态,可见于因耳毒性药物、噪声、遗传等各种因素导致的重度耳聋和/或前庭功能障碍的人类或其他动物的内耳标本中。目前已知扁平上皮细胞分化水平较低,神经支配存在不同程度的退化,但在上皮形成的某些阶段可能具有较高的代谢水平和有丝分裂水平。耳蜗扁平上皮不能够再生,但前庭扁平上皮可能有微弱的毛细胞再生能力。扁平上皮的形成过程中观察到了多种蛋白标记物的变化,对其基因表达变化的研究将有助于深入了解扁平上皮特点和形成机制。如何通过基因调控或干细胞定植分化使扁平上皮再生出具有功能的毛细胞还有待未来的研究去解决。

