骨硬化蛋白与DKK1蛋白在慢性肾脏病-矿物质骨代谢紊乱中的研究进展
张晓宇,王 平,刘爱峰,杨 光,李 洁,李远栋,周 鑫,张 超,吴 思
骨硬化蛋白(sclerostin):由骨细胞高度特异性分泌的骨代谢调节相关糖蛋白,通过与 LPR5/6结合而发挥抑制骨细胞中 Wnt/β-catenin 信号通路的作用。
DKK-1:属于富含半胱氨酸蛋白家族,通过与 LRP5/6和卷曲蛋白相互作用发挥经典Wnt通路拮抗剂的作用,在骨相关疾病的新骨形成过程中发挥着关键作用。
近年来慢性肾脏病(chronic kidney disease, CKD)的发病率及死亡率呈逐年升高的趋势,已成为严重影响人类健康的重要疾病之一。2012年我国一项慢性肾脏病流行病学调查显示,中国成年人群CKD的患病率为10.8%,但成年CKD的知晓率仅为12.5%[1]。慢性肾脏病-矿物质骨代谢紊乱(chronic kidney disease-mineral and bone disorder,CKD-MBD)作为CKD患者的常见并发症与CKD患者的预后及生存质量密切相关。2009年改善全球肾脏病预后组织(Kidney Disease: Improving Global Outcomes, KDIGO)指南将CKD-MBD定义为:CKD-MBD是全身性疾病,具有下列一个或一个以上表现:(1)钙、磷、甲状旁腺素(parathyroid hormone, PTH)或维生素D代谢异常;(2)骨转化、骨矿化、骨容量、骨骼线性生长或骨强度的异常;(3)血管或其他软组织钙化[2]。大量的研究证据表明高磷血症、钙磷乘积增高和甲状旁腺功能亢进可以导致血管钙化和发生心血管事件的危险性增加,与透析患者多种并发症及病死率增加相关。因此对CKD-MBD发病机制的研究已成为近年来的研究热点之一。目前研究认为CKD-MBD的发病机制主要是由于体内钙磷代谢异常以及PTH、维生素D和磷调节激素成纤维细胞生长因子23(fibroblast growth factor, FGF23)在体内稳态失衡所引起[3]。但这些经典的骨代谢标志物如:血钙、血磷、iPTH以及维生素D一般在CKD的后期才出现明显改变[4]。近期研究发现Wnt/β-catenin信号通路的激活对CKD-MBD的发生及进展有重要影响,而骨硬化蛋白(sclerostin)与DKK-1蛋白作为Wnt/β-catenin信号通路的抑制剂可能涉及到CKD-MBD的发病机制[5-6]。故本文将从骨硬化蛋白与DKK1入手对其在CKD-MBD中的作用及意义做一综述,以期为CKDMBD的发病机制及治疗提供新的思路与方法。
1 骨硬化蛋白与DKK-1概述
1.1 骨硬化蛋白 骨硬化蛋白(sclerostin)是Wnt/β-catenin信号通路中重要的抑制剂之一。骨硬化蛋白是由位于人类基因组17q12-21染色体的SOST基因编码的分泌型糖蛋白,其相对分子质量为24 000,包含6个保守的半胱氨酸残基,1个保守的甘氨酸残基,1个用于分泌的信号肽和2个可能的N-糖基化位点[7]。骨硬化蛋白主要由骨细胞表达,对骨组织有高度选择性,研究发现在心脏、主动脉、肝脏以及肾脏虽然并未检测到骨硬化蛋白,但都有SOSTm-RNA的表达[8]。
1.2 DKK-1 DKK-1同样作为Wnt/β-catenin信号通路中重要的抑制剂之一。最早发现于非洲爪蟾蜍胚胎,DKK1基因散在分布于Wnt通路组件的上游[9]。人类DKK1基因位于10号染色体10q11上,由266个氨基酸组成,其相对分子质量在29 000左右[10]。DKK家族共包括DKK1、DKK2、DKK3、DKK4,共4个成员,不同的DKKS对Wnt/β-catenin信号通路的调节作用不同。DKK1在Wnt/β-catenin信号通路中主要发挥抑制作用,而DKK2在Wnt/β-catenin信号通路中可有激动和抑制的双重调节作用,DKK3可减少β-catenin在细胞质和包核中的聚集,主要参与调控非经典的JNK信号通路,而在Wnt/β-catenin信号通路中的作用尚有待进一步研究,DKK4与DKK1相同也可对Wnt/β-catenin信号通路产生抑制作用。
1.3 Wnt信号通路 Wnts蛋白是由原癌基因Wnt编码的一类富含半胱氨酸的分泌型糖蛋白,能够调控细胞的增殖、分化、凋亡与极性。Wnt蛋白可以通过旁分泌和自分泌方式发挥作用,在细胞水平上Wnts可激活下游诸多级联反应,激活多种细胞内信号途径,包括经典的Wnt/β-catenin信号途径和非经典Wnt信号途径。其中Wnt/β-catenin信号途径研究最为广泛,目前已知至少存在8个Wnt蛋白可激活β-catenin信号[11]。Wnt/β-catenin信号途径的活性主要取决于细胞质中活性β-catenin的含量[12]。Wnt蛋白可与膜受体Frizzled(Fzd)以及共同受体低密度脂蛋白受体相关蛋白LRP5和LRP6结合,抑制细胞内β-catenin的磷酸化,使β-catenin以持续活化的状态进入核内,与核内转录因子(T-cell factor, TFC)和 lymphoid enhancer-binding factor(LEF)结合,激活靶基因的转录作用。
骨硬化蛋白与DKK-1作为Wnt/β-catenin信号通路的抑制蛋白,主要通过与LRP5/6结合从而阻碍具有活性的Wnt受体复合物的形成,发挥抑制Wnt/β-catenin信号通路的作用。研究发现,SOST除与LRP5/6结合外,还可与LRP4结合增强对Wnt/β-catenin通路的抑制作用[13-14]。DKK1的受体除LRP5/6外,还可通过与含kringle结构域的Kremen蛋白受体间接与LRP5/6结合,形成三聚体,抑制Wnt蛋白信号内传导,阻断Wnt/β-catenin信号通路。众多研究表明,Wnt/β-catenin信号通路的激活与CKDMBD的发病密切相关,尤其与经典骨代谢标记物异常、血管及其他软组织钙化及骨代谢异常等方面关系密切。因此,本文将从以上三方面对骨硬化蛋白及DKK-1在CKD-MBD中的表达与作用进行综述。
2 骨硬化蛋白与DKK-1在CKD-MBD患者中的表达及作用
2.1 骨硬化蛋白及DKK-1与CKD-MBD患者经典骨代谢标记物的相关性 钙磷代谢紊乱、继发性甲旁亢以及维生素D代谢异常是CKD-MBD的重要表现之一。CKD患者随着病情的进展由于肾脏排泄功能障碍及肾脏结构损伤导致肾脏排磷及1-α羟化酶生成减少,出现低钙高磷血症,从而刺激甲状旁腺分泌PTH增多。高水平的iPTH往往与CKD患者心血管疾病发病率、死亡率及骨折密切相关。iPTH、维生素D及血清钙磷水平作为经典的骨代谢标志物一般在CKD的后期才出现明显改变,这对于CKDMBD的诊断及干预有一定的滞后性。近期大量实验研究表明,骨硬化蛋白与CKD-MBD患者经典骨代谢标记物存在明显相关。Pelletierin等[15]通过对90例CKD患者的血清硬化蛋白分析发现,骨硬化蛋白与CKD患者的肾小球滤过率及iPTH呈负相关,与CKD患者的年龄、血磷水平呈正相关,并且结果提示,患者的血清骨硬化蛋白水平在CKD3期时开始出现升高,CKD5期时患者的血清骨硬化蛋白水平是正常者的4倍。与骨硬化蛋白不同,有研究发现DKK-1与任何组织学骨参数及临床参数之间不存在相关性[16]。Yamada[17]等人通过对74名腹膜透析患者的横断面研究发现,患者血清骨硬化蛋白水平与PTH浓度相关,而DKK-1水平仅与血小板水平相关,与其他骨代谢标记物并无关联。Geert等[18]通过分析308例CKD患者的血清骨硬化蛋白及DKK-1水平发现,血清骨硬化蛋白水平会随着CKD的严重程度而增加,并与血清PTH浓度及血清1,25-(OH)2VitD3水平呈明显负相关性,且在CKD晚期可出现血清高骨硬化蛋白水平与高PTH水平共存,而血清DKK-1水平与CKD患者肾功能及矿物质代谢参数未见关联,同时该研究发现血清DKK-1水平与骨硬化蛋白水平无关,提示两者存在不同的起源位点或是不同的调节机制,其具体机制尚有待于进一步探究。以上研究提示CKD-MBD患者血清骨硬化蛋白水平随着肾功能的降低出现升高并与PTH、血清钙磷及维生素D水平等经典骨代谢标记物存在相关性,表明血清SOST可作为CKD-MBD的生物标记物,对CKD-MBD的早期诊断及干预有重要意义,血清骨硬化蛋白水平的升高与血清PTH水平的相关性及其具体调节机制还需进一步研究。关于CKD-MBD患者血清DKK-1水平与经典骨代谢标记物的相关性目前看法不尽相同,尚需更多的实验研究加以证实。
2.2 骨硬化蛋白及DKK-1与CKD-MBD患者血管及其他软组织钙化的相关性 CKD患者软组织钙化主要涉及心脏瓣膜及血管的钙化,是CKD-MBD患者的重要临床表现,也是CKD患者死亡的重要原因之一。有研究显示CKDMBD患者是否存在主动脉瓣钙化及主动脉瓣钙化严重程度与CKD患者的死亡率密切相关[19]。血管钙化的形成一般认为是由于机体内钙磷代谢紊乱导致细胞和组织间钙磷结晶沉积而形成[20]。研究表明,Wnt通路参与了血管及瓣膜钙化,并在钙化及钙化防御中呈过表达[21],骨硬化蛋白及DKK-1作为Wnt信号通路的抑制剂,通过抑制Wnt信号通路,从而影响了CKD-MBD患者软组织钙化的病理过程。目前关于骨硬化蛋白及DKK-1与血管钙化相关性的结论尚未统一,Brandenburg等通过对67名慢性肾脏病血液透析患者的研究发现,血清骨硬化蛋白水平与主动脉瓣钙化呈强关联,血管钙化严重的患者其血清骨硬化蛋白水平更高[22]。Morena等对241名非透析的CKD患者进行横断面研究分析后发现,冠状动脉硬化的风险会随者血清骨硬化蛋白水平的增加而升高,并且未观察到血清DKK-1水平与冠状动脉硬化之间的相关性[23]。与此相反,Lee等[24]研究发现CKD血液透析患者骨硬化蛋白与DKK-1水平与腹主动脉钙化水平呈负相关,且血清SOST水平是腹主动脉钙化的独立决定因素,提示SOST可能是对抗血管钙化的保护性因素。Claes等通过对154例CKD患者进行横断面分析后发现,主动脉硬化患者的血清骨硬化蛋白水平更高,然而在多变量回归分析中,此关联相反,低血清骨硬化蛋白水平是主动脉钙化的独立危险因素[25]。这可能与纳入的人群不同有关,且血清骨硬化蛋白的升高可抑制Wnt信号通路减轻血管钙化,同时血清骨硬化蛋白还可通过骨-血管轴参与血管钙化的调控[26]。因此,关于血清骨硬化蛋白是否是软组织钙化的保护因素尚需进一步实验研究来证明。而在DKK-1与软组织钙化的相关性方面研究较少,Thambiah等通过对78例CKD患者研究发现,血清DKK-1水平与动脉硬化指数呈负相关[27],而Morena等则未观察到血清DKK-1水平与冠状动脉硬化之间的相关性[23]。这表明关于DKK-1与CKD-MBD患者软组织钙化之间的相关性仍需要进行更多的探究。
2.3 骨硬化蛋白及DKK-1与CKD-MBD患者骨代谢异常之间的相关性 CKD在引起体内矿物质代谢紊乱后,可导致骨转化、骨矿化、骨容量、骨骼线性生长或骨强度的异常,从而出现骨生长障碍、骨畸形、骨痛以及骨折等临床表现。大量研究显示Wnt信号通路在CKD-MBD骨代谢异常发病过程以及维持骨形成和骨吸收的动态平衡方面有重要意义。Rodda[28]等剔除早期成骨细胞祖细胞中的β-catenin基因后发现成骨细胞可向软骨细胞分化,而β-catenin基因在成骨细胞前体中的稳定作用使骨基质分泌成骨细胞的分化提前,提示Wnt/β-catenin信号通路可促进骨形成,抑制骨细胞凋亡。另一方面在敲除破骨细胞中的β-catenin基因后可使破骨细胞的数目增加并加重骨吸收的程度[29],说明Wnt/β-catenin信号通路可抑制骨细胞的分化和骨吸收。因此骨硬化蛋白与DKK-1可通过抑制Wnt/β-catenin信号通路调节CKD-MBD患者的骨稳态。CKD患者血清中骨硬化蛋白的表达水平会随着肾小球滤过率的降低而增加,血清中骨硬化蛋白的高表达可抑制Wnt/β-catenin信号通路,从而促进骨吸收,降低骨形成,调节骨量。Thambiah等在实验中发现CKD患者血清中骨硬化蛋白的水平与骨形成呈负相关,与骨密度呈正相关[28]。同样Ryan等[30]在敲除小鼠骨硬化蛋白编码基因(SOST)后发现缺失SOST基因的小鼠成骨细胞增加破骨细胞减少,矿物质密度及含量增加,尿钙的排泄减少。这表明骨硬化蛋白可影响骨形成和矿化。SM Moe在对CKD大鼠应用抗骨硬化蛋白抗体治疗时发现在低PTH水平的大鼠中,抗骨硬化蛋白抗体的治疗增加了CKD大鼠骨小梁体积和骨矿化面积,但在高PTH的大鼠中则未见到明显改变[31]。这为CKD-MBD骨代谢紊乱的治疗提供了新的思路,同时我们需要进一步的实验来证实骨硬化蛋白抗体在低转运性骨病治疗中的作用。目前关于DKK-1在CKD患者血清中表达的研究结论不尽相同,但DKK-1作为Wnt/β-catenin信号通路的抑制剂同样参与CKD-MBD患者骨代谢异常发病过程。Thambiah等在实验中发现CKD患者血清中DKK1水平升高,并与股骨颈密度呈负相关[27]。Fang等[32]通过对CKD2期糖尿病小鼠的研究发现,与非CKD糖尿病小鼠相比,CKD2期小鼠循环中DKK-1水平增加,在肾损伤后通过利用单克隆抗体在CKD2期小鼠中中和Dkk-1可刺激骨形成速率,使小鼠骨形成和骨量增加,纠正骨营养不良,同时降低了循环中SOST的水平。以上研究表明,骨硬化蛋白及DKK-1与CKD-MBD患者骨代谢异常之间是明显相关的,骨硬化蛋白及DKK-1通过抑制Wnt/β-catenin信号通路调节CKDMBD骨吸收与骨形成的动态平衡,使骨形成抑制而骨吸收在增加,骨量降低。而骨硬化蛋白及DKK-1蛋白抗体的治疗在动物实验中呈现有效性,表明其可作为CKD-MBD骨代谢紊乱治疗的新方向,但仍需更多的临床试验来验证,见图1。
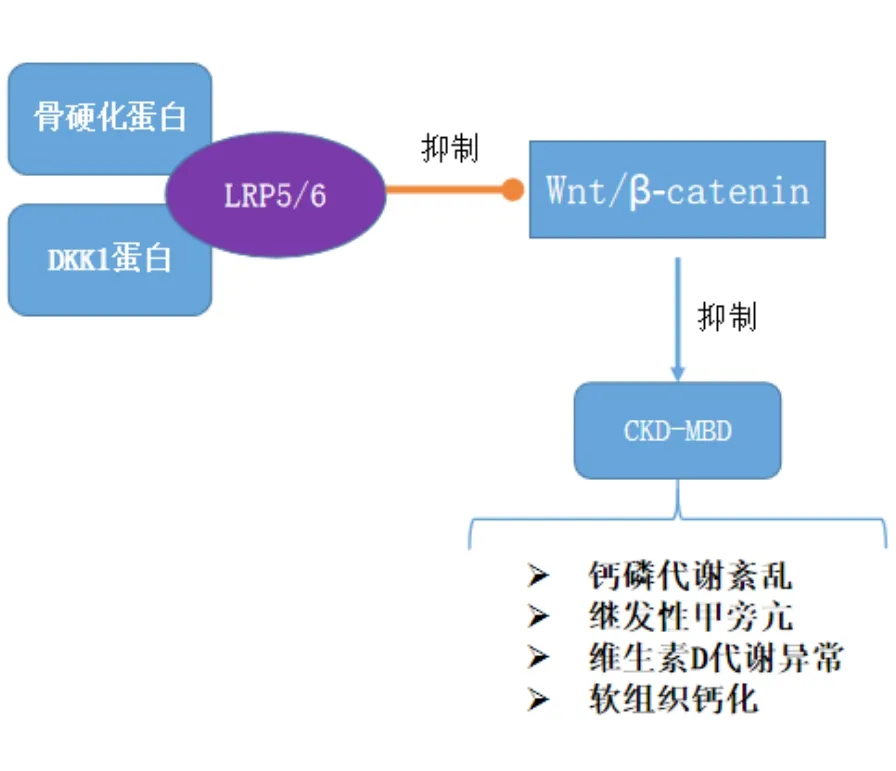
图1 模示图
3 结语与展望
骨硬化蛋白及DKK-1在CKD-MBD的发病机制及临床诊疗中均有重要作用,更多的临床试验及动物实验发现骨硬化蛋白在CKD-MBD钙磷代谢紊乱、软组织钙化及骨代谢异常方面均存在明显相关性,而DKK-1在CKD-MBD中的影响则更多地体现在骨代谢异常方面。因此,骨硬化蛋白可作为一种新型生物标记物参与CKD-MBD的早期诊断,而DKK-1在CKD-MBD中的作用研究尚不充足,还需要大量的研究来进一步证实。除此之外,我们仍需更多的临床研究来证实骨硬化蛋白及DKK-1蛋白抗体在治疗CKD-MBD骨代谢紊乱中的有效性,更好的选择新型生物标记物作为药物干预治疗的靶点,调节骨重建过程中吸收和生成之间的平衡、成骨与破骨细胞之间的稳态、进而调节骨量,从而为更好的防治CKD-MBD提供治疗新思路。

