青蛤酶解多肽对RAW264.7巨噬细胞的免疫调节作用
叶盛旺,杨最素,李 维,唐云平,黄芳芳,张小军,余方苗,,*,丁国芳,
(1.浙江海洋大学食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022;2.浙江省海洋水产研究所,浙江 舟山 316021)
生物活性肽是一类含有2~20 个氨基酸的特异性蛋白片段,具有多种潜在的生物学活性[1]。近年来研究发现,生物活性肽在抗肿瘤、抗氧化及免疫调节等方面表现出了重要的生理功能。如贾盈露等[2]通过蛋白酶水解的方法从双齿围沙蚕中制备了双齿围沙蚕多肽(Ile-Glu-Pro-Gly-Thr-Val-Gly-Met-Met-Phe),活性研究表明,其对肺癌A549细胞的增殖具有明显的抑制作用。赵卉双[3]用碱性蛋白酶水解大黄鱼鱼卵水溶性蛋白,经过分离纯化得到4 种抗氧化肽(NPCASR、QESEEY、NEVGA、AMCC),通过观察其对H2O2诱导的HepG-2细胞氧化损伤的保护作用发现,4 种抗氧化肽的添加可有效的提高细胞存活率,且能明显促进细胞内HO-1蛋白的表达。邓志程等[4]以马氏珠母贝为原料,模拟胃肠道消化的方式对其进行酶解,经多级分离纯化后得到两种寡肽(Ala-Arg/Pro-Met、Val-Arg),通过体外研究发现两种寡肽对于脾淋巴细胞的增殖和巨噬细胞吞噬功能的提高都具有明显的促进作用,表现出了免疫调节作用的潜在价值。故本研究以RAW264.7巨噬细胞相对增殖率为指标,从青蛤中制备具有免疫调节作用的生物活性肽。
青蛤是属帘蛤科的一种双壳软体动物,是我国贝类水产养殖中最重要的双壳贝类之一[5]。近年来的研究表明,青蛤多糖在抗氧化、抗肿瘤及保肝护肝等方面都具有良好的生物活性[6-8],但关于青蛤多肽(Cyclina Sinensis peptides,CSP)的研究却鲜见报道。本实验在前期筛选出的最佳酶及最佳酶解条件的基础上,以青蛤为原料,通过胃蛋白酶酶解和超滤的方法制备青蛤多肽,而后根据其对RAW264.7巨噬细胞生长与增殖、细胞形态、吞噬作用、一氧化氮(nitric oxide,NO)分泌和细胞因子分泌及细胞周期的影响,评价其免疫调节作用,以期为青蛤多肽的进一步研究提供实验依据。
1 材料与方法
1.1 材料与试剂
青蛤 舟山市老碶菜场;小鼠单核巨噬细胞系RAW264.7 中科院上海细胞所。
胃蛋白酶 亚太恒信科技中心(北京)有限公司;DMEM培养基 美国Gibco公司;脂多糖(lipopolysaccharides,LPS)、噻唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;NO试剂盒、白介素(interleukin,IL)-1β试剂盒、IL-6试剂盒、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)试剂盒 南京建成生物工程研究所;中性红细胞增殖及细胞毒性检测试剂盒 上海碧云天生物技术有限公司;细胞周期检测试剂盒 上海贝博生物。其余试剂均为国产分析纯。
1.2 仪器与设备
ZHJH-C1209C型超净工作台 上海智诚分析仪器制造公司;Forma 3111型CO2培养箱 美国Thermo公司;SpectraMax M2多功能酶标仪 美国Molecular Devices公司;CKX4型倒置显微镜 日本Olympus公司;CF16RXⅡ型高速低温离心机 日本日立公司;Easy Cyte6 HT-2L流式细胞仪 美国Millipore公司;ALPHA 1-4/LD plus型冷冻干燥机 德国Christ公司;BONA-GM-18型纳滤膜分离实验机 济南博纳生物技术有限公司。
1.3 方法
1.3.1 细胞培养
小鼠单核巨噬细胞系RAW264.7于DMEM高糖培养基(含体积分数10%胎牛血清和双抗)中培养,37 ℃、5% CO2培养箱中孵育,待细胞长至培养瓶80%以上时进行传代,选取对数生长期细胞进行实验。
1.3.2 CSP酶解液的制备
青蛤去壳取肉,洗净,匀浆并用异丙醇脱脂6 h,于12 000 r/min、4 ℃离心15 min,收集沉淀洗净备用;称取适量的沉淀,根据前期筛选出的最佳酶种及最佳酶解条件,选用胃蛋白酶,在温度42 ℃、pH 2.0、料液比1∶10、加酶量1 600 U/g条件下酶解8 h;酶解完成后于沸水中水浴15 min,12 000 r/min、4 ℃离心15 min,仔细收集上清液即为CSP酶解液。
1.3.3 超滤酶解液的制备
选取孔径为30、10、5 kDa和3 kDa的超滤膜对1.3.2节所得的CSP酶解液超滤,收集大于30 kDa、10~30 kDa、5~10 kDa、3~5 kDa、小于3 kDa 5 个分子质量段的超滤液分别命名为CSP-1、CSP-2、CSP-3、CSP-4、CSP-5,再将CSP-5组分经孔径为150 Da的纳滤膜进行脱盐处理。冷冻干燥后,以100 μg/mL的质量浓度,采用MTT法检测各组分对RAW264.7细胞生长与增殖的影响,同时设置空白对照组(完全培养液、细胞),筛选出与空白对照组相比,相对增殖率最高的组分进行免疫调节作用研究。参考陈榕芳等[9]的方法,按公式(1)计算RAW264.7细胞的相对增殖率。

1.3.4 CSP对RAW264.7巨噬细胞免疫调节作用的研究
1.3.4.1 MTT细胞增殖实验
参照Deng Chao等[10]的方法,并稍作修改。细胞浓度约为1×104个/mL,每孔200 μL接种于96孔板,37 ℃、5% CO2培养箱孵育12 h后弃去培养液,加入质量浓度分别为1 000、500、250、100、50、25、12.5 μg/mL的CSP,同时设置空白对照组(完全培养液、细胞)和1 μg/mL的LPS阳性对照组;孵育36 h后吸去上清液,每孔加入200 μL 5 mg/mL MTT,于培养箱中继续孵育4 h;吸出上清液,每孔加入150 μL的DMSO,振荡10 min,用酶标仪在490 nm波长处测定OD值,按公式(1)计算相对增殖率,根据相对增殖率的大小确定后续实验所选取的CSP质量浓度。每个实验组设置5 个重复。
1.3.4.2 倒置显微镜观察细胞形态
细胞浓度约为1×104个/mL,每孔2 mL接种于6 孔板中,37 ℃、5% CO2培养箱孵育12 h后,吸出培养液,加入质量浓度分别为100、50、25 μg/mL的CSP,以LPS(1 μg/mL)为阳性对照组,同时设置空白对照组;孵育36 h后,用倒置显微镜观察并拍照。
1.3.4.3 中性红吞噬实验
参照Yu Jie等[11]的方法,并稍作修改。细胞浓度约为1×104个/mL,每孔200 μL接种于96 孔板,37 ℃、5% CO2培养箱孵育12 h后,吸出培养液,分别加入质量浓度为100、50、25 μg/mL的CSP,同时设置LPS(1 μg/mL)阳性对照组和空白对照组;孵育36 h后,吸出上清液,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2 次,每孔加入不含NaHCO3的培养液180 μL和中性红染液20 μL,于培养箱内继续孵育3 h;弃除上清液,再用PBS洗涤2 次,每孔加入200 μL裂解液,室温摇床裂解10 min,用酶标仪在540 nm波长处测定OD值,按公式(2)计算吞噬指数。

1.3.4.4 CSP对RAW264.7细胞NO分泌量的影响
参照Lee等[12]的方法,并稍作修改。实验分组及前期处理步骤同1.3.4.3节,各组分别加药物培养36 h后,收集上清液,按试剂盒要求操作,测定各组份中NO的分泌量。
1.3.4.5 CSP对RAW264.7细胞IL-1β、IL-6和TNF-α分泌量的影响
实验分组及细胞前期处理步骤与1.3.4.3节相同,各组分别加入药物培养36 h后,用无菌管收集培养上清液;2 000~3 000 r/min离心20 min,再次收集上清液,并按酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒要求操作,检测各组上清液中IL-1β、IL-6和TNF-α等细胞因子的含量。
1.3.4.6 CSP对RAW264.7细胞周期的影响
细胞浓度约为1×104个/mL,每瓶2 mL接种于25 mL培养瓶中,12 h后吸出培养液,分别加入质量浓度为100、50、25 μg/mL的CSP,同时设置LPS(1 μg/mL)阳性对照组和空白对照组,继续孵育36 h;弃去营养液,用PBS洗涤2 次,吹散细胞,1 000 r/min离心5 min收集;加入冷的体积分数75%乙醇溶液再次吹散细胞,放入-20 ℃固定1 h;离心除去乙醇,PBS洗涤2 次,300 μL冷的PBS重悬细胞;加入RNase A溶液20 μL,37 ℃水浴30 min,400 目筛网过滤;加入碘化丙啶染液400 μL,4 ℃避光孵育30 min,流式细胞仪检测其结果。
1.4 数据统计分析
2 结果与分析
2.1 CSP超滤组分对RAW264.7细胞增殖的影响

图1 CSP超滤组分对RAW264.7细胞增殖的影响Fig. 1 Effects of CSP ultrafiltration fractions on the proliferation of RAW264.7 cells
从图1中可看出,CSP各超滤组分对RAW264.7细胞的增殖都有一定的促进作用;与空白对照组相比,CSP-1组分对RAW264.7细胞增殖的促进作用具有显著性差异(P<0.05);CSP-3、CSP-4、CSP-5组分对RAW264.7细胞的促进作用具有极显著性差异(P<0.01),且CSP-5组分对RAW264.7细胞的相对增殖率最高,因此选择CSP-5进一步研究。
2.2 CSP-5对RAW264.7巨噬细胞的免疫调节作用
2.2.1 MTT细胞增殖实验结果
由图2可知,LPS和CSP-5均能促进RAW264.7细胞的增殖,但当CSP-5质量浓度过高或过低时对细胞增殖的影响并无显著性差异。当CSP-5质量浓度为25 μg/mL时,对RAW264.7细胞增殖影响显著(P<0.05);当CSP-5质量浓度为100 μg/mL时,对RAW264.7细胞增殖的影响极显著(P<0.01),且相对增殖率最大为(97.56±5.26)%。随着CSP-5质量浓度的继续增加,相对增殖率开始骤降。当质量浓度升至250 μg/mL时,与空白对照组相比,CSP-5对RAW264.7细胞增殖的影响已无统计学意义,故选择100、50、25 μg/mL CSP-5进行免疫调节机制的进一步研究。
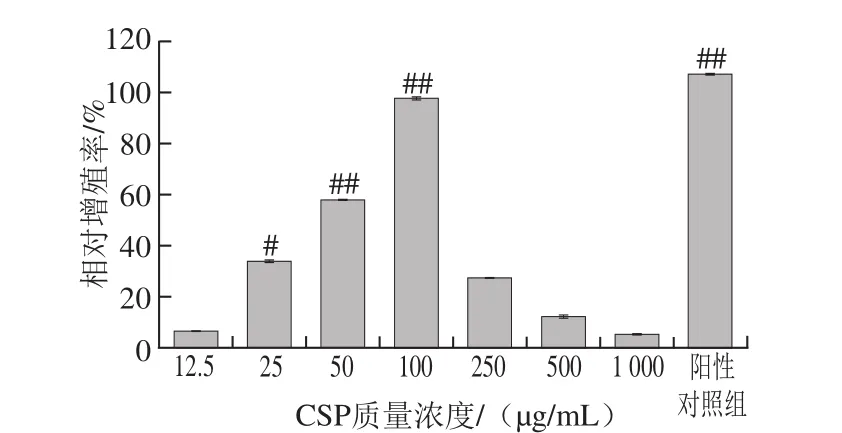
图2 CSP-5对RAW264.7细胞增殖能力的影响Fig. 2 Effect of different concentrations of CSP-5 on the proliferation of RAW264.7 cells
2.2.2 倒置显微镜观察细胞形态
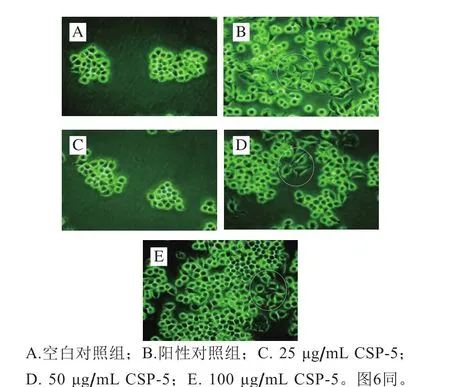
图3 倒置显微镜观察RAW264.7细胞形态(×400)Fig. 3 Morphology of RAW264.7 cells observed by inverted microscope (× 400)
由图3可看出,与空白组相比,经CSP-5和LPS处理后的细胞在形态和数目上都发生了明显的变化。空白对照组细胞数较少,细胞排列紧密且形态良好,无明显突起及棱角;经CSP-5作用后,细胞个数明显增加,且随着CSP-5质量浓度的增加,分化及出现伪足的细胞数也明显增加;100 μg/mL CSP-5组RAW264.7细胞的个数与LPS组相当,且部分细胞已开始分化,呈现不规则形状。
2.2.3 中性红吞噬实验结果
由图4可知,与空白对照组相比,LPS和CSP-5均能显著性增强RAW264.7细胞的吞噬能力,且随着质量浓度的增加,CSP-5对RAW264.7细胞吞噬能力的刺激作用也在不断地增加;当质量浓度增至100 μg/mL时,吞噬指数达到2.17±0.04,表明CSP-5能有效激活RAW264.7细胞,从而增强机体的免疫力。

图4 CSP-5对RAW264.7细胞吞噬能力的影响Fig. 4 Effect of different concentrations of CSP-5 on the phagocytosis of RAW264.7 cells
2.2.4 CSP-5对RAW264.7细胞NO分泌量的影响
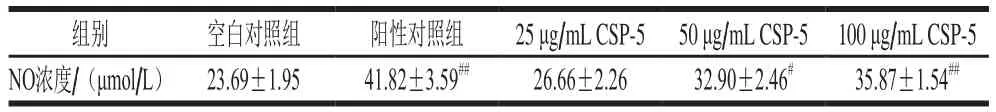
表1 CSP-5对RAW264.7细胞NO分泌量的影响(n=3)Table 1 Effect of different concentrations of CSP-5 on NO secretion in RAW264.7 cells (n= 3)
由表1可知,CSP-5对RAW264.7细胞NO分泌量的刺激作用呈剂量相关性,CSP-5质量浓度为25 μg/mL时,细胞NO的分泌量无明显增加;CSP-5质量浓度为50 μg/mL时,细胞NO分泌量的增加具有显著性差异(P<0.05);CSP-5质量浓度为100 μg/mL时,细胞NO分泌量的增加具有极显著性差异(P<0.01),但弱于LPS组。
2.2.5 CSP-5对RAW264.7细胞IL-1β、IL-6、TNF-α分泌量的影响
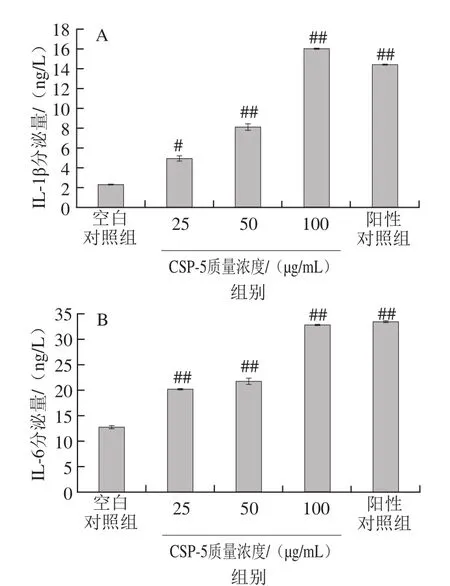

图5 CSP-5对RAW264.7细胞IL-1β(A)、IL-6(B)、TNF-α(C)分泌量的影响Fig. 5 Effect of different concentrations of CSP-5 on the secretion of IL-1β (A), IL-6 (B) and TNF-α (C) in RAW264.7 cells
由图5可看出,CSP-5对RAW264.7细胞培养上清液中细胞因子分泌量的影响具有剂量相关性。经50、1 0 0 μ g/m L C S P-5处理后细胞培养上清液中细胞因子I L-1 β、I L-6和T N F-α的分泌量与空白对照组相比都极显著性增加(P<0.01);而当CSP-5质量浓度为100 μg/mL时,培养上清液中IL-1β的分泌量已高于LPS阳性对照组,且细胞因子IL-6的分泌量也与其相当。
2.2.6 CSP-5对RAW264.7细胞周期的影响


图6 RAW264.7细胞周期的变化Fig. 6 Changes in cell cycle of RAW264.7 cells

图7 CSP-5对RAW264.7细胞周期的影响Fig. 7 Effect of different concentrations of CSP-5 on cell cycle of RAW264.7 cells
由图6、7可知,与空白对照组相比,经CSP-5刺激36 h后处于G0/G1期的细胞比例有所上升,处于S期及G2/M期的细胞在总细胞数中的占比有所下降,且占比变化趋势呈剂量相关性。CSP-5低质量浓度时各期的比例与空白对照组相比无明显变化,当CSP-5质量浓度达到100 μg/mL时各期的变化趋势接近于LPS阳性对照组。
3 讨 论
免疫系统是一种存在于所有脊椎动物中复杂的防御系统,由多种器官、组织、细胞及因子组成,涉及多种疾病(如肿瘤的发生,细菌、病菌的感染)的病因学及病理生理学机制,分为先天免疫和适应性免疫[19-20]。先天免疫是机体识别“自我”和“非自我”,清除异物,保护机体健康的第一步[21],其主要由巨噬细胞、粒细胞及多种单核细胞组成,且在抵御细菌或病毒感染以及组织炎症时能不断地自我进化[22]。免疫组成细胞中,巨噬细胞有着独一无二的作用,具有多种生物学功能如吞噬、监视及靶向生物体的破坏等,是激活先天免疫应答和诱导适应性免疫应答的重要桥梁[23-24],因此巨噬细胞也常作为免疫调节模型来评价活性物质在免疫调节方面所具有的生物学作用。RAW264.7小鼠单核巨噬细胞系曾被用来描述各种活性物质在分子水平的免疫调节作用[25];故本实验以RAW264.7巨噬细胞为模型,研究青蛤多肽在体外的免疫调节活性。
免疫调节是指在免疫调节剂的参与下,免疫系统对自身免疫应答控制和调节的过程,其目的是保持机体的稳定和内平衡。其中多肽因具有生物活性高、毒性低、易吸收等特点,近年来在免疫调节剂开发等方面受到了越来越多国内外研究者的重视。卜天等[26]采用MTT法,以小鼠腹腔巨噬细胞的活性为指标,筛选出温度62.5 ℃、pH 9.5、加酶量0.08%、酶解时间8 h为胰蛋白酶水解虾蛄的最佳酶解条件;中性红吞噬实验结果表明,在质量浓度为20、25 mg/mL的条件下,虾蛄多肽对小鼠腹腔巨噬细胞吞噬能力的增强具有显著的作用。纪丽娜[27]用中性蛋白酶和木瓜蛋白酶酶解金枪鱼头肉,经分离纯化后作用于小鼠腹腔巨噬细胞,结果表明0.01 mg/mL的酶解液对于巨噬细胞活性和吞噬功能的增强均具有显著的效果;Griess法和ELISA法检测结果显示,酶解液对于巨噬细胞NO、TNF-α、IL-6分泌的影响均无显著性差异。Wu Wenjia等[28]采用酶解的方法,经分离纯化后从麦胚球蛋白中制备出一种新型寡肽(Glu-Cys-Phe-Ser-Thr-Ala),当质量浓度为20、40、80 μg/mL时,此寡肽能通过TLR2和TLR4模式识别受体激活巨噬细胞RAW264.7,巨噬细胞被激活后,其吞噬能力显著增强,且NO、IL-6、TNF-α和活性氧的分泌量也显著增加。多肽生物活性的影响因素主要有氨基酸序列、肽链的长度及分子质量等,且多数研究结果表明,小分子肽较大分子肽具有更强的生物活性[29-30],这可能与小分子肽在体内易吸收、不易被破坏等优势相关。本实验中CSP-1为酶解液中分子质量大于30 kDa的所有物质,不是单一的组分,其对于RAW264.7细胞的增殖效果优于CSP-2可能是由于各组分之间协同作用的结果,而CSP-2为分子质量在10~30 kDa的组分,成分相对单一,免疫活性物质的含量可能相对较少,所以作用效果不如CSP-1混合组分高。
LPS为革兰氏阴性菌产生的病原体,具有激活巨噬细胞、诱导免疫应答的作用,在免疫调节评价实验中常作为阳性对照出现[31]。活化后的巨噬细胞其吞噬能力明显增强,且能分泌大量生物活性物质如NO和多种细胞因子如TNF-α、IL-1β、IL-6等[32-33];因此,巨噬细胞的吞噬功能、NO及相关细胞因子的分泌量可作为评价CSP是否具有激活巨噬细胞从而增强机体免疫力的实验依据。巨噬细胞作为吞噬细胞,其活性衡量的一项重要依据就是吞噬能力的大小[34],而中性红吞噬实验是检测其吞噬能力常用的方法[35];本实验结果显示,经CSP-5作用后RAW264.7细胞的吞噬作用与空白对照组相比明显增强,且与LPS作用后的细胞变化趋势保持一致。NO是精氨酸通过一氧化氮合酶合成的重要炎症介质,也是巨噬细胞发挥吞噬功能的基本条件[36];经LPS和CSP-5作用后巨噬细胞NO分泌量也明显增加,与其吞噬增强的研究结果相吻合。为了进一步验证CSP-5的免疫调节作用,本实验还检测了RAW264.7细胞细胞因子TNF-α、IL-1β和IL-6的分泌量。细胞因子作为一种重要的信号传导介质,在机体发生炎症时,能诱导巨噬细胞向炎症部位移动,且有助于机体适应性免疫的产生,预防炎症的恶化及组织损伤;由图4、5可知,经CSP-5作用后,RAW264.7细胞分泌细胞因子的能力得到了明显的增强,作用效果呈剂量相关性,低剂量时促进作用不明显,当质量浓度达到100 μg/mL时,促进作用接近于阳性对照组,这表明CSP-5具有增强炎性因子分泌的作用。同时,本实验还进行了细胞周期相关研究,研究结果表明,随着CSP-5质量浓度的增加,处于G0/G1期的细胞比例上升,S期比例有所下降,由此可得,经CSP-5作用后的巨噬细胞主要在G0/G1期发生增殖,而G0/G1期也是RNA及蛋白质的合成期;因相关蛋白的表达量增加,所以其吞噬、NO及细胞因子的分泌能力也的到了相应的增强。综上所述,CSP-5具有激活巨噬细胞、增强机体免疫力的潜在作用。

