双歧杆菌和乳酸菌β-半乳糖苷酶转糖基作用的研究进展
姜陈波,杭 锋*
(乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司乳业研究院,上海 200436)
半乳糖苷酶(β-galactosidase,β-gal)可作为生物催化剂水解乳糖,广泛应用于乳品加工、食品加工、制药领域等[1]。除了水解反应以外,具有转糖基活力的β-gal还能参与转糖基反应,产生益生元低聚半乳糖(galactooligosaccharides,GOS)[2]。GOS因其具有显著调节肠道菌群、提高有益菌双歧杆菌的数量和代谢活力、减少有害菌吸附、调节肠道免疫系统以及治疗代谢疾病的作用,在益生元领域引起广泛关注[3]。
商业GOS一般以乳糖为底物,通过β-gal转糖基反应,产生具有不同聚合度和糖苷键的复杂GOS混合物,该过程依赖于酶的来源和作用条件[4]。β-gal在自然界中普遍存在,其来源包括动物、植物和微生物,一般而言微生物来源β-gal的生产率更高,可以显著降低生产成本[5]。因此,尽管在多种来源中发现β-gal,仍普遍采用微生物源β-gal合成GOS[6]。微生物源β-gal包括曲霉属(Aspergillus)、克鲁维酵母属(Kluyveromyces)、乳杆菌属(Lactobacillus)以及双歧杆菌属(Bifidobacterium)等,这些来源的β-gal已作为生物催化剂应用于GOS的合成反应[7]。
在多种微生物源β-gal中,Aspergillus和Kluyveromyces菌株产生的β-g a l在工业中应用范围最广[8]。但双歧杆菌(bifidobacteria)和乳酸菌(lactic acid bacteria,LAB)来源的β-gal在生产GOS方面也具有非常重要的价值,是β-gal较好的来源,且越来越受到关注。首先双歧杆菌和LAB均被认为是“一般认为安全(generally recognized as safe,GRAS)”的微生物,在食品发酵领域具有较长的应用历史。此外,研究发现利用乳酸菌β-半乳糖苷酶(lactic acid bacteria β-galactosidase,Lβ-gal)和双歧杆菌β-半乳糖苷酶(bifidobacteria β-galactosidase,Bβ-gal)合成的GOS将最有可能选择性促进这两类菌在肠道中的生长,提高菌株在肠道内的代谢活力,从而增加益生作用[9]。
近年来,国内关于β-gal的综述性报道较少,国外则较为全面[1,5],但针对Lβ-gal和Bβ-gal这两类来源及其合成GOS的总结报道较少。因此,本文针对Lβ-gal和Bβ-gal转糖基作用合成GOS的研究进展,总结了能够产生具有转糖基活力β-gal的双歧杆菌和乳酸菌菌株,分析比较了两类来源的β-gal的酶学性质,并重点阐明了β-gal以乳糖为底物在合成GOS中的应用,为开发Lβ-gal和Bβ-gal及其应用提供理论指导。
1 β-gal转糖基作用合成GOS
近年来,GOS因其具有多种益生功能,且在较广的pH值和温度范围内具有稳定性,而受到广泛关注[10]。GOS的分子链含有2~8 个单糖,末端为1 个葡萄糖分子,剩余部分为半乳糖;此外,通过转糖基作用由2 个半乳糖组成的二糖也属于GOS[6]。GOS被认为是具有有益作用的益生元成分,可不被水解或消化直接从人体上肠道到达大肠,选择性促进肠道中有益菌双歧杆菌和乳杆菌的生长,以及抑制肠道致病菌的生长[11],从而改善肠道菌群的组成,对免疫反应和代谢综合征标志物产生积极作用[12-14]。此外,肠道微生物在结肠中发酵GOS的产物包括乙酸、丙酸、丁酸和乳酸等短链脂肪酸,这些产物给结肠上皮提供能量,降低了结肠pH值,促进了钙、镁的吸收,以及降低了促炎反应标志物的水平[15-17]。
目前,主要通过糖苷水解酶的转糖基作用,以乳糖为底物,产生具有不同聚合度和结构的GOS混合物以及未参与反应的乳糖和单糖(葡萄糖和半乳糖)[18]。在GOS的工业化生产中,β-gal发挥着极其重要的作用,其形成GOS的具体作用机制见图1。首先1 分子乳糖和β-gal的活性位点结合,释放葡萄糖残基,剩下的β-gal-半乳糖基复合物进行下一步反应。接着,该复合物转移到含有羟基的糖类或水分子受体上,当溶液中乳糖浓度较低时,将促进水分子作为受体,产生半乳糖;而当溶液中乳糖浓度较高时,则乳糖等作为受体连接该复合物,最终产生GOS[5]。当乳糖作为受体时,通过转糖基作用可产生聚合度为3的GOS(β-D-Galp-(1→x)-β-D-Galp-(1→4)-D-Glcp),该GOS可再次作为受体底物,重复经历转糖基过程。因此,转糖基反应可产生具有不同结构的GOS混合物[3]。
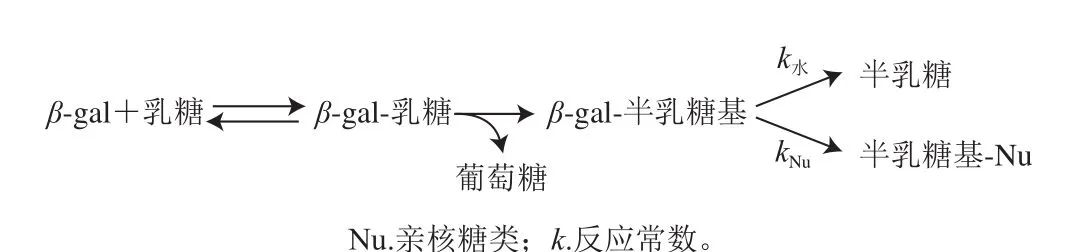
图1 β-gal合成GOS的反应[5]Fig. 1 Reaction route for the synthesis of GOS by β-gal[5]
2 具有转糖基活力Lβ-gal和Bβ-gal的来源和酶学性质
2.1 具有转糖基活力Lβ-gal和Bβ-gal的来源
部分双歧杆菌和LAB菌株能够产生具有转糖基活力的β-gal,这两类菌是筛选转糖基活力β-gal的较好来源[9]。表1总结了目前文献报道的具有转糖基活力Lβ-gal和Bβ-gal的来源。其中,能够产生具有转糖基活力β-gal的双歧杆菌包括长双歧杆菌(Bifidobacterium longum subsp. longum)、婴儿长双歧杆菌(Bifidobacterium longum subsp. infantis)、两歧双歧杆菌(Bifidobacterium bifidum)、短双歧杆菌(Bifidobacterium breve)、角形双歧杆菌(Bifidobacterium angulatum)、青春双歧杆菌(Bifidobacterium adolescentis)和假长双歧杆菌(Bifidobacterium pseudolongum)等。Lβ-gal的来源包括嗜热链球菌(Streptococcus thermophilus)、植物乳杆菌(Lactobacillus plantarum)、戊糖乳杆菌(Lactobacillus pentosus)、短乳杆菌(Lactobacillus brevis)、发酵乳杆菌(Lactobacillus fermentum)、嗜酸乳杆菌(Lactobacillus acidophilus)、清酒乳杆菌(Lactobacillus sakei)、保加利亚乳杆菌(Lactobacillus delbrueckii subsp.bulgaricus)、罗伊氏乳杆菌(Lactobacillus reuteri)和副干酪乳杆菌(Lactobacillus paracasei)等。
β-gal主要以全细胞、经过化学处理或物理处理的细胞、破碎细胞后获得的粗酶、粗酶经过进一步纯化获得的纯化酶、固定化处理的酶,以及通过大肠杆菌(Escherichiacoli)、巴氏毕赤酵母(Pichia pastoris)和L. plantarum等表达宿主菌获得的重组酶等不同形式存在。不同来源和不同形式的β-gal的酶学性质存在差异,从而对GOS的合成过程产生影响。
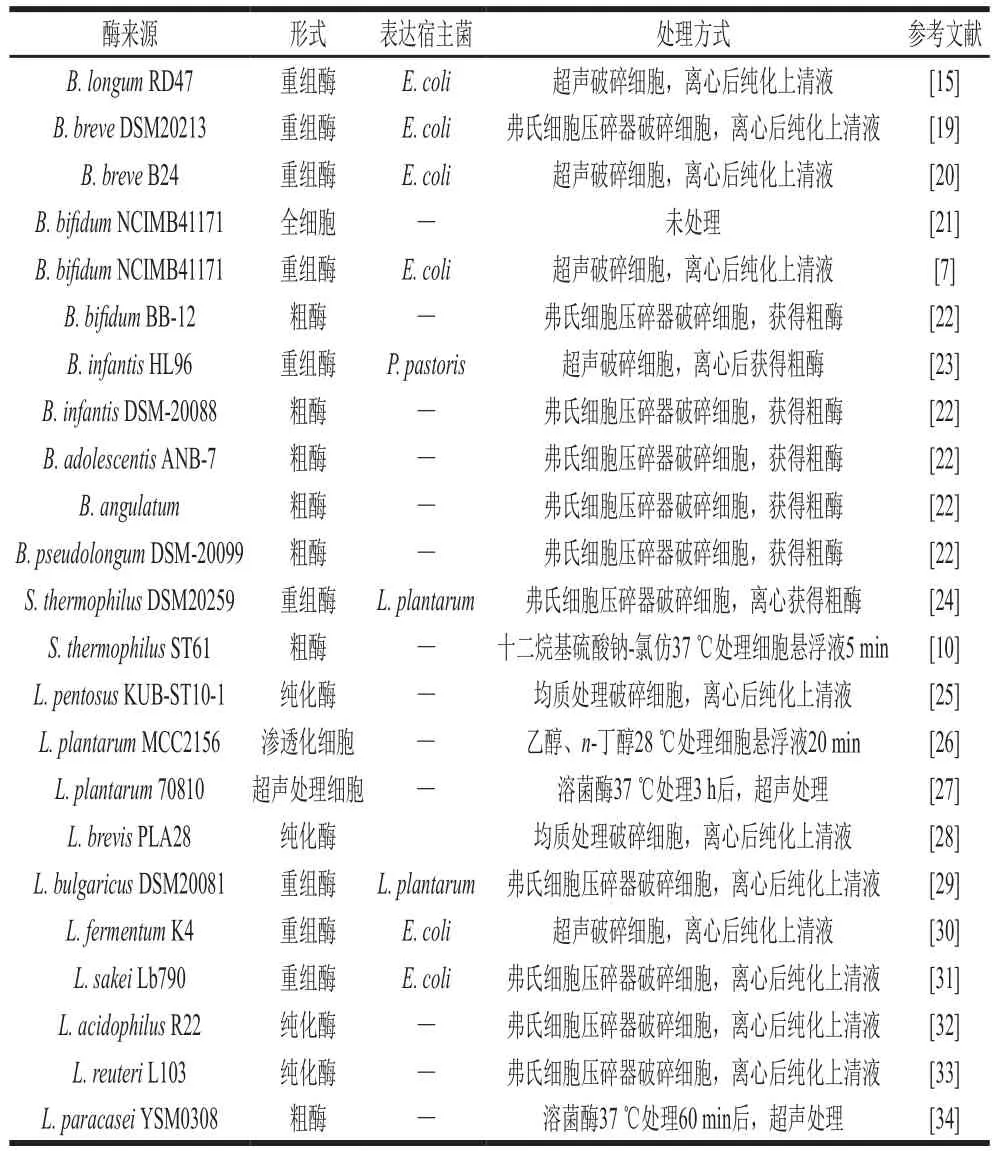
表1 Lβ-gal和Bβ-gal的来源Table 1 Microbial sources of Lβ-gal and Bβ-gal
2.2 具有转糖基作用的Lβ-gal和Bβ-gal的酶学性质
基于CAZy(carbohydrate-active enzymes)数据库,β-gal属于糖苷水解酶家族(glycoside hydrolase families,GH)1、2、35、42和59(GH1、GH2、GH35、GH42和GH59)[35]。双歧杆菌和乳酸菌中,仅在GH2和GH42家族中发现具有转糖基活力的β-gal(表2)。GH2家族中,大部分乳酸菌产生LacLM类型的β-gal,即由lacL和lacM两个基因编码形成的异源二聚体,包括L. pentosusKUB-ST10-1、L. acidophilusR22、L. plantarumWCFS1、L. sakeiLb790、L. reuteriL103等菌株[25]。而由单一lacZ基因编码的LacZ类型β-gal在乳酸菌中不常见,仅有少数乳酸菌属于这一类型,例如菌株L. bulgaricusDSM20081[29]。LacZ类型的β-gal在双歧杆菌中更为常见,例如B. bifidumNCIMB 41171、B. infantisHL96、B. breveDSM 20213和B. longumCCRC 15708等双歧杆菌菌株产生的β-gal均为LacZ类型[19,29-30]。此外,具有转糖基活力的Lβ-gal和Bβ-gal以GH2家族居多,只有少部分菌株属于GH42家族,例如分别来自B. bifidumNCIMB 41171的β-半乳糖苷酶BbgII[36]和B. infantisHL96的β-半乳糖苷酶β-GalIII[37]。这是由于GH2家族的β-gal可能更倾向于催化转糖基反应,因此该家族β-gal转糖基活力的研究一般得到更多关注[19]。
β-gal催化合成GOS是一个动力学控制的反应,该过程转糖基反应和水解反应同时发生[6]。但关于GOS合成反应的动力学参数米氏常数Km以及催化常数kcat的报道较少,这可能是由于GOS的形成速率很难准确计算。当Km用来计算转糖基作用时,通常需要的数量级远高于乳糖水解的数量级,例如B. bifidum β-gal的转糖基作用和乳糖水解的乳糖浓度分别为800 mmol/L和13 mmol/L,转糖基作用需要提供更高的乳糖浓度才能获得最大转糖基速率[38]。因此,相比于转糖基作用的动力学参数,关于乳糖水解的动力学参数报道更多,表2总结了具有转糖基活力的Lβ-gal和Bβ-gal的乳糖水解的动力学参数以及β-gal参与乳糖水解反应的最适pH值和温度。
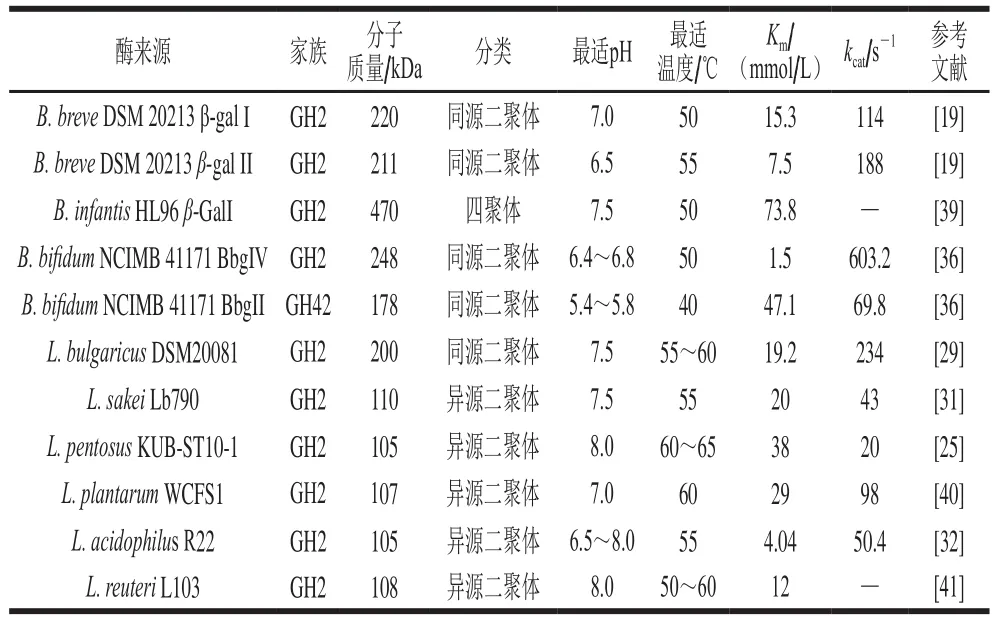
表2 Lβ-gal和Bβ-gal的酶学性质Table 2 Enzymatic properties of Lβ-gal and Bβ-gal
3 Lβ-gal和Bβ-gal合成GOS的应用
3.1 产生的GOS特点
β-gal的来源可能是影响GOS合成最重要的因素,决定了GOS的产量、产物的组成以及β-糖苷键的类型[11]。
3.1.1 GOS产量
在文献中关于GOS的产量有多种定义,较常用的定义是GOS质量浓度(g/L)和初始乳糖质量浓度(g/L)的比值[15],在本文中即采用该定义表达GOS产量。表3列举了不同来源的Lβ-gal和Bβ-gal,以乳糖为底物合成GOS的反应条件和最大产量。由表3可知,在不同的过程参数下,源自不同菌株的Lβ-gal和Bβ-gal转糖基作用产生GOS的量在10%~70%之间不等。一般而言,GOS产量超过50%的β-gal较不常见,合成过程经过优化后,获得的产量约在30%~40%之间[24]。表3中总结了目前报道的几个GOS产量超过50%的Bβ-gal和Lβ-gal,例如,源自B. infantisHL96菌株的β-galI,合成的GOS产量达到63%[39]。B. bifidumNCIMB41171β-gal无论是存在于完整的细胞中,还是以重组酶BbgIV形式存在,其GOS产量均超过50%[9]。在乳酸菌中,S. thermophilusDSM20259[24]和L. bulgaricusDSM20081[29]菌株产生的β-gal,合成的GOS产量达到50%左右,是乳酸菌中GOS产量较高的菌株。但也存在GOS产量较低的β-gal,例如L. pentosusBFP32β-gal合成的GOS产量较低,当以粗酶液作为催化剂,GOS产量仅为13.9%[42]。Lβ-gal和Bβ-gal转糖基活性存在菌株特异性,其中部分β-gal合成GOS的产量甚至超过60%,高于Aspergillus β-gal和Kluyveromycesβ-gal等常见来源[43],因此可以深入探究这两类来源的β-gal的特点,并应用于GOS的工业生产。
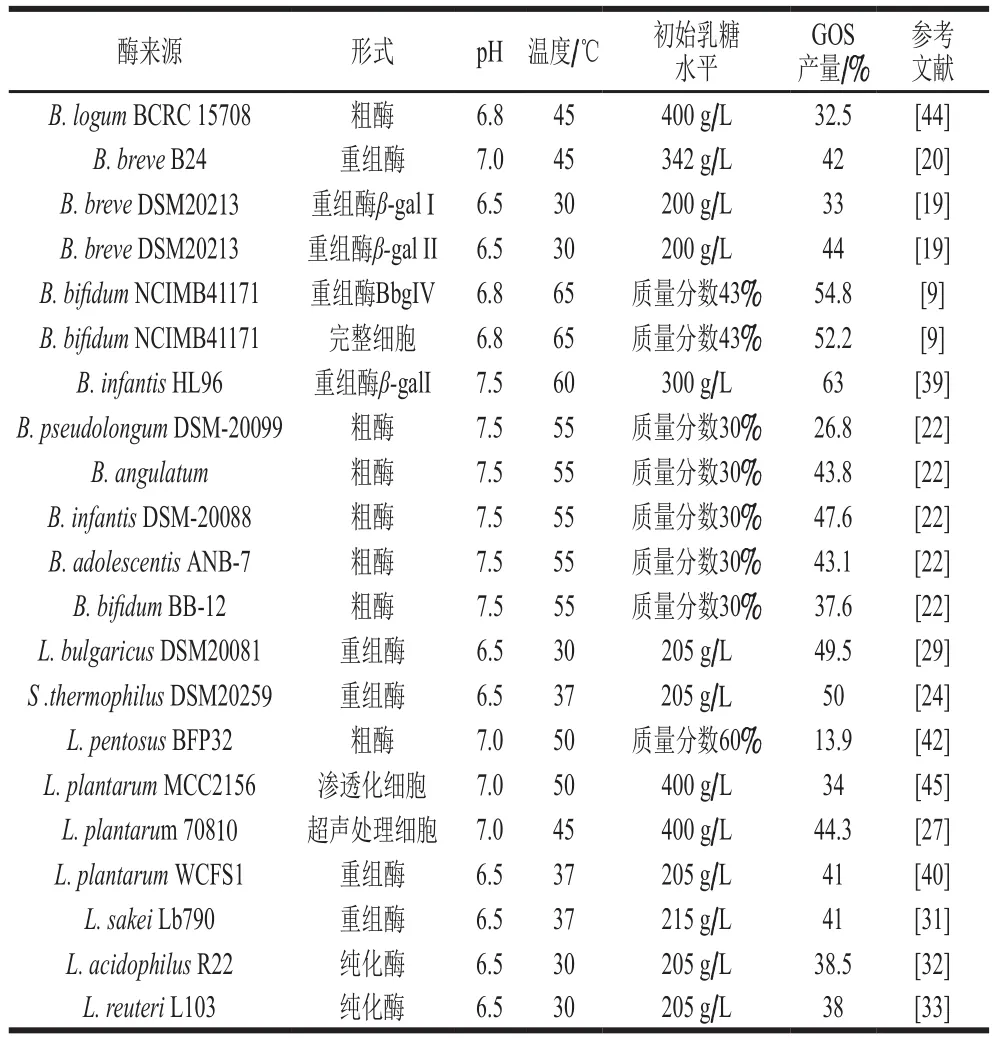
表3 Lβ-gal和Bβ-gal不同反应条件下的最大GOS产量Table 3 Maximum GOS yield produced by Lβ-gal and Bβ-gal under different reaction conditions
3.1.2 GOS组成及键接方式
Lβ-gal和Bβ-gal以乳糖为底物合成的GOS结构为Galn-Lac;此外,也存在Gal-Gal的二糖结构(表4)。产物GOS的聚合度普遍在2~5之间。例如,L. acidophilusR22β-gal合成的GOS中非乳糖二糖、三糖和四糖分别占总糖质量的15.5%、19%和4%[32]。L. plantarumWCFS1β-gal的GOS产物中非乳糖二糖、三糖和四糖的占比分别为19%、21%和1.3%[40]。B. bifidumNCIMB 41171β-gal合成的GOS混合物,除了含有二糖(25%)、三糖(35%)、四糖(25%),还有15%的戊糖[21]。
商业GOS例如Elix’or的糖苷键类型主要为β-1,4糖苷键,和Lβ-gal合成的GOS存在较大的区别[40]。表4总结了不同来源Lβ-gal和Bβ-gal合成的GOS产物的组成和键接方式。Lβ-gal倾向于合成β-1,6和β-1,3糖苷键连接的GOS。其中这几株LAB菌株,包括L.bulgaricusDSM20081[29]、L.reuteriL103[33]、L.plantarumWCFS1[40]和L.sakeiLB790[31]产生的Lβ-gal尤其倾向于合成β-1,6糖苷键连接的GOS;此外,在双歧杆菌中也存在类似现象,将B. breveDSM 20213菌株中的lacZ基因在E. coli中表达,获得两种纯化后的重组酶β-gal I和β-gal II,两种酶通过转糖基作用产生的主要GOS产物为二糖β-D-Galp-(1→6)-D-Glc和三糖β-D-Galp-(1→3)-D-Lac,都是通过β-1,6和β-1,3糖苷键连接的,两种糖的总量分别超过GOS总量的75%和65%,而通过其他糖苷键连接的GOS产物则较少,仅产生极少量β-1,4糖苷键连接的三糖β-D-Galp-(1→4)-D-Lac[19]。但Bβ-gal产物中也存在主要通过β-1,4糖苷键连接的GOS产物,例如B. longumRD47菌株β-gal合成的三糖和四糖中,均存在β-1,4糖苷键[15]。相比于Lβ-gal,Bβ-gal合成的GOS糖苷键类型更具多样化。
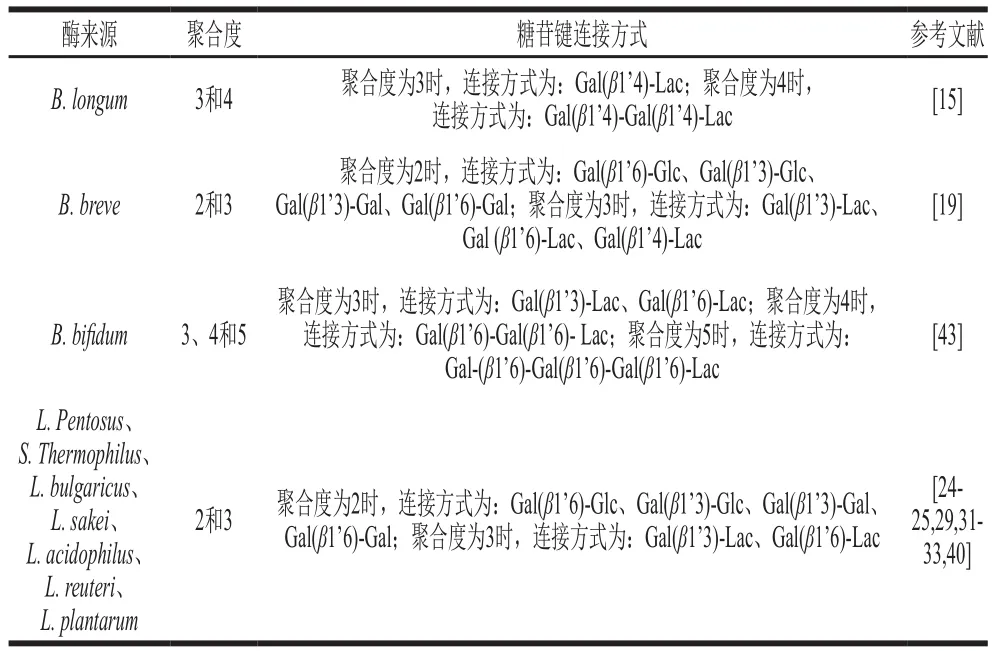
表4 Lβ-gal和Bβ-gal产生的GOS结构特点Table 4 Structural characteristics of GOS produced by Lβ-gal and Bβ-gal
3.2 影响GOS合成反应的因素
β-gal的来源是影响GOS合成最重要的变量,决定了GOS的产量、产物的组成以及β-糖苷键的类型。除此之外,酶的形式、反应条件等也会影响GOS的合成[46-47]。本文重点从反应时间、乳糖浓度、反应温度、热稳定性酶的应用、固定化酶这5个方面,分析总结影响GOS合成反应的因素。
3.2.1 反应时间
β-gal以乳糖为底物合成GOS的反应过程中,GOS的合成和降解反应同时进行,GOS产量和组成不断发生变化,因此需要了解反应时间历程(乳糖转化)以获得最大的GOS产量[18]。L. bulgaricusDSM20081β-gal在合成GOS过程中,反应开始时主要形成三糖,包括β-D-Galp-(1→3)-D-Lac和β-D-Galp-(1→6)-D-Lac。随着反应的进行,葡萄糖和半乳糖的量稳定增加,这部分单糖成为转糖基反应的重要受体,部分非乳糖二糖开始形成,例如β-D-Galp-(1→6)-D-Glc和β-D-Galp-(1→3)-D-Glc是该阶段两种主要产物。反应过程中GOS产量也随着时间延长不断发生变化,当反应时间为12 h时,GOS的产量最高,接近50%,但在此之后,由于β-gal也能够水解GOS,GOS浓度出现下降,反应时间达到24 h时,GOS产量约降低了10%[29]。B. breve DSM20213 β-gal I和β-gal II两种酶在合成GOS时,分别在6 h和22 h之后获得最大GOS产量,但之后GOS浓度也出现了下降,尤其是β-gal I更为显著[19]。因此,终止反应的时间点相当严格,要尽可能接近最大GOS产量的时间点,以降低GOS的损失。
3.2.2 乳糖浓度
一般情况下,增加初始乳糖浓度有利于GOS的合成。初始乳糖浓度对GOS合成过程的影响主要表现在两个方面:一方面增加了半乳糖基受体数量,提高了GOS的合成速率;另一方面降低了水分活度,从而降低了GOS的降解速率以及乳糖水解速率[38]。但当初始乳糖浓度过高时,GOS的产量出现下降。例如,利用L. plantarum 79810菌株的β-gal合成GOS时,当初始乳糖质量浓度从200 g/L升高到400 g/L时,反应体系中转糖基反应逐渐占据主体,但随着乳糖质量浓度的进一步增加,GOS产量减少[27]。B. longum BCRC 15708菌株的β-gal催化反应中,当乳糖初始质量浓度从50 g/L增加到400 g/L时,GOS产量不断增加,质量浓度为400 g/L时,产量最高,但随着乳糖质量浓度进一步增加,GOS产量出现减少,与L. plantarum 79810菌株的反应趋势一致[44]。而出现该现象的原因,可能是由于高浓度乳糖底物,伴随着高含量半乳糖和葡萄糖转糖基产物的产生,而这两种产物是β-gal的竞争性抑制剂,从而降低了GOS的合成[27]。因此,在一定范围内提高初始乳糖浓度有利于提高GOS产量。
3.2.3 反应温度
提高温度有利于促进GOS的合成,主要原因是由于温度的升高增加了反应速率和底物的溶解度。例如,Geiger等[24]将S. thermophilus DSM20259菌株中编码β-gal的lacZ基因,在L. plantarum中表达获得重组β-gal粗酶提取液后,分别在37 ℃和50 ℃条件下合成GOS,在50 ℃条件下反应5 h,GOS产量接近总糖的50%;当反应温度降低到37 ℃时,需要反应8.5 h才能达到50%的产量。但不同来源β-gal的适宜反应温度范围具有菌株特异性,Zhang Hongzhi等[27]以超声破碎处理后的L. plantarum 79810菌株作为β-gal源合成GOS,当反应温度分别为30、37、45 ℃和50 ℃时,GOS的最高产量分别为26.5%、36.8%、43.5%和15.6%;当温度从30 ℃升高到45 ℃时,乳糖转化率从46.85%升高到78.25%,GOS产量逐渐增加;但随着温度从45 ℃升高到50 ℃,GOS产量出现显著下降。此外,温度可能对GOS产量无显著影响。Nguyen等[29]利用L. bulgaricus的β-gal合成GOS时,反应温度对GOS产物的最大产量以及组成影响很小,温度为30、40、50 ℃时,产量分别为49.5%、48.7%、48.2%;GOS混合物的主要组成成分未发生改变,且产量只发生微量变化。因此,针对不同来源的β-gal,需探究适宜的反应温度以提高GOS产量。
3.2.4 热稳定性酶的应用
升高温度通常能够促进GOS产生,但β-gal的热稳定性可能限制其在工业化规模上的应用;因此许多学者针对热稳定性酶的来源和特性展开重点研究[48-49]。热稳定性β-gal在应用时,提高反应温度、增加初始反应乳糖浓度,不仅可提高GOS产量,同时能够限制其他微生物的污染[38]。目前普遍认为,来自嗜热微生物的β-gal在较高温度下转糖基活力较高,是适于合成GOS的生物催化剂;而来自乳酸菌和双歧杆菌的β-gal合成GOS的反应温度一般不超过55 ℃。然而,Osman等[9]首次在双歧杆菌B. bifidum NCIMB 41171菌株中分离纯化出一种β-半乳糖苷酶BbgIV,它能够在65 ℃条件下有效合成GOS,最大GOS产量达到54.8%,高于一般水平。GOS生产率在65 ℃条件下达到35.1 g/(L·h),远高于生产率分别为4.8、12.7、24.3 g/(L·h)和18.2 g/(L·h)的菌株布勒掷孢酵母(Bullera singularis)、B. infantis HL96、米曲霉(Aspergillus oryzae)和海栖热袍菌(Thermotoga maritima);该发现实现了Bβ-gal在65 ℃高温下合成GOS的可能,说明Bβ-gal在合成GOS方面具有很大的潜力。
3.2.5 酶的固定化处理
除了筛选热稳定性强的Lβ-gal和Bβ-gal以外,酶的固定化处理也可提高β-gal的稳定性。固定化处理是将酶限制在一定区域内,保留催化活力,从而增加酶的稳定性和可重复利用性,其核心的技术问题在于载体材料的制备与选择[50]。关于Bβ-gal的固定化研究较少,Osman等[47]首次将B. bifidum NCIMB41171菌株产生的β-半乳糖苷酶BbgIV固定化处理后合成GOS,相比于游离的BbgIV,DEAE纤维素、Q-琼脂糖凝胶和氨基乙基琼脂糖固定化BbgIV在45 ℃和55 ℃下稳定性提高;其中,Q-琼脂糖凝胶固定化BbgIV在45 ℃和55 ℃下反应仅2 h即获得最大产量的GOS(49%~53%),而游离BbgIV合成最大产量GOS(49%~53%)则分别需要20 h和16 h;此外,Q-琼脂糖凝胶固定化BbgIV在55 ℃高温下重复使用6 次后,活力仍保留了67.5%。因此,固定化处理也将会对GOS合成成本产生重要的影响。
4 结 语
双歧杆菌和乳酸菌被认为是GRAS微生物,是β-gal较好的来源,在生产GOS方面具有非常重要的价值。目前,Clasado公司利用B. bifidum NCIMB41171菌株产生的GOS已经实现商业化生产,GOS质量分数达到48%[51]。此外,S. thermophilus菌株产生的β-gal在将乳清中的乳糖转化为GOS方面也有较好的应用[24]。
β-gal的来源和反应条件等影响GOS的类型、产量以及特殊糖苷键的形成。未来的研究方向,一方面需要进一步筛选转糖基活力高的Lβ-gal和Bβ-gal,充分利用高乳糖含量的乳清等乳制品工业废弃物,优化反应过程,提高GOS产量和纯度,从而减少乳清等对环境的污染,增加经济效益[52];另一方面,在婴儿配方粉中通常添加GOS模拟母乳寡糖的结构和益生作用,但GOS结构的多样性显著低于母乳寡糖[3,53]。因此需要深入探究Lβ-gal和Bβ-gal酶学性质和产生的GOS特点,通过结构定点饱和诱变等生物工程技术,丰富GOS结构的多样性,从而扩大工业化应用。

