基于双荧光系统的HepG2肝细胞癌原位移植裸鼠模型建立及活体荧光成像动态定量分析
张飞翔,赵珂,高瑞,高慧英,詹轶群,李长燕,杨晓明
1.广东药科大学,广东 广州 510006;2.军事医学研究院 辐射医学研究所,北京 100850;3.军事医学研究院 生命组学研究所,北京 102206
肝细胞癌(hepatocellular carcinoma,HCC)是源自肝脏细胞的原发性恶性肿瘤,在常见肿瘤类型中位居第六。全球每年约有630 000 例HCC 新增病例,占所有新发肿瘤病例的5.7%,80%的患者分布在发展中国家,我国独占55%[1-2]。诱发HCC的因素较多,主要包括乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染、酗酒、肥胖及2 型糖尿病[3]。该病早期诊断性差,生存期短,临床反应性低,使得它具有高度的致命性。HCC 患者在早期诊断中可以通过手术切除、肝脏移植和局部区域治疗的方式提高生存期[4],但总体生存率仍然不会超过10%[5],大多数晚期患者的治疗方法也十分有限。目前最有效的晚期HCC 靶向治疗药物索拉非尼仅将生存期从7.9 个月提高到10.7 个月[6]。因此,迫切需要开发更新、更有效的治疗HCC的药物。
活体荧光成像是一种光学分子成像技术,利用萤光素酶基因标记细胞,加入萤光素酶底物后可产生荧光,通过高灵敏度光学检测仪器对活体生物体内细胞行为实现可视化、实时动态监测及定量分析[7]。该技术主要用于临床前研究,可用于监测细胞内基因表达[8]、活体动物模型中病原体和肿瘤的定位及追踪[9-10]、细胞增殖和迁移等。目前,含有萤光素酶基因标签的肿瘤模型得到了广泛应用,该模型能快速、无创、可视化地观察体内肿瘤生长变化,并提供肿瘤生长的定量信息,是肿瘤发病机制研究和抗肿瘤药物研发的重要模型。为建立一种可以实时、定量、动态检测的肝细胞癌原位移植模型,我们采用慢病毒感染的方式建立能够稳定表达绿色荧光蛋白(green fluo⁃rescent protein,GFP)和萤火虫萤光素酶(lucifer⁃ase,Luc)基因的肝癌细胞系HepG2,进而建立表达双荧光的肝癌原位移植模型,为抗肿瘤药物研发和药效评价提供重要的动物模型。
1 材料与方法
1.1 材料
BALB/c-nu/nu 裸鼠,雄性,4~5 周龄,体重 20~22 g,购于北京斯贝福生物技术有限公司;肝癌细胞HepG2、人胚肾细胞293T、慢病毒过表达载体 pCDH-GFP-luc(此载体含有 GFP、Luc 和嘌呤霉素基因)、慢病毒包装质粒psPAX2、包膜质粒pMD2G 为本实验室保存;大肠杆菌DH5α购于北京博迈德生物技术有限公司。
甲苯磺酸索拉非尼片购自Bayer 公司;羧甲基纤维素钠(CMC-Na)购自国药集团化学试剂有限公司;EndoFree 质粒 DNA 纯化试剂盒 Maxi(10)购自Qiagen 公司;细胞培养基DMEM 购自Gibco公司,jetPRIME 转染试剂盒购自Polyplus-transfec⁃tion 公司;胎牛血清购自Gemini 公司;超滤管购自Millipore公司 ;Xenolight D-Luciferin Potassium Salt购自Perkin Elmer公司;Dual-Luciferase Re⁃porter Assay System 试剂盒购自 Promega 公司;倒置荧光显微镜购自Olympus 公司;流式细胞仪购自 BD 公司;IVSI LuminaⅡ成像仪购自Perkin El⁃mer 公司。
1.2 质粒大提与慢病毒包装
分别将上述3 种质粒转入大肠杆菌DH5α,培养扩增后采用EndoFree 质粒DNA 纯化试剂盒Maxi(10)进行质粒大提。
用含10%胎牛血清的H-DMED 培养基培养293T 细胞,转染前24 h 将细胞铺于10 cm 细胞培养皿中,细胞密度达80%~90%时进行转染。将3 μg pMD2G、9 μg pSPAX2、12 μg pCDH-GFPLuc 加入 500 μL jetPRIME 缓冲液中涡旋混匀,再加入48 μL jetPRIME 试剂,涡旋混匀后室温静置10 min;将混合物逐滴加到细胞培养皿中,轻轻摇匀,37℃、5% CO2条件下继续培养,转染 4~6 h后更换新鲜的培养基,每个培养皿中加15 mL,24 h 后补加 15 mL 培养基;转染 48 和 72 h 分别将上清液收集于50 mL 离心管中,4℃、3000 r/min离心15 min 去除细胞碎片;用超滤管浓缩,4℃、4500 r/min 离心 30 min,浓缩液过 0.45 μm 滤膜,向收集到的滤液中各加1/5 体积的5×PEG,4℃静置过夜;4℃、1500 r/min 离心30 min,弃上清,用SFEM 培养基溶解病毒沉淀,分装后于-80℃冰箱中保存备用。
1.3 慢病毒滴度检测
按每孔 2×105/500 μL的密度将 293T 细胞接种到24 孔板内,24 h 后分别加入不同浓度病毒感染细胞,感染24 h 后更换培养基,48 h 后用荧光显微镜观察GFP的表达。收集细胞,通过流式细胞仪检测GFP 阳性率并计算病毒滴度(病毒滴度=阳性细胞百分率×接种细胞数/加入病毒体积)。
1.4 HepG2-GFP-Luc细胞系的建立
将肝癌细胞HepG2 接种于6 孔板中,待细胞处于对数生长期时按MOI=10 加入带有GFP 标签、嘌呤霉素抗性标签及Luc 基因的慢病毒,培养12 h 后进行第2 次感染。细胞感染48 h 后,用荧光显微镜观察细胞中是否表达GFP。更换含有5 μg/mL 嘌呤霉素的细胞培养基培养细胞12 h,用普通显微镜观察细胞存活情况并检测GFP 阳性率。流式细胞仪分选GFP+细胞并扩增培养。
1.5 萤火虫萤光素酶表达鉴定
将上述细胞接种于24 孔板内,待细胞融合至90%左右时,弃上清,用PBS 清洗2 次,每孔加入被动裂解液100 μL,充分振荡30 min 裂解细胞,每孔吸取 30 μL 上清裂解液,加入 30 μL Lucif⁃eras Assay ReagentⅡ液充分混合,立即放入发光仪,测量室内测定Luc 活性。另将不同密度的细胞悬液接种于96 孔板内,待细胞贴壁后弃上清,用PBS 清洗2 次,加入100 μL 底物(浓度150 μg/mL),用IVSI LuminaⅡ成像仪体外检测自发荧光强度。
1.6 皮下肿瘤模型的建立
体外扩增培养表达萤光素酶的HepG2 细胞,收集细胞,用 PBS 重悬,制备 2.5×107/mL 细胞悬液,并按照每只200 μL 注射于4~5 周龄裸鼠右侧前肢腋窝皮下,2 周后用IVSI LuminaⅡ成像仪进行活体成像。
1.7 肝癌原位移植模型的建立及分组给药
待异体肿瘤组织长至直径1 cm 左右时取出,除去外层包膜和内部坏死部分,选取中间鱼肉状肿瘤组织,放入生理盐水中,切成1 mm3左右的瘤块备用。将体重20~22 g的20 只裸鼠用1%戊巴比妥钠溶液麻醉,固定,碘伏棉球消毒腹部皮肤,自胸骨下方沿着腹中线向下剪开约1 cm 切口,挤出肝脏,将瘤块置于20 号穿刺针头内并接种于肝左叶,用无菌棉棒充分按压止血后将肝脏塞入腹腔,伤口滴加少量注射用青霉素钠溶液后,用无菌针线依次缝合肌肉层和皮肤,术后第10 d 对裸鼠进行活体成像。将造模成功的裸鼠按照发光部位的荧光总光子数值大小随机分为对照组和治疗组,分别给与0.5%羧甲基纤维素钠溶液和50 mg/kg 索拉非尼溶液,灌胃给药2/d,连续给药28 d,每7 d 进行一次活体成像,观察裸鼠体内肿瘤动态变化。结束实验后,处死全部裸鼠,解剖裸鼠肝脏,分离瘤块并拍照称重。
1.8 统计学分析
用GraphPad Prism 5 软件进行数据统计分析,计量资料实验数据以x±s表示,组间差异采用t检验,P<0.05 认为有显著性差异。
2 结果
2.1 pCDH-GFP-Luc慢病毒的包装及滴度测定
将 pCDH-GFP-luc、psPAX2 和 pMD2G 质粒共转染293T 细胞,48 h 后荧光显微镜观察到约80%的细胞表达GFP(图1A)。收集病毒后浓缩并沉淀,用SFEM 培养基溶解病毒沉淀,然后测定病毒滴度。结果如图1B、C,加入体积为0.5 μL的病毒48 h 后,荧光显微镜观察到细胞具有绿色荧光,流式细胞仪检测GFP+细胞的比率为30.2%,经计算病毒滴度为1.21×108pfu/mL,该滴度完全可用于后续研究。
2.2 HepG2-GFP-Luc细胞系的建立及鉴定
向 HepG2 细胞中加入 50 μL 慢病毒,12 h 后进行第2 次感染,48 h 后在荧光显微镜下可以观察到成功感染的细胞产生绿色荧光(图2A)。用5 mg/mL 嘌呤霉素筛选12 h 后,细胞经流式细胞仪检测到GFP 阳性率为99%(图2B),体外培养2周后GFP 阳性率为98.9%(图2C),提示外源基因成功整合到HepG2 细胞染色体上并稳定遗传表达。对GFP+细胞进行流式细胞仪分选,获得稳定表达 GFP 和 Luc的 HepG2 细胞株 HepG2-GFPLuc。
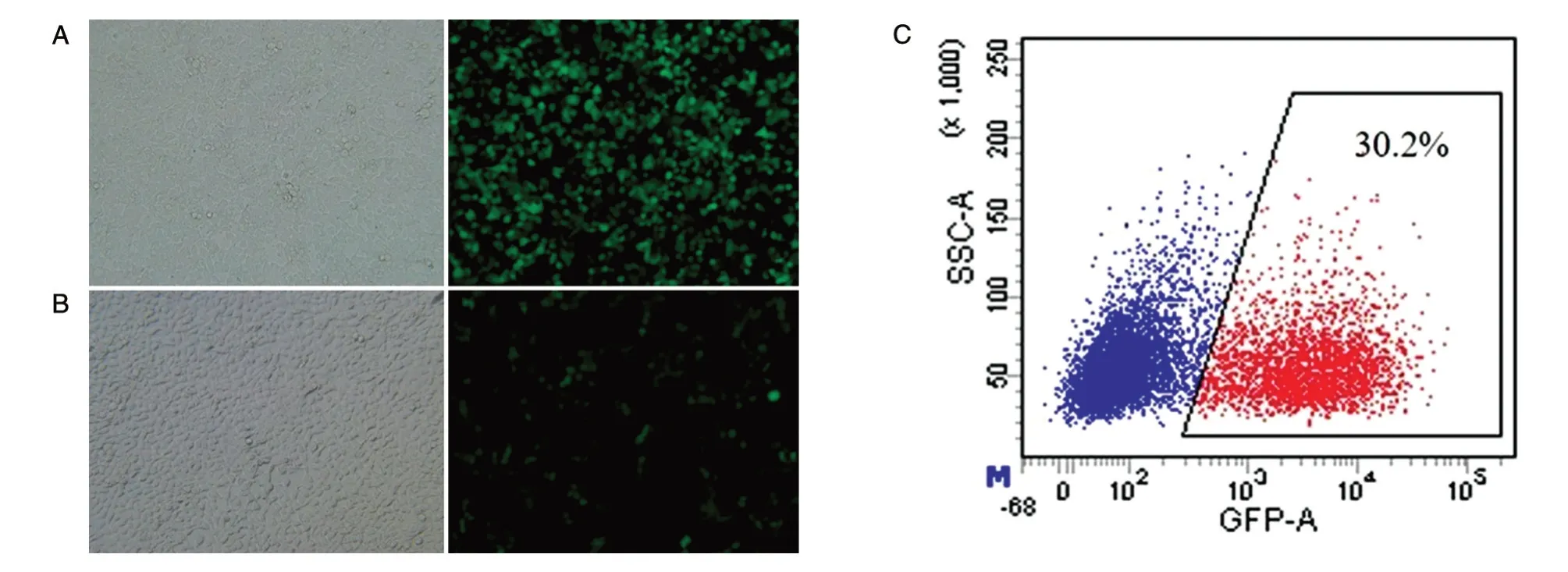
图1 慢病毒包装及病毒滴度检测

图2 慢病毒感染HepG2细胞
对获得的HepG2-GFP-Luc 细胞中的Luc 活性进行测定,结果如图3A,HepG2-GFP-Luc 细胞Luc 活性达106,远远高于对照组未感染病毒的HepG2 细胞(Luc 活性为 103),证明肝癌细胞株HepG2-GFP-Luc 高表达 Luc(n=3)。利用不同数量的HepG2-GFP-Luc 细胞进行体外自发荧光强度检测,结果表明,细胞体外成像发光信号强度与细胞数目存在线性相关关系(图3B、C)。
2.3 HepG2-GFP-Luc皮下成瘤活体成像
向裸鼠皮下注射5×106细胞,2 周后长出肉眼可见的肿瘤组织块,通过IVIS 成像仪器对裸鼠皮下瘤组织进行活体成像,结果如图4。裸鼠皮下瘤组织表达Luc,成瘤率为100%(n=4),生物发光总光子数为 1.453×108~7.113×108p/s。该成瘤组织可用于原位移植模型的建立。
2.4 HepG2-GFP-Luc肝细胞癌原位移植模型活体成像及动态观察
分离皮下成瘤组织,接种肝脏原位,术后第10 d 对裸鼠进行活体成像,显示肿瘤组织在肝脏内成功存活,造模成功率为90%(18/20),检测到65%的裸鼠体内荧光信号为 4.10×106~9.24×106p/s,由于仪器灵敏度有限,25%的裸鼠体内荧光信号可以检测,但无法得到精确数值(图5)。
将造模成功的裸鼠分为对照组(n=6)和治疗组(n=7),在第10、17、24、31、38 d 对裸鼠活体成像,结果显示对照组裸鼠肝脏肿瘤细胞随时间延长而增殖,荧光信号强度也随之增加;而由于药物的作用,索拉非尼治疗组肿瘤细胞增殖相比于对照组受到抑制,荧光信号强度明显弱于对照组(图6)。以每次活体成像得到的荧光总光子数值绘图,得到荧光总光子数-时间曲线图(图7),可以看出对照组总光子数值随时间的推移而逐渐增长,第31 d 起明显增加;而索拉非尼治疗组肿瘤细胞增殖受到抑制,总光子数值增长缓慢。与对照组相比,第24、31 和38 d 治疗组裸鼠总光子数值显著低于对照组,这与图6中荧光信号强度相符。另外,从各组裸鼠解剖后获得的肿瘤总览图中可以看出索拉非尼治疗组肿瘤体积明显小于对照组(图8),而对各组肿瘤重量的统计结果表明,治疗组平均瘤重显著低于对照组(图9)。以上结果说明建立了HepG2-GFP-Luc 肝细胞癌原位移植裸鼠模型,活体成像系统检测的肿瘤细胞荧光信号强度能够反映裸鼠肝脏内肿瘤大小变化,并且通过对比治疗组和对照组活体成像结果证明该模型可用于抗肝癌药物的研发及药效评价。
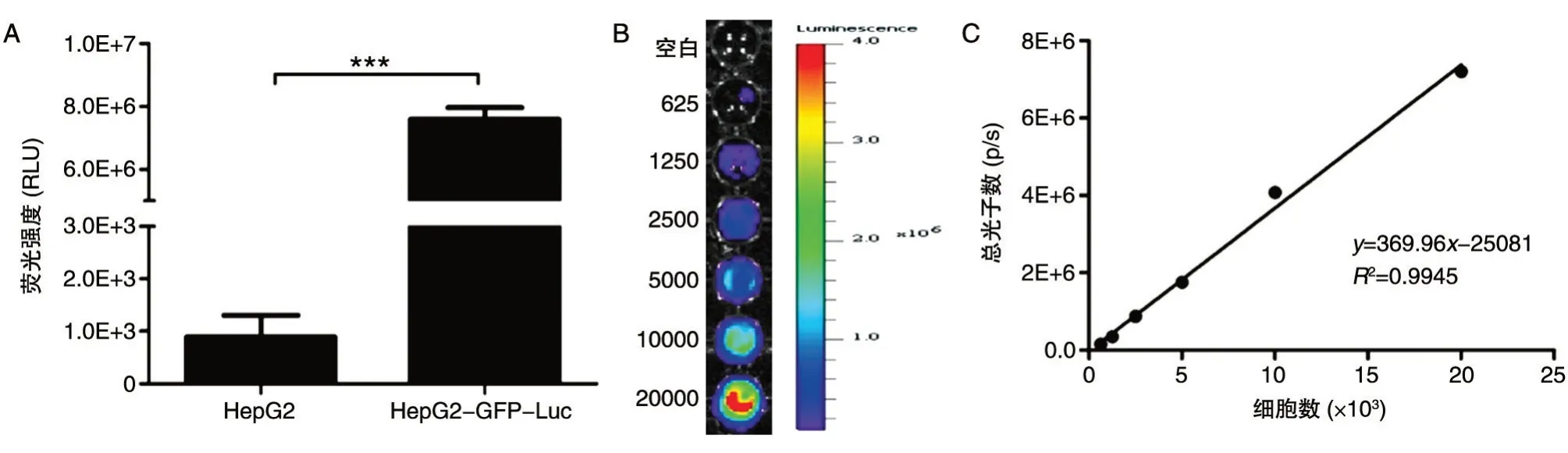
图3 检测HepG2细胞中Luc的表达
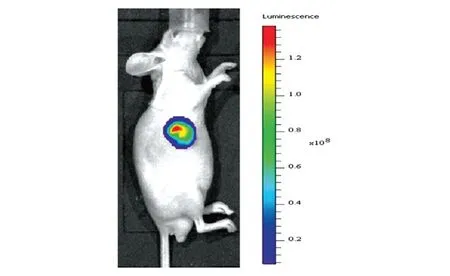
图4 接种2周后裸鼠皮下肿瘤组织活体成像

图5 活体荧光成像检测裸鼠肝细胞癌原位移植模型
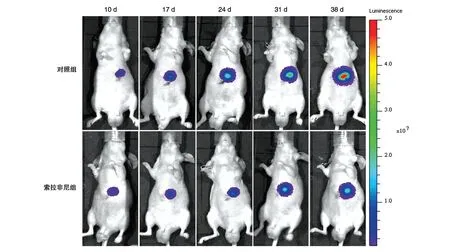
图6 裸鼠肝细胞癌原位移植模型不同时间点活体成像检测

图7 荧光总光子数-时间曲线图

图8 处死裸鼠后解剖分离获得的瘤块

图9 各组裸鼠肝脏肿瘤重量统计
3 讨论
随着对肿瘤研究的不断深入,传统的动物肿瘤模型在肿瘤学研究中受到诸多限制。尤其是原位肿瘤模型实验,要获得特定时间点的肿瘤生长信息必须处死动物,这对动态监测肿瘤生长非常不便。肝癌原位移植模型在肿瘤微环境、形态、转移性及对药物的反应性等方面能够很好地模拟人肝癌发生的情况。但由于其肿瘤病灶发生在肝脏,导致无法有效地对动物体内肿瘤细胞的生长和转移情况进行直接观察及动态监测。因此,实时、可视化并且可进行动态定量分析的肝癌原位模型的建立非常重要。
近年来,由于活体生物发光成像具有高灵敏度、非损伤性、低成本和功能多样性的优点,在小动物模型中的应用迅速增长[11]。经过萤光素酶基因修饰后的细胞可以表达萤光素酶,当给予萤光素酶底物时,此酶在O2、ATP 及Mg2+存在的条件下催化底物荧光素氧化并发光[12-13]。萤光素酶标记的原位肿瘤模型正是利用这一原理实现对动物体内肿瘤大小和转移进行实时观察。与传统模型相比,不仅操作简单,节省了人力物力,还能降低实验成本,可在多个时间点获得相关数据信息,这也是此模型能够在肿瘤研究中广泛应用的重要原因。但是,萤光素酶催化的发光是化学发光,其标记的细胞无法在显微镜下进行观察,使得在建立稳定表达细胞株时无法进行有效的筛选。因此,引入绿色荧光蛋白标签对于目的细胞的筛选与纯化具有非常重要的作用。本研究采用双荧光标记方法,将GFP 与Luc 基因构建到同一种载体上,可使目的细胞同时表达2 种荧光,不仅实现了稳定表达细胞株的筛选与纯化,还能在体内通过加入底物的方法实时、动态检测肿瘤细胞的生长增殖。
建立荧光标记的肿瘤模型关键在于获得稳定遗传并表达荧光的细胞株,慢病毒感染和脂质体转染是最常用的2 种方法。慢病毒载体是在人免疫缺陷病毒(HIV-1)基础上发展而来,是一种属于逆转录病毒科的RNA 病毒。它能在病毒自身的反转录酶和整合酶的作用下将插入的外源基因片段整合到宿主细胞染色体上,感染宿主细胞范围广,感染效率高,并且能长期稳定地遗传和表达[14-15]。而脂质体转染是通过细胞膜融合和胞饮作用将人工脂质体内的质粒导入细胞的一种方法,载体DNA 随机整合,效率低且具有细胞毒性,转染后获得单克隆细胞时间也较长。本研究采用的慢病毒载体是pCDH-GFP-Luc,该载体携带GFP、Luc 和嘌呤霉素基因作为生物标记,能够实现宿主细胞被3 种标签基因同时标记。对慢病毒感染的HepG2 细胞首先进行嘌呤霉素的筛选,可使GFP 阳性细胞达到99%左右,进一步利用流式细胞术筛选,获得高度纯化的pCDH-GFPLuc 稳定表达细胞株。
本研究利用第二代慢病毒感染的方式,构建了稳定表达双荧光(GFP 和Luc)的肝癌细胞系HepG2-GFP-Luc,再通过皮下-原位间接移植方法建立了裸鼠肝细胞癌原位移植模型,并对比对照组和治疗组活体荧光成像结果,证明可以通过活体荧光成像技术在不同时间对该模型裸鼠体内肝细胞癌的生长变化直接观察、记录,发光信号强弱能够反映体内肿瘤大小变化,进而实现了对肿瘤生长过程的动态定量分析,为抗肝癌药物研发和药效评价提供了重要的科学工具。

